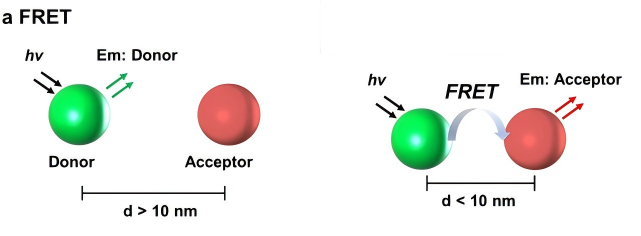
荧光共振能量转移(FRET)是一种依赖于分子间距离的能量转移现象。FRET检测的原理是将两种荧光蛋白分别与两种目的蛋白融合表达,形成荧光供体蛋白与荧光受体蛋白,当两个融合蛋白之间的距离在5-10nm的范围内,则供体发出的荧光可被受体吸收,并激发受体发出荧光,此时通过测量供体荧光强度的损失量来确定这两个蛋白是否相互作用。两个蛋白距离越近,供体所发出的荧光被受体接收的量就越多,检测器所接收到的荧光就越少。
FRET实验流程
1、载体构建:选择合适的荧光分子对(例如CFP和YFP),将要检测的X和Y蛋白分别偶联上CFP和YFP标签,构建CFP-X和Y-YFP融合表达质粒载体;
2、细胞培养:根据实验目的培养特定的细胞用于后续的转染;
3、细胞转染:将表达质粒转染到培养的细胞中;
4、FRET图像采集:按照标准protocol,使用共聚焦显微镜采集图像;
5、FRET数据处理:采用合适的分析方法对FRET数据进行分析和处理。
FRET实验注意事项
01 荧光标签对的选择
FRET 的核心是供体(D)与受体(A)的光谱匹配及光学特性,选择时需注意以下要求:
1、光谱重叠度
供体发射光谱与受体激发光谱的重叠需适中(重叠度越高,FRET 潜力越大),但需避免供体发射与受体发射光谱过度重叠(否则易产生信号串扰,难以区分FRET是否真正发生以及 FRET 的效率高低)。
2、光学特性
供体需高量子产率(减少能量损耗),受体需高消光系数(增强能量吸收);同时,受体自身荧光背景需低(避免 “假阳性”,如 Cy5 较 Cy3 背景更低)。
3、稳定性
探针需耐受实验条件(如光漂白、pH、温度),例如荧光蛋白(如 GFP 变体)比有机染料更耐光漂白,适合活细胞长时间观测;而有机染料(如 Alexa 系列)需避免在高 pH 环境中使用(可能淬灭)。
02 样品制备
样品的标记、浓度及状态直接影响 FRET 信号的真实性,为避免非特异性干扰,制备样本时需注意:
1、标记效率与位置
标记效率需 > 80%(低效率会导致 “游离” 探针过多,干扰信号),可通过 HPLC 或荧光分光光度计验证。标记位置需避免影响分子相互作用(如蛋白质标记在柔性末端,而非活性位点;核酸标记在末端而非碱基配对区)。
2、标记比例
目标分子需避免 “多标记”(如一个分子同时标记 2 个供体 + 1 个受体),否则会因分子内探针近距离产生非特异性 FRET;建议 “1:1 标记”(每个分子仅 1 个供体 + 1 个受体)。
3、样品浓度与聚集
浓度需适中(如蛋白质 1-10μM),过高易导致分子聚集(非特异性 FRET),过低则信号弱(信噪比差),聚集样品需通过离心或稀释处理。
4、缓冲液与杂质
缓冲液需维持分子活性(如生理 pH、离子强度),避免含荧光淬灭剂(如 NaN₃、高浓度 Cl⁻)。需过滤去除灰尘 / 颗粒(减少散射光干扰)。
03 仪器设置
仪器参数直接影响信号的准确性,为保证信号特异性,需针对仪器设置进行优化:
1、激发与发射光选择
激发光需为供体的最佳激发波长(避免直接激发受体,否则受体荧光会被误判为 FRET 信号)。发射光检测需区分供体发射(D 通道)与受体发射(A 通道),通过滤光片或单色仪严格分离。
2、串扰校正
若供体发射与受体发射存在重叠(如 GFP 与 RFP),需通过 “供体单独组” 和 “受体单独组” 计算串扰系数(供体在 A 通道的泄漏率、受体在 D 通道的泄漏率),并在数据分析中扣除。
3、仪器稳定性
温度控制:活细胞或热敏样品需维持恒温(±0.5℃),避免温度波动导致分子构象变化(影响距离)。
光源稳定性:激光或弧光光源需预热(如 10-30 分钟),避免强度漂移;长时间实验需定期校准。
04 数据采集与分析:排除假阳性
1、对照实验设计
阴性对照:供体 + 非相互作用的受体(或空载),验证非特异性 FRET;
阳性对照:已知高 FRET 效率的体系(如共价连接的 D-A 对),验证实验体系有效性;
单独供体 / 受体对照:用于计算串扰系数和背景校正。
2、背景与统计校正
扣除缓冲液背景、散射光(可通过空白组测量);每个细胞FRET检测重复3次,确保结果的准确性。每种转染至少完成6个细胞的FRET检测,保障分析数据充分性。
FRET常见问题分析
01 FRET结果无信号或信号弱
(1)供体与受体距离超出 FRET 范围(>10nm):目标分子未发生相互作用(如蛋白质未结合、构象未变化),或标记位点距离过远;
(2)供体-受体光谱重叠不足,FRET 潜力弱;
(3)标记效率低(<80%):游离的未标记分子过多,参与 FRET 的有效探针少;
(4)仪器参数设置错误:激发波长未对准供体最佳激发峰,或检测通道未覆盖受体敏化发射峰;
(5)荧光漂白过快:供体 / 受体光稳定性差,信号在检测过程中衰减。
02 背景信号过高,掩盖 FRET 特异性信号
(1)样本自发荧光干扰:细胞 / 组织本身的自发荧光(如 NADH、黄素)与受体发射光谱重叠;
(2)游离探针残留:标记后未彻底去除未反应的游离荧光染料,其自发荧光被误判为 FRET 信号;
(3)非特异性结合:标记的探针与其他分子(如杂质、容器壁)非特异性结合,产生背景。
03 信号串扰(Crosstalk)严重,无法区分 FRET 特异性信号
(1)供体发射光谱与受体发射光谱过度重叠,导致供体荧光 “泄漏” 到受体检测通道(供体串扰),或受体自身激发(非 FRET 介导的荧光)被误判为敏化发射(受体串扰);
04 FRET 效率波动大,重复性差
(1)样本浓度不均:标记分子在溶液中聚集或分布不均,导致局部 FRET 效率差异;
(2)实验条件不稳定:温度、pH、离子强度波动影响分子互作(如蛋白质结合依赖 pH);
(3)非特异性 FRET:标记探针与其他杂质(如缓冲液中的蛋白、核酸)非特异性靠近,产生假阳性信号。
05 荧光探针稳定性差(易降解或淬灭)
(1)探针化学稳定性差;
(2)目标分子降解:如蛋白质在高温下变性、核酸被核酸酶降解,导致标记探针脱落。




















 1084
1084

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








