基因治疗概述
基因治疗(Gene Therapy)即基因疗法,是一种利用基因来治疗、预防或治愈疾病或医学病症的技术,其目标是通过针对遗传原因来改变疾病进程。通常,基因疗法的工作原理是添加受损基因的新副本,或者用该基因的健康版本替换患者细胞中的缺陷或缺失基因。目前,遗传性疾病(例如血友病和镰状细胞病)和获得性疾病(例如白血病)都已通过基因疗法取得治疗,其还有望治疗多种疾病,如癌症、囊性纤维化、心脏病、糖尿病、血友病和艾滋病等。当基因突变(DNA序列的永久性改变)导致蛋白质缺失或有缺陷时,通过基因治疗就有可能恢复该蛋白质的正常功能。
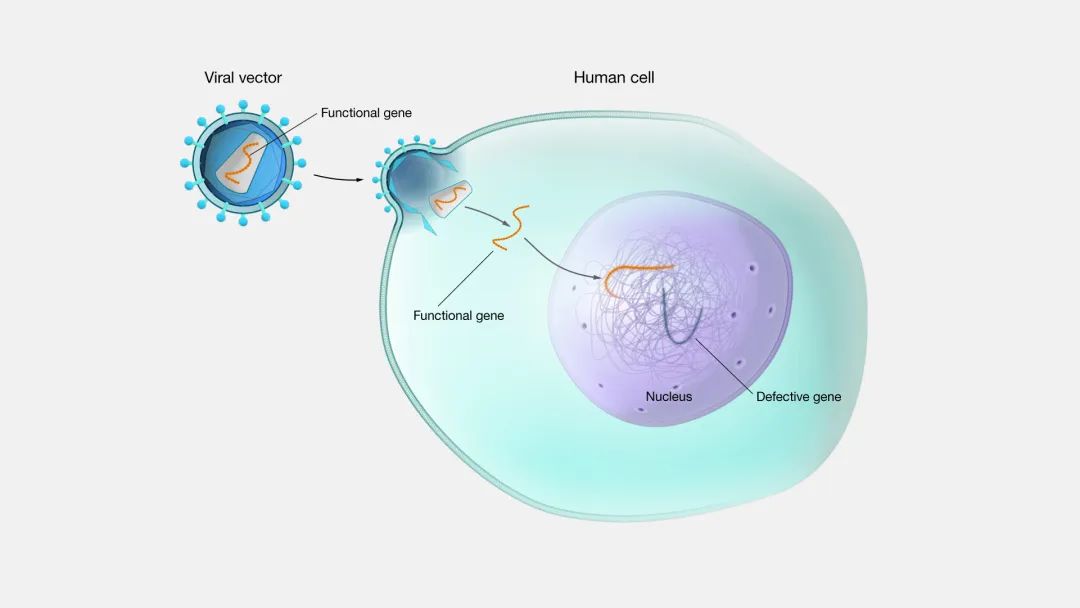
▲ 基因治疗示意图(源自National Human Genome Research Institute)。
目前,基因治疗主要有以下几种不同的机制:引入新的或修改的基因副本、打开或关闭基因以避免疾病、用该基因的健康副本序列替换该基因的致病序列。针对这些机制,已研发出多种类型的基因治疗产品,常见类型如下:
(1)质粒DNA:环状DNA分子可通过基因工程将治疗基因携带到人体细胞中;
(2)病毒载体:病毒具有将遗传物质传递到细胞中的天然能力,因此一些基因治疗产品源自病毒。一旦病毒被修饰以消除其引起传染病的能力,这些修饰的病毒就可以用作载体,将治疗基因携带到人类细胞中;
(3)细菌载体:细菌可经过改造以防止其引起传染病,然后用作载体将治疗基因携带到人体组织中;
(4)基因编辑技术:基因编辑的目标是破坏有害基因或修复突变基因;
(5)患者来源的细胞基因治疗产品:从患者体内取出细胞,进行基因改造(通常使用病毒载体),然后返回患者体内。
自1989年首次实验以来,基因治疗一直是一个活跃的研究领域。经过三十年严格的实验并克服重重障碍,基因疗法终于进入临床。但目前现有的大多数已获批的基因治疗药物仅针对有限的罕见疾病的单基因突变的治疗,还有一些基因疗法成功临床转化的另一个因素是易于在靶组织中施用,例如眼部和造血系统疾病,而基因编辑作为治疗遗传性疾病的方法大多仍停留在实验室阶段。下图为临床基因治疗重大事件的时间表。
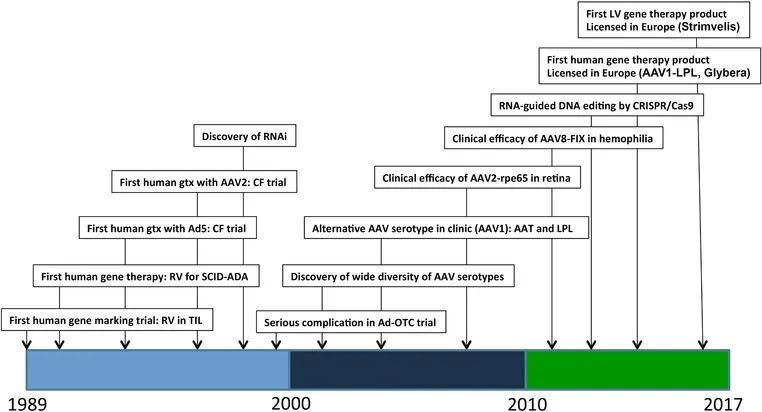
图1 临床基因治疗重大事件的时间表(Keeler et al., 2017)。
迄今为止,全球已有40余种基因治疗产品获批上市,其中包括对神经肌肉疾病、遗传性失明、某些血液癌症等疾病的颠覆性疗法。回顾2022年,就有9种药物获批。可见,基因治疗作为疾病的“治本”疗法,被推上了新药研发的下一个风口浪尖之上。
21世纪以来,基因治疗已成为现代生物医学工程和临床疾病治疗的重要研究方向。在我国,基因治疗于1993年被原卫生部定义,并将其按基因导入人体途径分为:Ex vivo即体外途径(经体外导入外源基因后再用于人体)、In vivo即体内途径(将含外源基因的载体直接注射人体)(图2)。
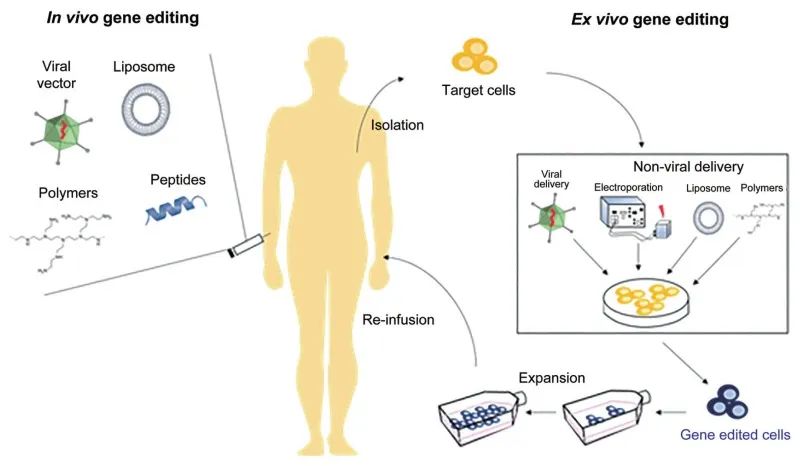
图2 基因治疗方法示意图(Sinclair et al., 2018)。
基因治疗的关键步骤是将基因有效递送至靶组织/细胞,这是通过称为载体的基因递送载体进行的。载体有两种类型:病毒载体和非病毒载体。鉴于非病毒载体缺乏细胞靶向能力以及体内基因转染率较低,目前大多用于体外操作。用于基因治疗的病毒载体的选择取决于待插入基因的大小、靶细胞(分裂或非分裂以及细胞类型)、宿主基因组整合和免疫原性,常见的有逆转录病毒(RV)、慢病毒(LV)、腺病毒(AV)或腺相关病毒(AAV)载体(图3)。
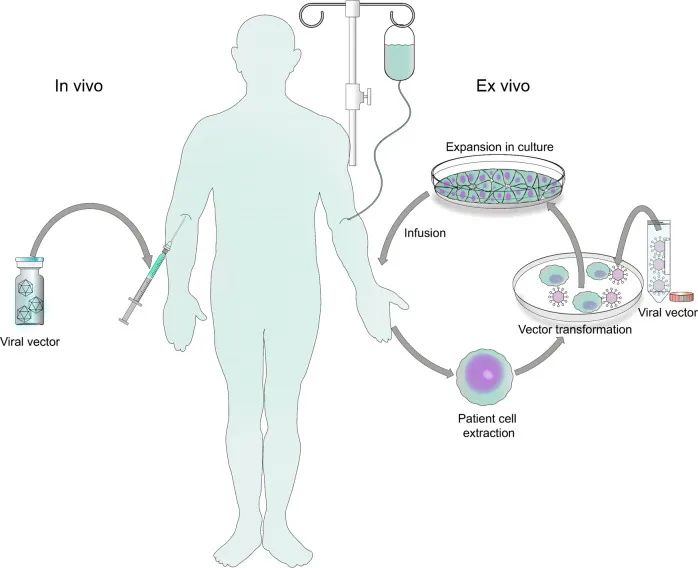
图3 病毒基因治疗方式总结(Bulcha et al., 2021)。
20世纪90年代初,用于体内治疗的Ad载体首次被用于在大鼠肝细胞和肺组织中递送和表达α-1抗胰蛋白酶(A1AT)基因,目前,基于Ad的基因治疗临床试验占全球试验总量的50%,主要应用于新型疫苗和癌症疗法。迄今为止,全球已有三种基于AAV的基因治疗药物(Glybera、Luxturna、Zolgensma)进入商业市场,并且全球已有超过200项基于AAV的临床试验。LV是RV的一种,目前已有十多项已完成的临床试验使用LV载体治疗一系列疾病,包括代谢紊乱、癌症、免疫紊乱和罕见先天性疾病,并且其对于开发CAR-T细胞治疗难治性血液恶性肿瘤至关重要。
基因编辑
随着2020年的诺贝尔化学奖颁给Emmanuelle Charpentier 和Jennifer Doudna,以表彰她们发现的CRISPR/Cas9系统,基因编辑已无可厚非的成为基因治疗发展史上的一大里程碑。下面,小医将针对基因编辑引领的基因疗法新时代展开详细叙述,大家一起来学习下吧!
基因编辑(Gene Editing)是指通过基因编辑技术对生物体基因组特定目标进行修饰的过程。高效而精准的实现基因插入、缺失或替换,从而改变其遗传信息和表现型特征。其与早期的基因工程技术不同处在于,基因编辑是在特定位置插入基因片段,早期的基因工程技术是在宿主的基因组中进行随机插入基因物质。基因编辑原理即利用序列特异性的核酸内切酶,识别并切割基因组中的特定DNA位点,诱导DNA损伤修复,实现对指定基因组的定向编辑,详细而言,基因编辑核酸酶以不同程度的特异性与DNA结合,并产生双链断裂(DSB),这些断裂随后由细胞自身的DNA修复机制进行修复,修复机制包括同源重组(需要内源或外源提供的同源模板)、非同源末端连接(NHEJ)或微同源介导的末端连接(MMEJ)。用于基因编辑的核酸酶的主要类型是ZFN、TALEN和CRISPR/cas9系统(图4)。
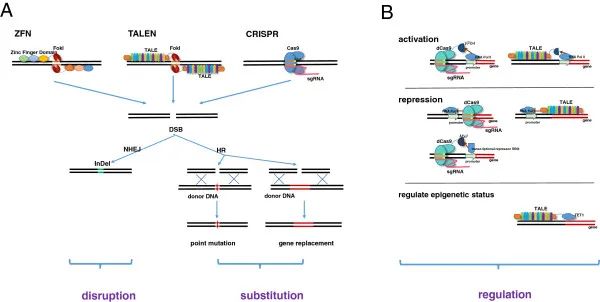
图4 ZFN、TALEN和CRISPR/Cas9的机制(Chen et al., 2014)。
CRISPR基因编辑技术自问世以来,就展现出无可比拟的优势,并深刻改变了基因编辑领域乃至整个生命科学的研究模式。目前,已开发出多种脱靶特异性较低的Cas9变体,如:HF-Cas9、eCas9、HypaCas9以及CRISPR/Cas12(Cpf1)和CRISPR/Cas13a(C2c2),可识别不同的PAM,提供更高的靶向特异性。
近年来,一些基于基因编辑特别是CRISPR系统的基因疗法已进入人体临床试验。基因治疗已被广泛研究用于治疗多种遗传性和获得性疾病,其市场分为恶性肿瘤、溶血性疾病、免疫缺陷性疾病、神经系统疾病、视觉疾病、罕见遗传疾病、心血管疾病和传染病以及少数X连锁疾病。目前,恶性肿瘤和单基因疾病主导着基因治疗的研究和开发。2018年,针对单基因疾病、遗传性失明、某些遗传性神经退行性疾病、代谢性遗传病以及多种骨髓和淋巴结癌的基因疗法获得批准。为了充分发挥CRISPR/Cas9的编辑潜力,必须使用适当的载体将它们成功递送到靶细胞或组织中,各种传输方法见图5。
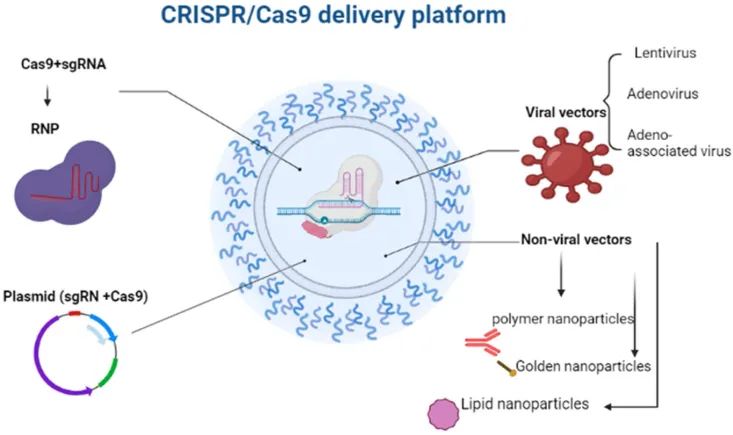
图5 CRISPR/Cas9递送平台(Khoshandam et al., 2023)。
虽然,CRISPR/Cas9是一种很有前途的方法,但其最近在人类中的发现和应用使其在临床研究中应用受限。免疫原性、脱靶、突变、递送技术和伦理是CRISPR/Cas9技术的主要困难(图6)。

图6 在临床环境中利用 CRISPR-Cas 的主要挑战和可能的方法(Morshedzadeh et al., 2023)。
人类癌症基因工程小鼠模型(GEMM)是分析肿瘤发生的原子成分的必要工具。利用AV载体通过物理方法将CRISPR/Cas9转移到细胞中,可促进特定的染色体改善,从而产生Eml4-Alk驱动的肺癌小鼠模型,扩展了研究人员开发人类癌症模型的方式。因此,AV载体已被用来改进针对非酒精性脂肪性肝炎(NASH)小鼠PTEN的基因编辑技术,为在小鼠中模拟人类肝脏疾病提供了一种新策略。
近年来,随着分子生物学、载体技术和转基因技术的进步,为基因治疗疾病开辟了新途径。在生命早期,免疫系统会接触天然存在的AAV,从而激活T细胞反应并对这些血清型产生免疫力,由于AAV基因治疗的局限性,最近的临床试验强调了这种免疫力(图7)。研究表明,rAAV载体安全,能够转染广泛的宿主细胞,能够有效介导外源基因在多种细胞中长期稳定表达,而不表达任何病毒蛋白基因。
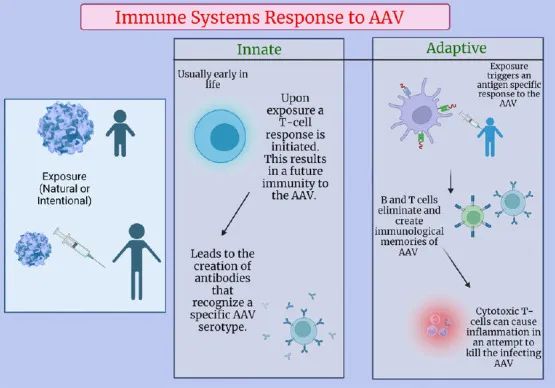
图7 免疫系统对AAV暴露的反应(Rouse et al., 2024)。
据报道,在小鼠模型中使用AAV8作为基因治疗载体可长期纠正A型血友病、家族性高胆固醇血症和II型糖原累积病。越来越多的研究表明,携带外源基因的重组AAV载体可以在体内长期稳定表达,以对抗促肿瘤生长因子。虽然AAV介导的基因治疗临床试验逐年增多,为进一步验证载体的安全性和有效性提供了有力支撑,但长期监测仍需完善,以实现更高的转导效率、更低的免疫反应和可预测的治疗结果。因此,充分利用AAV基因治疗的前景并克服当前的挑战,以促进rAAV8系统在人类疾病研究中的应用至关重要。
基因编辑与肿瘤治疗
目前针对恶性肿瘤治疗的基因组编辑策略主要为:改造CAR-T细胞以提高效率,以及沉默特定致癌基因以促进/诱导肿瘤细胞死亡。在大多数CAR-T系统中,肿瘤细胞的识别取决于CAR的生物分布。鉴于肿瘤生长环境与缺氧密切相关,近年来,通过将CAR与ODD HIF结构域(ODD-CAR)融合,创建缺氧依赖性分子“开关”工程T细胞膜上的ODD-CAR研究火热。研究人员除了在CAR C末端融合ODD序列之外,还在CAR启动子中引入了HRE串联重复,从而创建了“HypoxiCAR T”系统(HiCAR T)(图8)。并已在体外和体内得到证明,克服了两个主要限制,即对CAR表达的更严格控制和更强的抗肿瘤活性,且没有明显的在靶/脱瘤毒性。
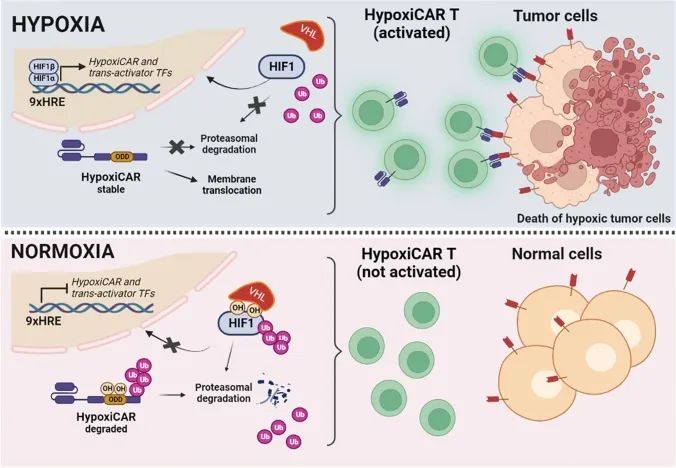
图8 缺氧敏感的CAR-T激活机制(Stampone et al., 2023)。
有学者提出,将反式激活系统Gal4-UAS(上游激活序列)转变为氧依赖性系统,与常氧/生理氧相比,在缺氧条件下可显著增加CAR的表达,在反式激活子的启动子区域引入了多个HRE序列,形成HIF对CAR和反式激活子表达的双向控制,创造了“HiTA-CAR T”系统,即一种双向缺氧诱导的转录扩增系统,提高了CAR-T的安全性。与HiCART或HiTA-CAR T不同,一些缺氧激活的前药(HAP)系统虽已进入了临床试验阶段,甚至可与放疗和化疗联合使用,但还未通过临床批准,需要进一步研究。
参考文献
Bulcha JT, Wang Y, Ma H, Tai PWL, Gao G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 2021;6(1):53.
Chen L, Tang L, Xiang H, et al. Advances in genome editing technology and its promising application in evolutionary and ecological studies. Gigascience. 2014;3:24.
Keeler AM, ElMallah MK, Flotte TR. Gene Therapy 2017: Progress and Future Directions. Clin Transl Sci. 2017;10(4):242-248.
Khoshandam M, Soltaninejad H, Mousazadeh M, Hamidieh AA, Hosseinkhani S. Clinical applications of the CRISPR/Cas9 genome-editing system: Delivery options and challenges in precision medicine.. 2023;11(1):268-282.
Morshedzadeh F, Ghanei M, Lotfi M, et al. An Update on the Application of CRISPR Technology in Clinical Practice. Mol Biotechnol. 2023;1-19.
Rouse CJ, Jensen VN, Heldermon CD. Mucopolysaccharidosis type IIIB: a current review and exploration of the AAV therapy landscape. Neural Regen Res. 2024;19(2):355-359.
Sinclair A, Islam S, Jones S. Gene Therapy: An Overview of Approved and Pipeline Technologies. In: CADTH Issues in Emerging Health Technologies. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; March 1, 2018.1-23.
Stampone E, Bencivenga D, Capellupo MC, et al. Genome editing and cancer therapy: handling the hypoxia-responsive pathway as a promising strategy. Cell Mol Life Sci. 2023;80(8):220.




















 2749
2749

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








