这周,我们就来看几个具体的的案例,讲一讲这个技术在实际研究中是如何应用的。
案例1
2023年,Yanting Su等人在期刊BMC Genomics上发表了(IF=4.4)题为“Study of FOXO1-interacting proteins using TurboID-based proximity labeling technology”的文章。文章采用基于TurboID的邻近标记技术筛选并验证了与FOXO1相互作用的蛋白。TurboID作为一种生物素连接酶,具有比BioID或APEX更高的催化效率,可将所需的标记时间从18h减少到10min。由于许多蛋白质参与的结合和催化事件都是非常短暂的,因此理论上可以使用TurboID技术找到相对较新的结合蛋白。

研究背景
近年来,随着生活质量提高,糖尿病成为一种常见疾病,2型糖尿病(T2DM)的标志是胰岛素抵抗和β细胞功能损害。在T2DM中,β细胞功能障碍可通过多种方式诱导,从而导致细胞凋亡、增殖受限、自噬、β细胞去分化等不良后果。而叉头转录因子1(FOXO1)参与上述机制,并能发挥相应功能。
转录因子FOXO家族由于其广泛存在,可以抑制肿瘤增殖,调节能量代谢,诱导细胞反应,并有助于调节人类抗衰老。其中FOXO1因其复杂的活性被认为在许多转录中起着关键的调控作用,是重要的转录因子,可以调控许多靶点,如参与凋亡和自噬的基因、抗氧化酶、细胞周期阻滞基因、代谢和免疫调节等。然而,FOXO1在许多疾病发生发展中的机制尚不清楚,甚至相互矛盾。因此,深入研究FOXO1信号通路对于开发多种靶向药物具有重要意义。
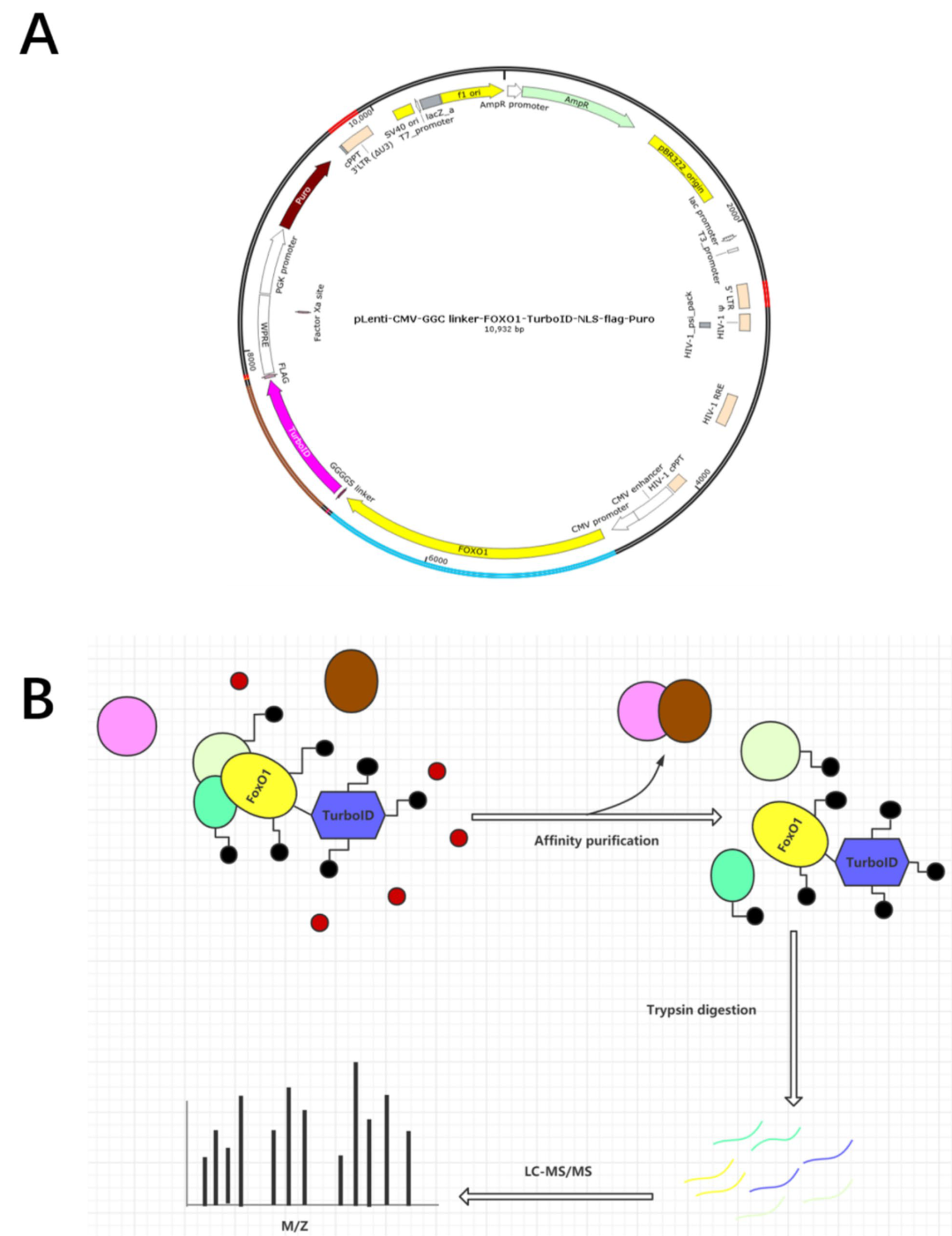
图1 过表达质粒的构建与TurboID标记流程图。
研究思路
(1)构建FOXO1-TurboID融合基因过表达慢病毒载体,采用慢病毒包装构建稳定表达FOXO1的U251细胞系;
(2)筛选生物素标记的时间(0min、10min、1h、3h、6和12h);
(3)使用TurboID邻近标记技术对邻近蛋白进行生物素共价标记;
(4)将生物素标记的蛋白进行亲和纯化,并用银染法鉴定具有生物素亲和力的蛋白;
(5)将银染鉴定后的蛋白进行无标记定量蛋白质质谱分析;
(6)通过对质谱结果进行GO和KEGG分析,发现FOXO1过表达组中多个差异蛋白与多种疾病相关;
(7)根据研究目的,选择两个蛋白hnRNPK和RBM14与FOXO1进行免疫沉淀(IP)和免疫荧光(IF)互作验证。
研究结果
采用TurboID技术筛选出与FOXO1相互作用的蛋白,在去除空白组(EGFP-U251)中鉴定出的蛋白后,在两个阳性组(FOXO1-U251和LPS处理的FOXO1-U251)中均发现了大量互作蛋白,且验证了其中两种,为进一步研究FOXO1的功能及其参与的调控网络奠定了基础。
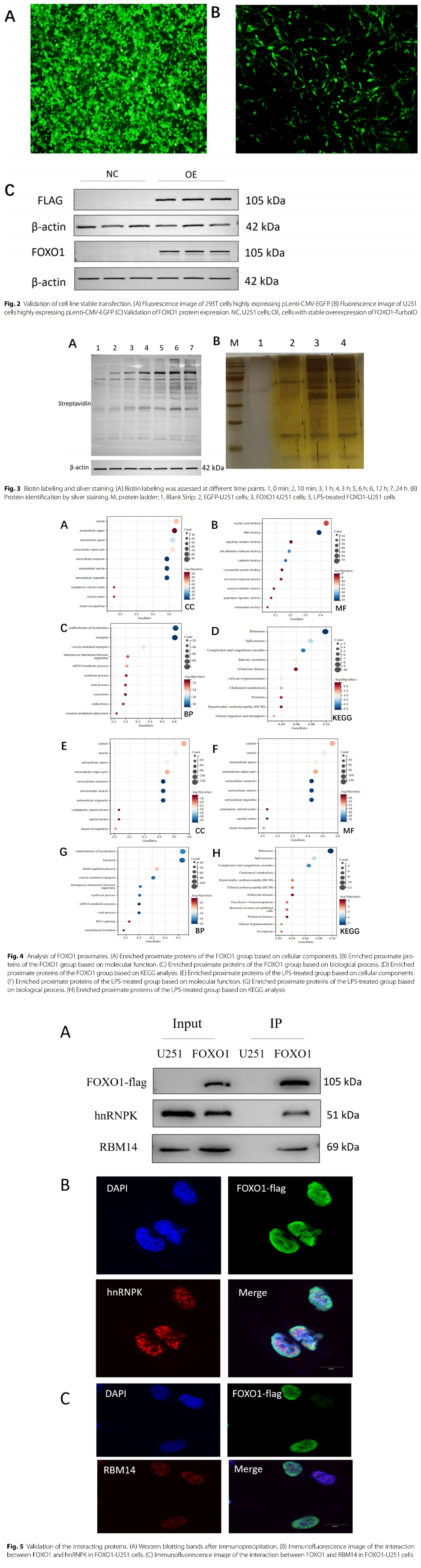
图2 案例1研究结果展示图。
案例2
2022年,Fujian Lu等人在期刊Nature communications发表了(IF=16.6)题为“CMYA5 establishes cardiac dyad architecture and positioning”的文章。该文章在小鼠心脏中使用基于BioID的邻近标记技术,并结合蛋白质组学鉴定在dyads附近富集的蛋白质,通过差异蛋白分析,找到一种横纹肌蛋白(CMYA5),并证明了CMYA5将连接肌浆网锚定到Z线、建立二元结构并调节二元Ca2+释放,为心肌病发病机制提供了见解。

研究背景
心肌细胞是形式和功能的整合,心脏兴奋-收缩(E-C)耦合需要dyads,即T小管与连接肌浆网(jSR)并列形成的纳米微域结构。T小管是由质膜形成的高度有序的小管内陷,可穿透心肌细胞内部,并允许动作电位在整个心肌细胞内部快速传递。肌节以端到端连接的形式在被称为Z线的结构上形成肌原纤维,驱动心肌细胞收缩,有力的心肌细胞收缩需要整个细胞中单个肌节的协调激活。jSR是肌浆网(SR)的一种特化结构。dyads二分体结构和功能的破坏是病变心肌细胞的共同特征。然而,对于T小管、肌节和jSR如何在心肌细胞内以及彼此之间达到复杂的纳米级组织,是心脏生物学中的一个基本谜团。
CMYA5(心肌病相关蛋白5)是三方基序超家族(TRIM)的成员,该家族包含四个保守顺序的蛋白质-蛋白质相互作用结构域(RING、BBox1、BBox2和卷曲螺旋),通常作为大型蛋白复合物的一部分发挥作用,被认为与心肌病有关。然而没有详细研究CMYA5敲除对二元体形成、结构和功能的影响。
研究思路
将BirA*融合到junctin(BirA*-ASPH)或triadin(BirA*-TRDN)的n端,跨膜jSR蛋白与RYR2形成复合物,使用腺相关病毒血清型9(AAV9)和心肌肌钙蛋白T(Tnnt2)启动子进行AAV包装,将AAV施用于P1小鼠,从P21到P28提供生物素并在P28取材小鼠心脏,使用固定的链霉亲和素纯化生物素化蛋白质,然后进行质谱分析。根据结果,鉴定到在dyads附近最富集的二元蛋白质是CMYA5,然后利用CRISPR/Cas9构建CMYA5敲除小鼠模型,通过RT-PCR、WB、活细胞成像、免疫荧光分析和转录组测序技术等方法进行CMYA5与心脏功能关系的研究。
研究结果
通过将BirA*定位到二元间隙,二元蛋白被生物素化,之后在链霉亲和素的作用下被纯化,经过蛋白质谱的方法进行筛选,鉴定出BioID组中含量最高的蛋白质之一是CMYA5,将它与jSR蛋白RYR2在成熟的心肌细胞中以条纹模式共定位,能观察到呈条纹图案的明亮的点状PLA信号,标记了CMYA5和RYR2非常接近的基因座,表明CMYA5是一种与RYR2密切相关的二元蛋白。再根据一系列实验对CMYA5进行详细研究,揭示了它是正常心脏功能所必须的,对二元组装的分层和发育有序过程具有重大贡献,其中CMYA5将jSR连接到Z线并随后添加T小管,通过增强E-C耦合的保真度和限制自发的RYR2 Ca2+来调节二元功能释放,同时能够保护二元结构和功能免受生物力学压力。所有结果均表明CMYA5是组织dyads的jSR和T小管组件所必需的,并且对于面对生物力学压力时心肌细胞的结构和功能完整性至关重要。
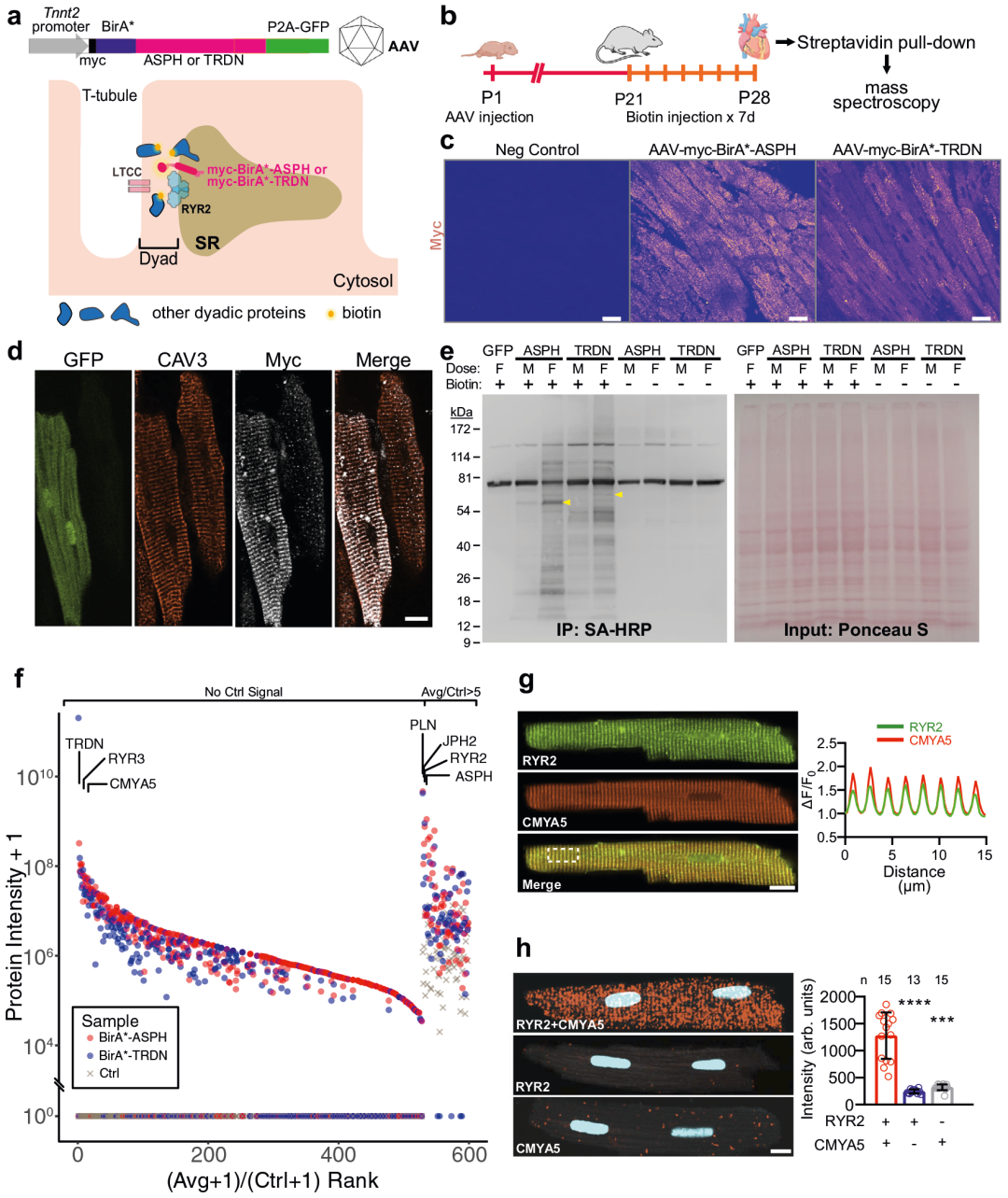
图3 dyadic蛋白质的BioID鉴定。
案例3
2023年,Sammy El-Mansi等人在期刊Blood发表了(IF=20.3)题为“Proximity proteomics identifies septins and PAK2 as decisive regulators of actomyosin-mediated expulsion of von Willebrand factor”的文章。该文章将APEX2邻近标记与创新的双重功能缺失筛选相结合,以识别与肌动球蛋白环功能相关的蛋白,鉴定出septin和PAK2是肌动球蛋白介导的血管性血友病因子排出的决定性调节因子。这种新的分子机制为控制血栓性疾病提供了新型治疗靶点,并且与使用胞外肌动球蛋白机制的其他分泌系统高度相关。

研究背景
超大糖蛋白血管性血友病因子(VWF)会在组织损伤几秒钟内,从内皮储存细胞器(Weibel−Paladebody,WPB)释放到血管腔内,从而导致血小板募集。VWF多聚体的巨大体量给内皮细胞(ECs)的分泌机制带来前所未有的负担。EC已经进化出了克服这一问题的机制,最典型的是一个具有形成、收缩和挤压的肌动球蛋白环。抑制这些结构的形成或功能是血栓性疾病的一个新的治疗靶点,但是表征与这种动态过程相关的蛋白质一直具有挑战性。
研究思路
通过将APEX2融合到Rab27a,并将其靶向WPB表面,在60s标记期后,用生物素标记邻近蛋白,经过邻近蛋白质组学分析和共聚焦显微镜研究VWF释放相关蛋白,通过双siRNA敲低、蛋白质谱分析和WB研究VWF释放相关信号通路,通过免疫荧光和WB研究胞吐中septin的募集,再通过药理学抑制和siRNA敲低研究肌动球蛋白环动力学,最后再通过WB和共聚焦显微镜研究septin释放与VWF释放。
研究结果
APEX2邻近标记与创新的双重功能缺失筛选相结合,鉴定出与肌动球蛋白环功能相关的蛋白质,WPB融合导致septin环的募集,septin环的募集依赖于PKA2的活性,PKA2是VWF释放的潜在上游信号分子,PKA2或septin的抑制作用导致VWF释放效率低下,无法形成血小板捕获串。这阐明了与体外和体内VWF释放相关的基本信号传导通路及septin在肌动球蛋白调节的胞吐中的新作用,对于理解内皮细胞如何控制止血以及肌动球蛋白涂层如何控制调节的分泌,具有重要的临床学意义。
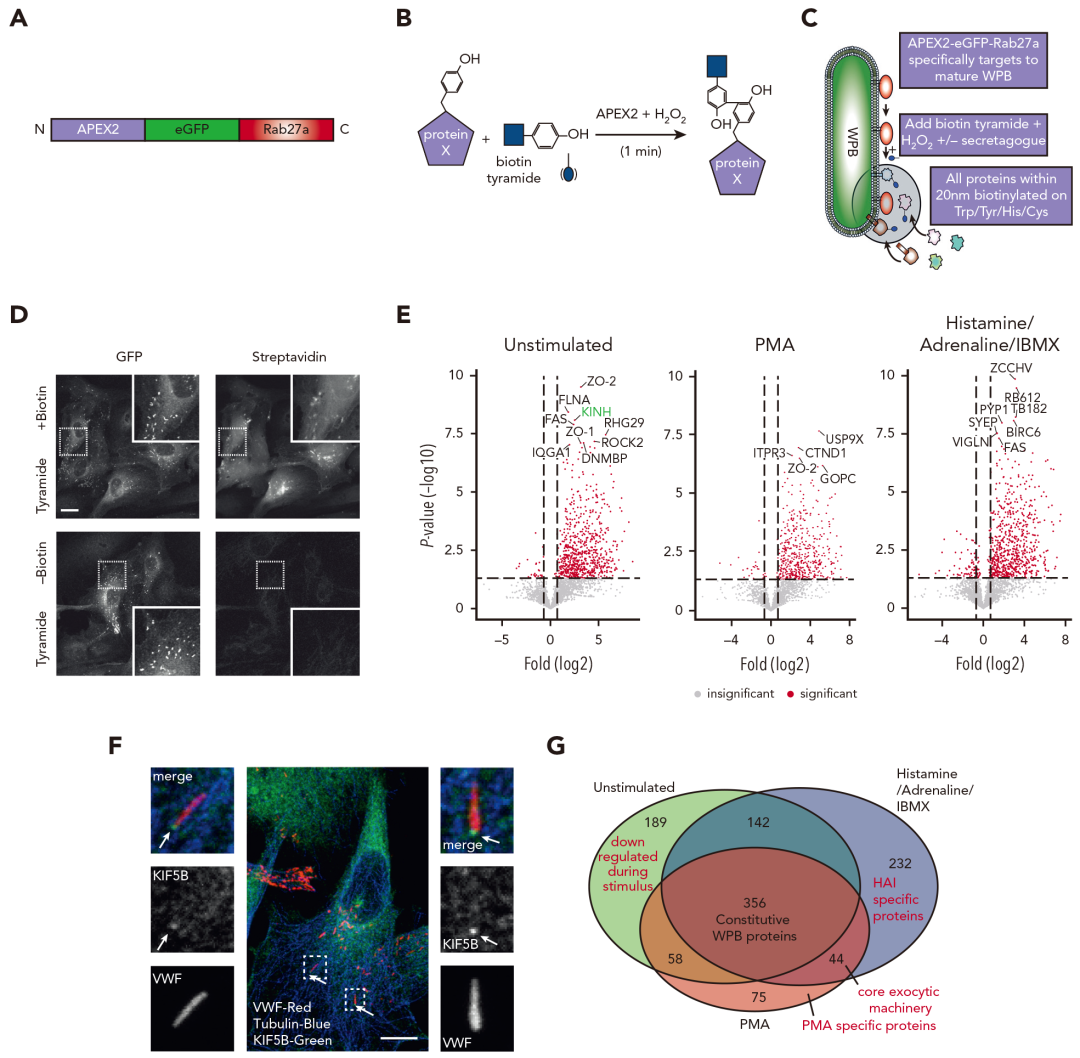
图4 邻近蛋白质组学揭示了新的WPB相关机制。
参考文献
El-Mansi S, Robinson C L, Kostelnik K B, et al. Proximity proteomics identifies septins and PAK2 as decisive regulators of actomyosin-mediated expulsion of von Willebrand factor[J]. Blood, The Journal of the American Society of Hematology, 2023, 141(8): 930-944.
Fujian L,Qing M,Wenjun X, et al. CMYA5 establishes cardiac dyad architecture and positioning[J]. Nature Communications, 2022,13(1).
Yanting S, Yuanyuan G, Jieyu G, et al. Study of FOXO1-interacting proteins using TurboID-based proximity labeling technology.[J]. BMC genomics, 2023,24(1).




















 989
989

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








