医疗器械的注册信息不仅是产品合法上市的 “身份证”,更是企业市场布局、医疗机构采购审核、监管部门风险防控的关键依据。随着全球医疗贸易的深化,不同国家和地区的监管体系差异显著,精准掌握官方查询途径成为突破市场壁垒的核心能力。本文系统梳理国内外医疗器械产品及注册信息的查询途径,覆盖全球超 40 个国家及地区,为行业提供实用指南。
中国
中国对医疗器械实行 “注册 + 备案” 双轨管理,查询渠道按监管层级、产品类型及特殊区域精准划分。
国家药品监督管理局(NMPA)
作为权威查询入口,涵盖一二三类医疗器械注册/备案信息,包括国产、进口以及历史注册产品数据。
https://www.nmpa.gov.cn/datasearch/home-index.html#category=ylqx
根据《医疗器械注册与备案管理办法》规定,我国对医疗器械实行分类注册,一类产品实行备案管理,二三类医疗器械均为注册制度。注册制度又分为境内及进口两大类,除境内二类医疗器械由地方药监局审查,其余均为国家药监局直管。
所以在查询医疗器械信息的时候需要确认自己查询的产品是属于境内的还是进口的,是注册的还是备案的,然后再进入对应数据库进行查询。
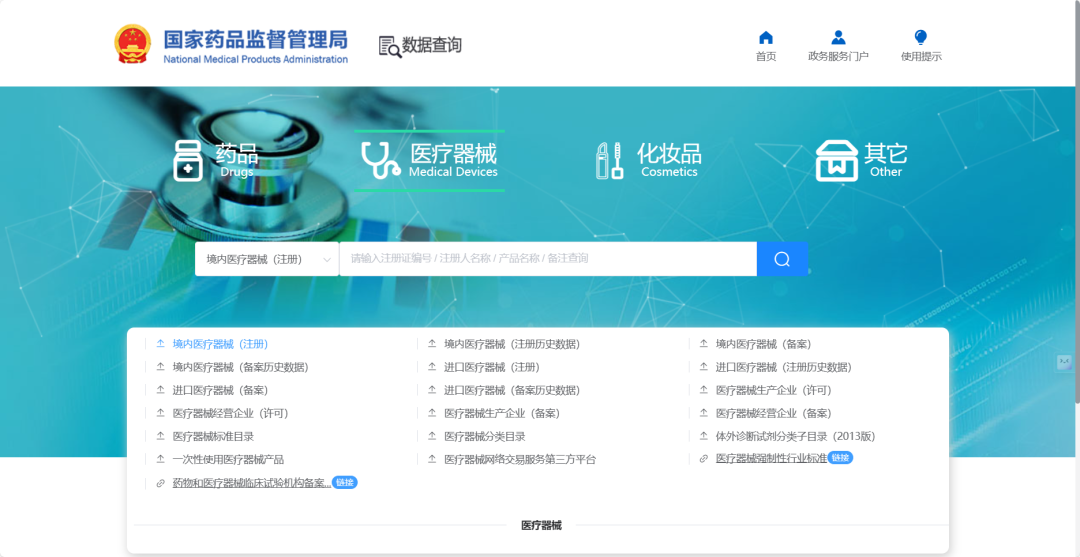
其检索字段主要包括注册证备案编号、注册人名称、产品名称等为数不多的基础字段。数据库支持高级检索,例如可以对注册人名称和产品名称同时检索,以得到精准的结果。
关键提示:注册证编号中 “准” 代表国产、“进” 代表进口、“许” 代表港澳台地区产品,第五位数字区分管理类别(1为一类、2为二类、3为三类)。
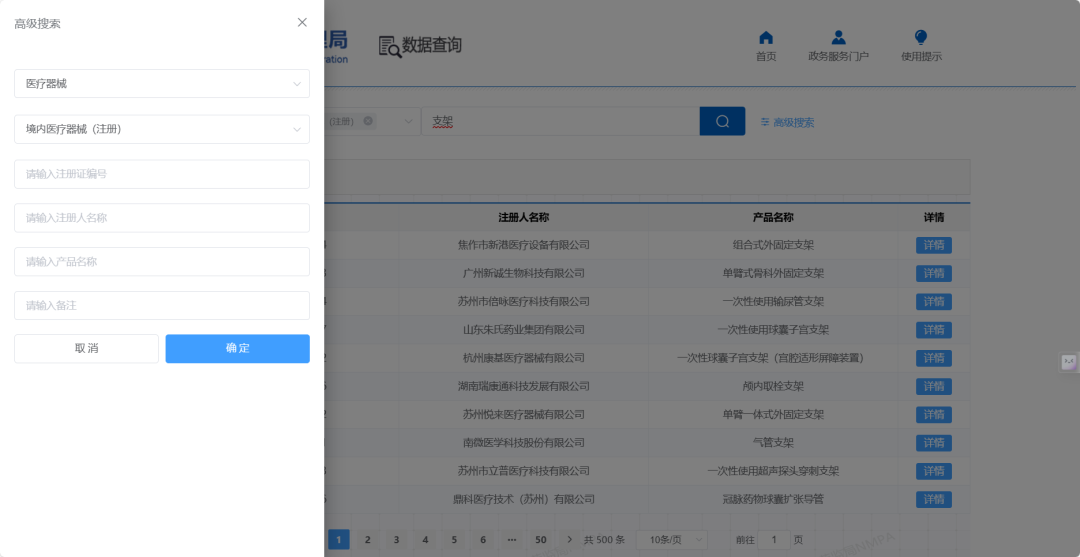
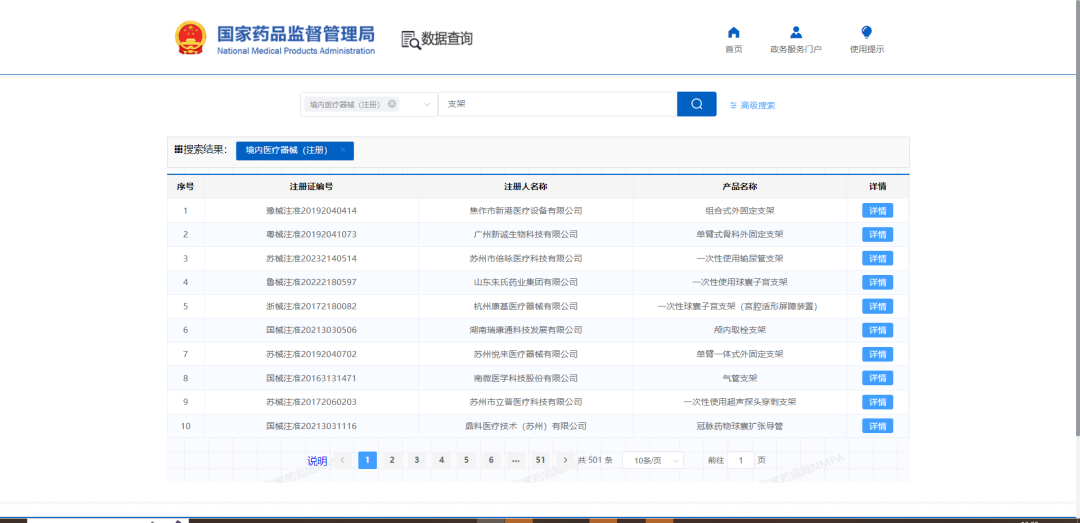
检索结果的列表页展示字段不多,包括序号、注册证编号、注册人名称、产品名称、详情。
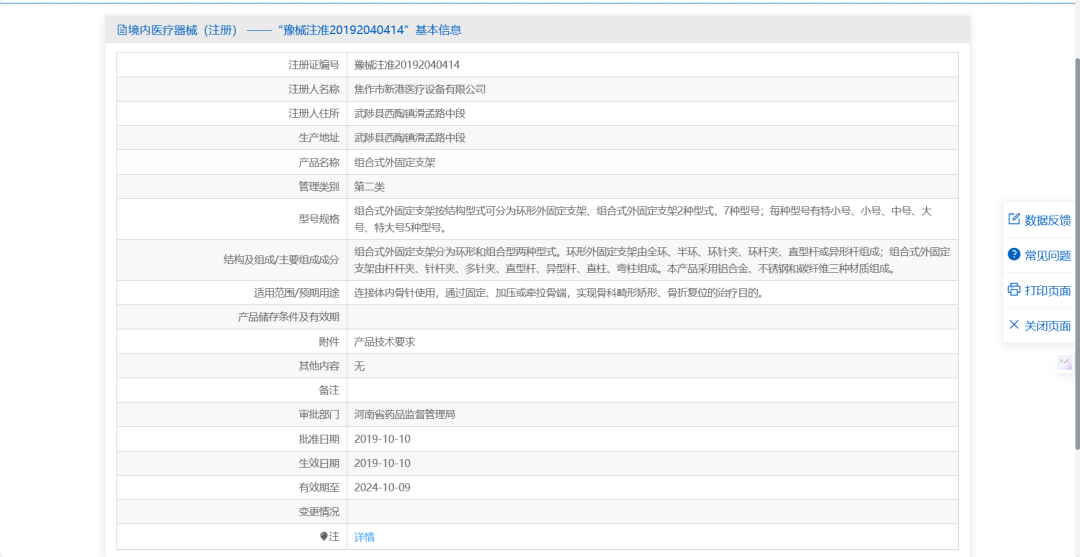
点击列表页中每条数据后面的详情按钮可进入相关产品的详情页,详情页中展示了产品名称、注册证编号、注册人名称、管理类别、型号规格、适用范围/预期用途等字段。
地方监管渠道
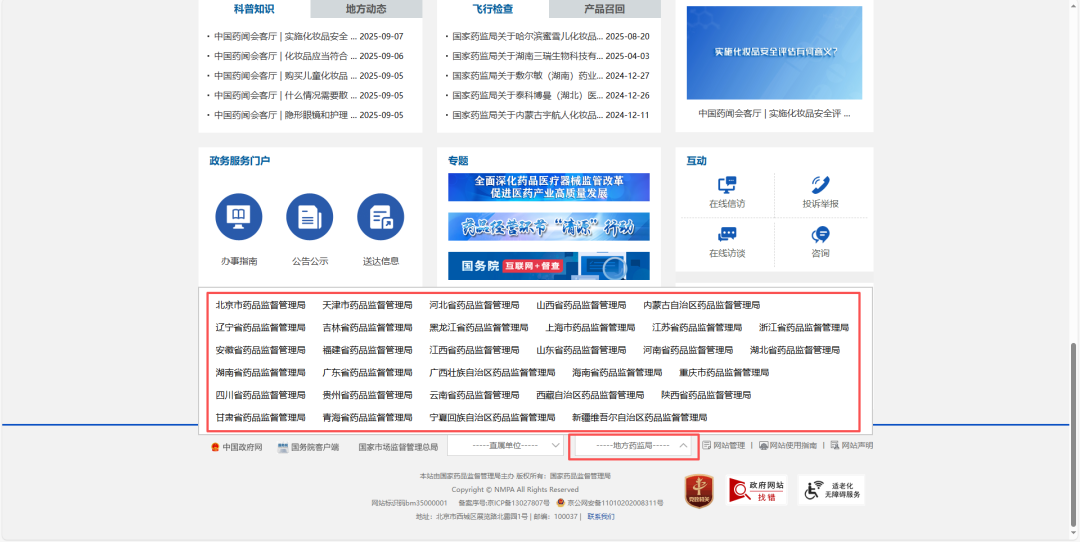
值得注意的是,由于境内一类及二类医疗器械由地方药监局进行审查管理,审查通过的医疗器械注册证编号会先录入当地数据库再由地方药监局向国家药监局主动报送,可能会造成国家药监局数据库更新不及时的情况。对于这部分信息,可以到各个省市的药品监督管理局网站进行查询。
相关网址在国家药品监督管理局官网(https://www.nmpa.gov.cn/)底部“地方药监局”区域有罗列展示,点击即可访问对应省市药监局官网。
其他
中国香港:卫生署医疗器械科
https://www.mdd.gov.hk/sc/mdacs/search-database/list-md/index.html
中国澳门:暂未找到澳门注册医疗器械查询的公开数据库,以下列出其药监局和卫生局官网,如果有知道澳门注册医疗器械查询途径的,欢迎评论区或私信给我进行补充。
药物监督管理局:https://www.isaf.gov.mo/cn
卫生局:https://www.ssm.gov.mo/portal/
中国台湾:食品药物管理署(TFDA)医疗器材许可证数据库
https://lmspiq.fda.gov.tw/web/MDPIQ/MDPIQLicSearch
总体来说,通过官网查询可以得到真实权威的数据信息,特别是NMPA将多个数据库集中在一起提供查询,对用户而言也相对也比较方便。不过因为缺少适用范围、结构组成等字段的检索功能,且查询到的数据无法直接导出,因此相关官方数据库大多只限于基数信息查询验证,不太适合于调研分析。
全球
药智医械数据(国内外上市医疗器械产品查询与分析)
药智医械数据提供了医疗器械从研发到市场,从产品到企业的全生命周期数据,其中“上市产品”版块包含中国、美国、英国、法国、日本等全球十多个国家和地区的上市医疗器械数据库,数据总量超千万条。
网址:https://qx.yaozh.com
除了数据汇集的优势,相关数据库还拥有更加完善的检索与分析功能。
其中最为完善的是其上市器械筛选系统数据库,支持产品名称、企业名称、结构组成、适用范围、科室分类、是否延续注册、创新优先审批、临床路径类别、带量采购、医保耗材分类等近40种检索与筛选功能。
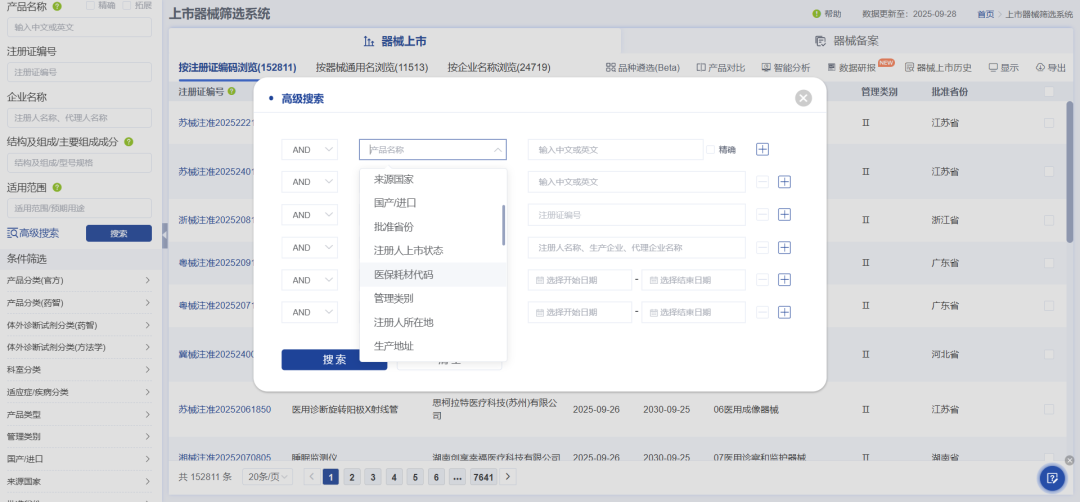
数据库支持通用名搜索,能全面检索相关产品,搜索结果涵盖器械名称、注册证编号、注册人名称、结构及组成/主要组成成分、适用范围/预期用途、批准日期、有效期等近20个维度的数据信息,并支持对检索结果一键导出,以便再次分析或其他用途。
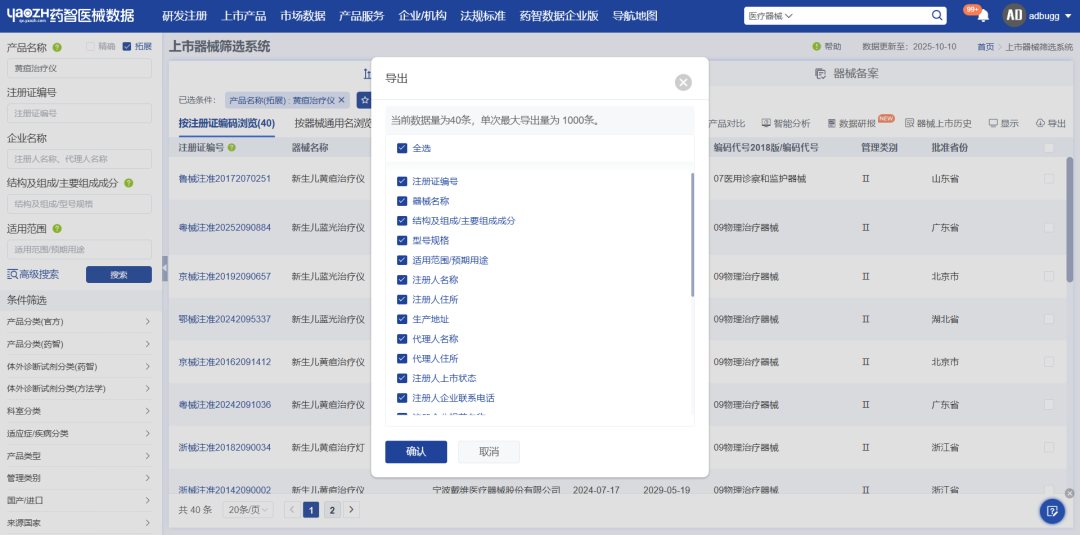
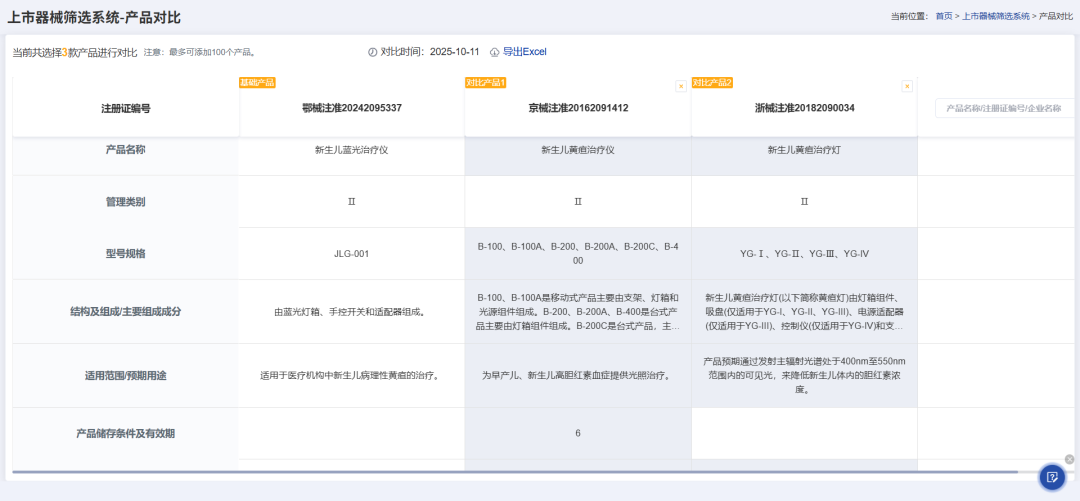
此外,还可以一键对多个产品进行横向对比,这让我们进行产品结构组成、适用范围等信息对比时更加便捷。
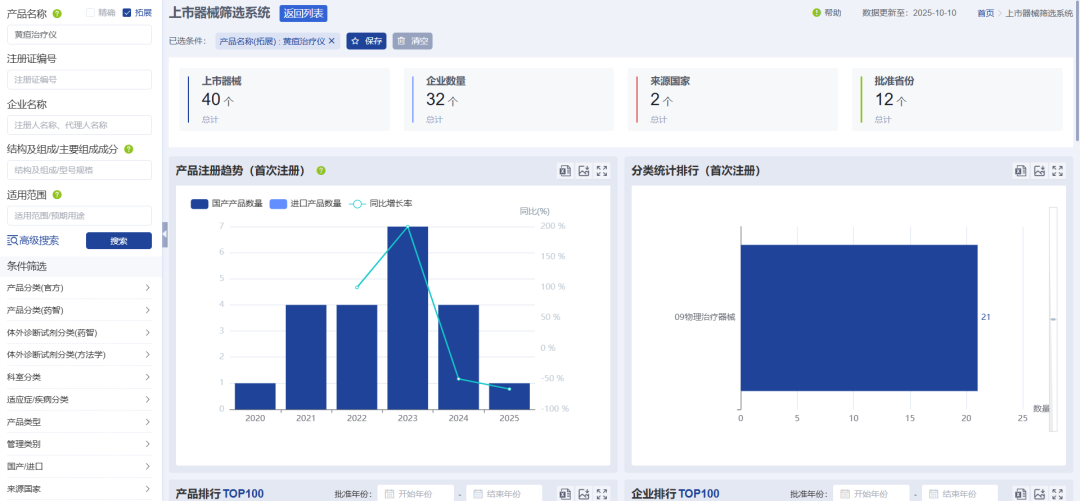
再一个就是智能分析功能,可以根据检索结果一键生成十多个可视化分析图表,直观呈现产品注册、分类、企业、带量采购、科室、适用症等多个维度的趋势、分布、排行、占比等情况。
总体而言,药智医械数据整合了全球多个国家和地区的数据,并且在官方数据基础上,拥有更为丰富的检索及分析功能,较适合对行业、产品、企业等进行调研分析使用。
美国
美国FDA对医疗器械的分类与中国管理类别基本一致,主要分为三类,一类伤害最低的采取列名方式,二类采取510(k)进行对比,三类进行PMA注册。
在FDA官网Medical Devices版块(https://www.fda.gov/medical-devices),下滑至“Search Medical Device Databases”栏,选择“All Medical Device Databases”可进入所有医疗器械数据库导航页。
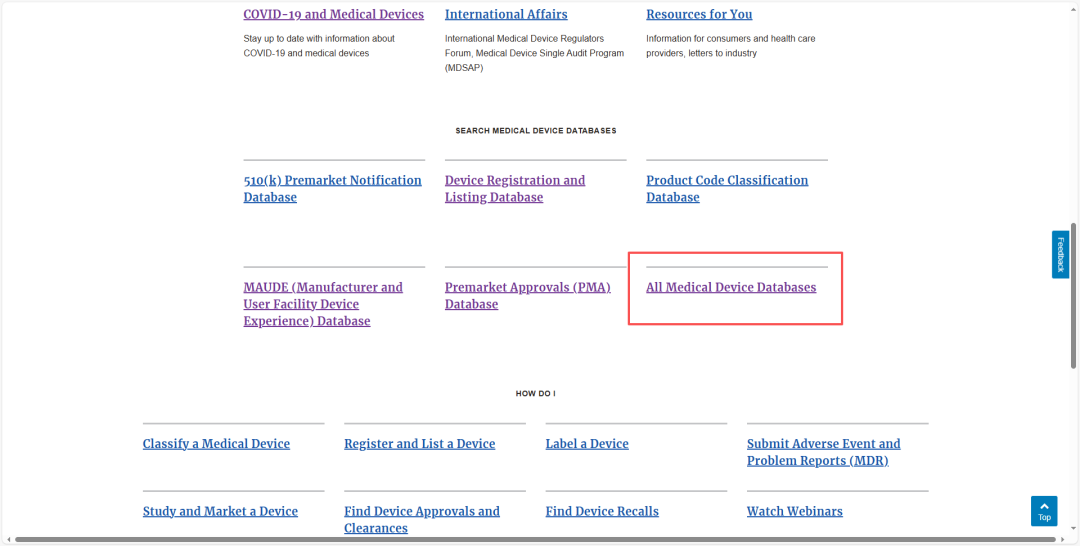
https://www.fda.gov/medical-devices/device-advice-comprehensive-regulatory-assistance/medical-device-databases
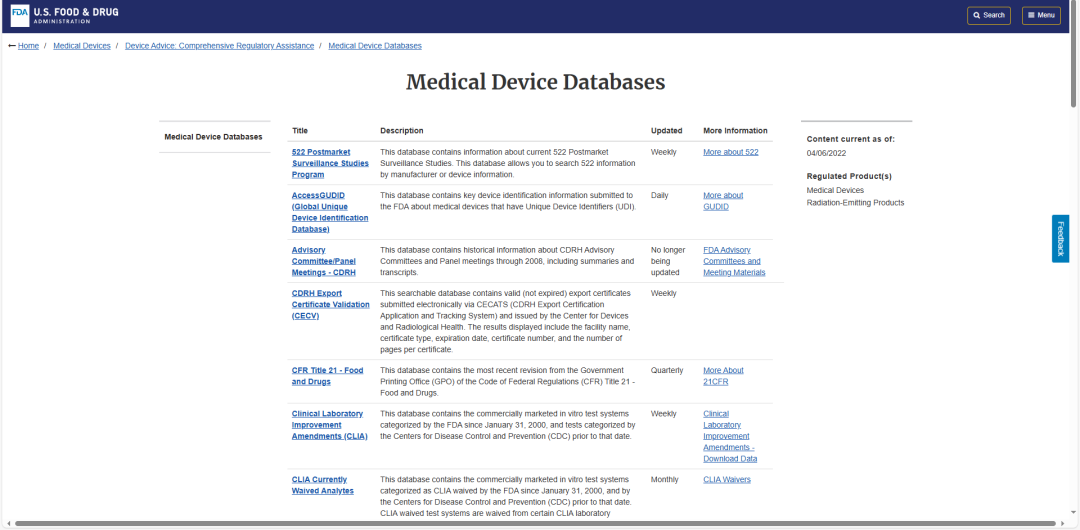
导航页中有很多数据库,例如:
AccessGUDID (Global Unique Device Identification Database):FDA唯一医疗器械产品标识符UDI,全球唯一设备标识数据库
Devices@ FDA:是FDA批准和许可的医疗器械信息目录,企业可以通过产品名称或者公司名字搜索FDA批准或者许可的器械。包含510(k)及PMA数据库。
Premarket Notifications (510(k)s):PMN-510(k)上市前通知,通过510(k)路径申请上市的医疗器械产品均可在此数据库查询。可以按510(k)编号、申请人、设备名称或 FDA 产品代码进行搜索。
Premarket Approvals (PMA):PMA-上市前批准,包含了通过PMA(预先市场批准)途径获得FDA批准的医疗器械信息,可查询器械名称、分类、批准日期等。
De Novo:已批准和已许可的新型中低风险器械产品
欧盟
EUDAMED 数据库
欧盟在 MDR 2017/745 法规框架下,以 EUDAMED 为核心数据库,同时保留成员国查询渠道。
https://ec.europa.eu/tools/eudamed/#/screen/search-eo
其他国家
法国:国家药品与健康产品安全局(ANSM)
https://archive.ansm.sante.fr/Produits-de-sante/Dispositifs-medicaux
英国:英国药监机构 MHRA
https://pard.mhra.gov.uk/
德国:德国卫生部 DIMDI
查询前需注册与支付费用:https://user.dimdi.de/neo/products.xhtml
查询链接:https://auth.bfarm.de/auth/realms/wirk/login-actions/authenticate?client_id=MPI-OFF&tab_id=Q0C8lfcmUtk
西班牙:AEMPS
https://www.aemps.gob.es/productos-sanitarios/
葡萄牙:葡萄牙国家药品和医疗产品管理局(INFARMED)
https://www.infarmed.pt/web/infarmed/pesquisa-dispositivos
意大利:卫生部
https://www.salute.gov.it/new/it/banche-dati/elenco-delle-apparecchiature-sanitarie/
捷克:
https://eregpublicsecure.ksrzis.cz/Registr/RZPRO/ZdravotnickyProstredek
瑞士:瑞士治疗器械机构(Swissmedic)
https://www.swissmedic.ch/swissmedic/en/home/medical-devices.html
土耳其:药品和医疗器械管理局(TMMDA)
https://www.titck.gov.tr/
俄罗斯:俄罗斯联邦食品药品监督管理局
https://roszdravnadzor.gov.ru
哈萨克斯坦:卫生部药品中心(NDDA)
https://www.ndda.kz/mainpage/mi
摩尔多瓦:药监局(MMDA)
https://amdm.gov.md/en
白俄罗斯:卫生部药品监管司
https://minzdrav.gov.by/
塞尔维亚:药品和医疗器械局(ALIMS)
https://www.alims.gov.rs/english/
挪威:药品局(Medicines Agency)
https://www.dmp.no/en/medical-devices
冰岛:食品药品管理局(MFSA)
https://www.ima.is/medical-devices/
罗马尼亚:罗马尼亚国家药品和医疗器械局 ANMDMR
https://dispozitive.anm.ro/f1f2-display
加拿大:加拿大卫生部 HC
https://health-products.canada.ca/mdall-limh/index-eng.jsp
墨西哥:联邦健康风险保护委员会(COFEPRIS)
https://www.gob.mx/cofepris
古巴:国家药品和医疗器械控制中心(CECMED)
https://www.cecmed.cu/
巴西:巴西国家卫生监督局 ANVISA
https://consultas.anvisa.gov.br/#/saude/
阿根廷:阿根廷国家食品药品及医疗技术管理局 ANMAT
https://helena.anmat.gob.ar/Boletin/
秘鲁:国家卫生局(DIGEMID)
https://www.digemid.minsa.gob.pe/webDigemid/registro-sanitario/dispositivos-medicos/
智利:国家药品管理局(ISP-ANAMED)
https://www.ispch.cl/
日本:日本独立行政法人医药品医疗器械综合机构 PMDA
https://www.pmda.go.jp/english/review-services/reviews/approved-information/devices/0001.html
韩国:韩国食品医药品安全管理局 MFDS
https://www.mfds.Go.kr/eng/brd/m_41/list.do
新加坡:新加坡卫生科学局 HSA
https://www.hsa.gov.sg/medical-devices/
泰国:食品药品监督管理局(FDA)
https://porta.fda.moph.go.th/FDA_SEARCH_ALL/MAIN/SEARCH_CENTER_MAIN.aspx
马来西亚:马来西亚医疗器械管理监督局 MDA
https://mdar.mda.gov.my/frontend/web/index.php%3Fr%3Dcarian
印尼:
https://infoalkes.kemkes.go.id/
菲律宾:菲律宾食品药品管理局
https://verification.fda.gov.ph/medical_deviceslist.PHP
缅甸:食品药品监督管理局
https://www.fda.gov.mm/?cat=13
印度:药品管理局(CDSCO),之前可以查到,目前貌似系统更换,网址暂时打不开
https://cdsco.gov.in/opencms/opencms/en/Medical-Device-Diagnostics/Medical-Device-Diagnostics/
沙特阿拉伯:食品药品监督管理局(SFDA)
https://www.sfda.gov.sa/en/medical-equipment-list
阿联酋:卫生和预防部(MOHAP)
https://mohap.gov.ae/en/registered-medical-product-directory
巴林:国家卫生监管局(NHRA)
https://www.nhra.bh/Departments/MDR/
黎巴嫩:公共卫生部
https://www.moph.gov.lb/en/Pages/4/8262/list-of-registered-implantable-medical-devices-at-moph
南非:卫生产品监管局(SAHPRA)
https://www.sahpra.org.za/medical-devices-licences-issued/
卢旺达:食品药品管理局(Rwanda FDA)
https://www.rwandafda.gov.rw/
澳大利亚:治疗用品管理局 TGA
https://www.tga.gov.au/resources/artg
新西兰:药品和医疗器械安全局(Medsafe)
https://www.medsafe.govt.nz/




















 3121
3121

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








