灭菌对硅基植入式医疗设备用超薄膜聚合物涂层的影响
摘要
用于医疗器械应用的新型生物材料必须在外科手术准备的所有阶段(包括灭菌)保持稳定。关于灭菌对适用于硅基人工器官的亚10纳米厚度聚合物表面涂层影响的研究信息十分匮乏。本研究探讨了五种标准灭菌方法对三种涂覆于硅表面的涂层的影响:聚乙二醇(PEG)、聚(磺基甜菜碱甲基丙烯酸酯)(pSBMA)和聚(2‐甲基丙烯酰氧乙基磷酸胆碱)(pMPC)。对经高压蒸汽灭菌、干热、过氧化氢(H2O2)等离子体、环氧乙烷气体(EtO)和电子束(E‐beam)处理的涂层进行分析,以确定灭菌可能导致的聚合物降解情况。灭菌后,PEG、pSBMA和pMPC的接触角发生显著变化,最大变化分别来自H2O2(D2148)、高压蒸汽灭菌(D1158)和干热(D1238)处理。PEG‐硅经高压蒸汽灭菌和EtO处理、pSBMA‐硅经E‐beam处理以及pMPC‐硅经EtO处理后,涂层厚度变化均小于5%。H2O2处理导致所有涂层的厚度至少减少30%。酶联免疫吸附测定显示,经过所有灭菌方法处理后,pMPC‐硅的蛋白质吸附显著增加。在每种涂层子集中,PEG‐硅的电子束处理和pSBMA‐硅的干热处理表现出最大的蛋白质吸附。总体而言,数据表明高压蒸汽灭菌和环氧乙烷处理适用于PEG‐硅,而电子束处理最适合pSBMA‐硅。pMPC‐硅受环氧乙烷处理的影响最小。H2O2处理对所有三种涂层均产生负面影响。这些结果可用于确定体内设备应采用哪些表面修饰和灭菌工艺。
关键词
硅,灭菌,超薄两性离子聚合物(磷酸胆碱,磺基甜菜碱甲基丙烯酸酯),聚乙二醇,防污表面涂层
引言
基于硅的设备因其可精确定义的微米和纳米级特征、低单位成本以及与微电子技术的集成能力,正日益成为可植入式医疗应用中极具吸引力的选择。这些设备包括神经假体用微电极、1可控药物递送系统、2,3用于细胞移植的免疫隔离腔、4–8以及用于肾脏替代治疗的过滤膜。9,10此类应用使硅材料直接接触体液,包括血液。根据美国疾病控制与预防中心(CDC)的规定,任何接触无菌生物液体的医疗器械均被归类为“关键物品”,必须进行灭菌处理。对于植入物,相关指南要求达到无菌保证水平10 26,这相当于每百万个孢子中有一个孢子在灭菌过程中存活的概率。该水平可通过多种物理和化学过程实现:高温暴露、化学和化学等离子体暴露以及辐射。11尽管这些处理方法可以消除微生物和孢子,但其强烈的特性可能导致医疗器械组件发生交联、键断裂和/或氧化,可能对功能化表面造成不可接受的损伤。
我们的团队率先开发了硅纳米孔膜(SNM)技术,用于研制人工器官,包括可植入人工肾9,12,13和人工胰腺7,如图1所示。该人工肾采用均匀的、小于10纳米的狭缝形状在硅基底上形成的孔隙,构成了一种高渗透性和选择性膜,能够实现溶质的对流清除,类似于健康肾脏中功能正常的肾小球。在人工胰腺中,纳米多孔硅膜(SNM)为包封的胰岛提供免疫隔离,保护其免受宿主免疫因子的影响,同时允许葡萄糖、胰岛素和其他小分子通过。
人工器官中SNM的生物相容性对于其在体内的成功运行至关重要。为此,可通过应用超薄聚合物涂层来增强硅的生物相容性,这些涂层可最大限度地减少生物污染以及基底材料的后续降解。14–17针对我们的人工器官,正在研究三种不同的表面修饰方法,这些方法因其亲水性和可控的聚合度而被选用:聚乙二醇(PEG)、聚磺基甜菜碱甲基丙烯酸酯(pSBMA)和聚(2‐甲基丙烯酰氧乙基磷酸胆碱)(pMPC)。PEG是一种广泛使用的抗污表面修饰材料。16 ,18–24理论上,PEG链形成一种保持水合状态的刷状层,从而产生空间排斥作用。14,25 pSBMA和pMPC是两性离子聚合物刷,也表现出优异的抗污性能。15 ,26–29这些仿生聚合物能够以一种抵抗蛋白质和细胞粘附的方式协调水分子。30
尽管硅本身可能不受高压蒸汽灭菌和伽马辐射等传统灭菌技术的影响,但灭菌对应用于硅表面的薄膜聚合物涂层的影响尚未得到充分表征。其他研究已报道了灭菌对水凝胶、交联聚合物以及厚度大几个数量级的表面修饰的影响。然而,据我们所知,尚无关于灭菌对小于10纳米厚的聚乙二醇(PEG)、聚磺基甜菜碱甲基丙烯酸酯(pSBMA)和聚磷酸胆碱甲基丙烯酸酯(pMPC)刷状聚合物结构影响的报道。因此,本研究旨在探讨常用灭菌方式对涂覆有PEG、pSBMA和pMPC的硅材料的影响。所用样品通过美国疾病控制与预防中心(CDC)认可的五种技术进行灭菌:高压蒸汽灭菌、干热、过氧化氢(H 2 O 2 )等离子体、环氧乙烷(EtO)气体和电子束(E‐beam)辐照。我们采用多种表面表征工具来分析灭菌引起的物理和化学效应。通过X射线光电子能谱(XPS)测定表面的化学组成;通过水接触角评估润湿性的变化;并通过聚合物厚度的变化评估使用椭圆偏振法测量。这三项测试共同为我们提供了关于聚合物链构象变化和/或降解的信息。最后,通过酶联免疫吸附测定(ELISA)测量了灭菌前后蛋白质抗性变化。
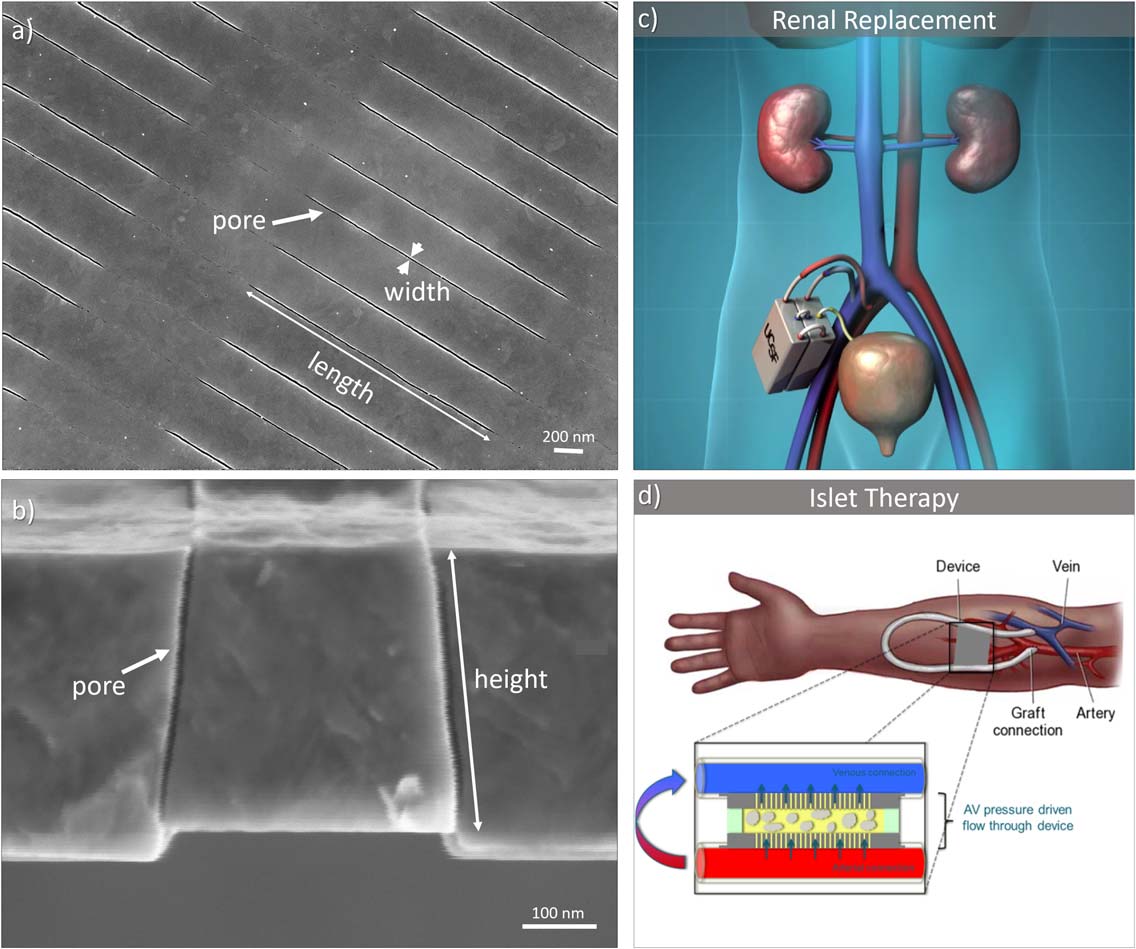
材料与方法
样品制备
从加利福尼亚州海沃德的Ultrasil公司获得双面抛光、400 毫米厚的P型硅片,并将其切割成1 cm²的硅芯片。硅芯片用“piranha”溶液(硫酸(96%)与过氧化氢(30%)按 3:1比例混合)清洗20分钟。随后,将其暴露于氢氟酸中5分钟,以去除在接触大气氧时硅表面自发形成的二氧化硅,然后通过另一次piranha清洗活化表面。最后,用氮气将硅芯片吹干,并立即用于表面改性。
表面改性
聚乙二醇表面改性
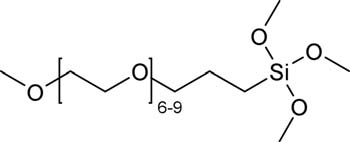
硅表面的聚乙二醇改性按先前所述方法进行。7,13简而言之,将基底在110°C的热板上干燥1小时。2‐[甲氧基(聚乙二醇)丙基]三甲氧基硅烷(PEG‐硅烷)(见表I)购自Gelest公司(宾夕法尼亚州莫里斯维尔),通过将基底浸入含有285 mL PEG‐硅烷的25 mL甲苯溶液中,在70°C下反应2小时,使其共价键合到硅表面。随后,基底分别用甲苯、乙醇和水依次冲洗三次,每次间隔10分钟,以去除多余的聚乙二醇。
两性离子表面改性
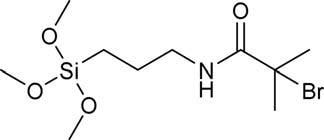
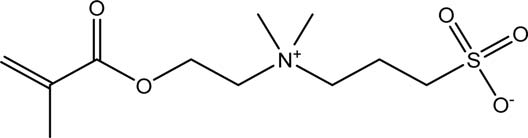
所有化学品均购自Sigma‐Aldrich公司(密苏里州圣路易斯),除非另有说明。两性离子表面改性按照先前发表的方法进行。35简而言之,如表I所示,合成了表面引发剂2‐溴‐2‐甲基‐N‐3[(三甲氧基硅基)丙基]‐丙酰胺(BrTMOS)。35将基底置于双环己基中的1% (v/v) BrTMOS溶液中反应2小时,然后依次用氯仿、乙醇和水冲洗表面,以去除多余的BrTMOS。2‐(甲基丙烯酰氧基)乙基]二甲基‐(3‐磺丙基)铵羟化物(SBMA)和2‐甲基丙烯酰氧乙基磷酸胆碱(MPC)分别如表I所示。将468 mg(3 mmol)去质子化的2,20‐联吡啶(98%)以及各自的单体——SBMA:1.06 g(3.8 mmol),MPC:506 mg(1.9 mmol)——和22.3 mg(0.1 mmol)溴化铜(II)(99%)溶于5:5 mL的甲醇:水混合溶液中配制成脱气溶液。将该混合物加入含有四个基底的反应室中,并加入143 mg(1 mmol)溴化亚铜(I)(99.999%),在氮气保护下进行聚合反应,pSBMA反应时间为15分钟,pMPC为7分钟。随后,基底依次用氯仿、乙醇、杜氏磷酸盐缓冲液(D‐PBS,加州大学旧金山分校细胞培养中心,加利福尼亚州旧金山)、水冲洗,并用氮气流干燥。
灭菌过程
评估了五种灭菌过程。高压蒸汽灭菌使用STERIS Amsco Century SV‐120 科学预真空灭菌器(俄亥俄州曼多),将基底暴露于高压蒸汽中,在121°C下持续30分钟。干热灭菌是将基底置于160°C的烘箱中加热2小时。36 H 2 O 2 等离子体处理使用STERRAD V R 100S 灭菌系统(标准循环)进行。环氧乙烷气体处理由D 2 EO(加利福尼亚州圣何塞)进行,在132毫巴和55°C条件下暴露2小时。最后,电子束灭菌由 STERIS(加利福尼亚州佩塔卢马)进行,施加的剂量范围为21.0 至21.9千戈瑞。
表面表征
X射线光电子能谱
使用表面科学仪器S‐Probe光谱仪配合单色化铝Ka X射线束进行X射线光电子能谱分析。采用150电子伏特的通能获取全扫描和高分辨率谱图。样品被加压至 <5 × 10⁻⁹ Torr,并使用0°起飞角,对应采样深度约为10 纳米。对每个样品,在三个位置进行X射线光电子能谱测量,光斑尺寸约为800微米。元素组成计算采用俄勒冈州本德的 Service Physics Hawk 7版本软件完成。
接触角
表面亲水性的变化采用静态液滴接触角测量法(Biolin Scientific,瑞典斯德哥尔摩 Attenzion Theta Lite)进行测量。在空气中将约3.5毫升的水滴置于基底上,测量液滴与基底之间的接触角。每0.1秒采集一次数据,持续10秒,然后取平均值。每个样品子集共采集六个数据点。
椭圆偏振法
表面涂层厚度使用LSE斯托克斯椭偏仪(Gaertner Scientific,伊利诺伊州斯科基)进行测量,采用 6328埃HeNe激光器,入射角为70°。将测得的反射和透射数据代入菲涅耳方程,并结合已知的折射率,通过迭代求解透明薄膜的厚度。对于两性离子和聚乙二醇表面涂层,均采用1.45的折射率。35尽管灭菌过程可能导致聚合物内部发生构象变化和交联,但仍假设折射率保持不变。空间均匀性通过在每组样品的三个独立芯片上各测量三个位置来表征。共进行九次测量,取平均值并报告平均值和标准差。
酶联免疫吸附测定
将基底在37°C下于含1毫克/毫升浓度人血清白蛋白(HSA)的D‐PBS溶液中孵育90分钟,以评估其抗蛋白质吸附性。采用已发表的方法通过酶联免疫吸附试验(ELISA)测定表面蛋白质浓度。27,35简言之,HSA孵育后,所有基底用0.5 mL D‐PBS清洗五次,并用牛血清白蛋白37 (98%,Sigma‐Aldrich公司)在1毫克/毫升浓度下封闭1.5小时。随后将基底用0.5 mL D‐PBS清洗五次,并转移至新的孔板中。样品接着与10微克/毫升辣根过氧化物酶标记的抗HSA抗体在37°C下孵育1.5小时(Abcam,马萨诸塞州剑桥)。再次清洗(用0.5 mL D‐PBS清洗五次)后,基底重新清洗并转移至新的孔板中。加入含有0.5毫克/毫升邻苯二胺(VWR公司,加利福尼亚州维萨利亚)和0.03%过氧化氢的0.05M柠檬酸磷酸盐缓冲液(pH 5.0, Sigma‐Aldrich公司),反应在铝箔避光条件下于37°C进行20分钟,然后通过加入0.5 mL 1M的溶液终止反应。硫酸。在490纳米处测量溶液的光吸收率。每种样品类型均进行三次测试,并减去背景值(未添加人血清白蛋白的对照组)。所有人血清白蛋白蛋白吸附数据均以组织培养用聚苯乙烯(TCPS)为阳性对照进行归一化处理。
统计分析
每次分析中,每种样品至少采集三次测量数据。由于仅在每种涂层子集中进行比较,因此采用普通单因素方差分析确定统计显著性。显著性水平定义为 p< 0.05。分析使用 Graphpad Prism软件(加利福尼亚州圣地亚哥)进行。
结果
X射线光电子能谱
图S1(支持信息)展示了每种未灭菌基底类型的X射线光电子能谱(XPS)宽扫谱的比较。图S2(a–d)展示了各种灭菌方法处理后每种表面修饰的相应谱图,元素组成总结于表II 中。高分辨率X射线光电子能谱数据示例见表SI。如预期所示,在所有情况下均观察到分别来自单晶硅基底和天然二氧化硅的Si 2p(100电子伏特)和O 1s(528电子伏特)峰。未经修饰(未涂层)的硅还显示出约8%的偶然碳污染,但经H2O2等离子体处理的基底除外,其碳含量约为16%。经过H2O2等离子体处理后,未修饰硅表现出较高的氧含量,并检测到氮、钠和氟的存在。由于这些杂质元素在其他基底上并未显著存在,其出现可能是由于样品操作不当所致。除 H2O2处理的样品外,高分辨率数据显示灭菌与未灭菌硅基底之间结晶硅和二氧化硅含量变化为<5%。
对于聚乙二醇偶联硅,Si 2p 的浓度降低了约12%,而 O 1s和 C 1s分别增加了约3%和11%。高分辨率数据(表 S1)显示,碳含量的增加主要归因于C–O键的增加,这在聚乙二醇涂层中是预期的结果。25灭菌后,碳含量略有下降,下降范围约为11%至16%,相比之下未灭菌样品的下降约为 18%。除干热处理样品外,碳含量的降低主要体现在C–O键的减少。总体而言,干热处理后的样品中C–O键最多,而 H2O2等离子体灭菌的样品中C–O键最少。然而,所有灭菌后基底中C–O键的百分比仍高于未经修饰的硅,表明所有灭菌后基底上均存在一定量的聚乙二醇。
与未改性的硅相比,接枝聚磺基甜菜碱甲基丙烯酸酯的硅表面 Si 2p浓度显著下降了>40%,C 1s含量增加了>37%。此外还观察到存在特征元素N 1s(400 eV)和S 2s(228 eV),以及 Br 3d(69 eV),表明pSBMA表面改性成功。高分辨率X射线光电子能谱数据(表SI)显示NR13浓度为3.1%,硫浓度为2.9%,这与化学计量比pSBMA预期的约1:1比例相符。灭菌后,这些样品的硅浓度略有下降,约为11%至17%,而未灭菌pSBMA基底的硅含量为20%。然而,碳、氧、氮和硫的浓度与未灭菌样品相比保持相近或更高。电子束灭菌和非灭菌基底中也存在可忽略量的磷污染物(<1%)。
未灭菌的pMPC偶联硅显示出Si 2p减少和C 1s含量增加,符合预期。同时还存在P 2s(190 eV)和N 1s,这是 pMPC的特征元素,表明在硅表面成功实现了聚合。高分辨率X射线光电子能谱数据(表SI)显示氮含量为1.7% NR13 ,磷浓度为1.2%,比例约为1:1,与pMPC的化学计量比一致。总体而言,除H2O2处理外,pMPC‐硅的灭菌未导致元素组成发生显著变化。在H2O2等离子体灭菌过程中,观察到碳浓度最大幅度下降,同时磷和氮含量也降至最低水平。还应注意的是,与pSBMA基底相比,pMPC基底中的碳浓度较低而硅浓度较高,表明pMPC的聚合度低于pSBMA。
接触角
接触角数据如图2所示。静滴水滴在10秒内保持稳定。未涂层硅基底的接触角为32°。经过聚乙二醇表面改性后,接触角增加至43°。两性离子涂层的接触角分别降低至pSBMA为15°,pMPC为25°。根据接触角测量结果可知,这三种表面修饰均具有亲水性。然而,灭菌处理后亲水性发生了显著变化,尤其是未涂层和 pMPC涂层基底。pSBMA‐硅的接触角受高压蒸汽灭菌影响最大,增加了15°。PEG‐硅受过氧化物处理影响最显著,降低了14°。
椭圆偏振法
使用椭圆偏振法(Ellipsometry),测定了各种表面涂层的厚度,如图3所示。PEG、pSBMA和pMPC涂层的初始厚度分别为0.9、7.1和2.7 nm。当采用H2O2等离子体进行灭菌时,所有涂层均观察到具有统计学显著性的厚度差异。表 III列出了相对于未灭菌对照样品的厚度变化,显示多种灭菌过程导致涂层厚度显著减少。PEG‐硅在干热、过氧化物和电子束辐照处理后厚度减少了>30%,而pSBMA和 pMPC在干热和过氧化物处理下厚度变化为>20%。此外,pSBMA也在高压蒸汽灭菌处理中受到显著影响,厚度减少了29%。
酶联免疫吸附测定
图4所示的HSA蛋白吸附数据表明,未经灭菌处理的 pSBMA和pMPC涂层硅芯片均表现出优异的抗污性能,与未涂层硅相比,蛋白质吸附分别减少了90%和95%。相比之下,聚乙二醇涂层芯片与未涂层硅相比仅减少了10%的蛋白质吸附。
总体而言,各种灭菌过程对未涂层硅的蛋白质吸附均未引起显著变化。对于表面改性的硅材料,灭菌似乎对涂层产生了不利影响,表现为蛋白质污染增加。电子束辐射导致 PEG‐硅上的HSA吸附量相较于未灭菌样品显著增加。对于 pSBMA‐硅,干热和环氧乙烷处理均显著增加了HSA吸附。最后,所有测试的灭菌方法均使其pMPC‐硅表面的白蛋白吸附显著增加。
讨论
为了成功开发可植入式医疗设备,必须考虑灭菌对设备及其表面修饰的影响。在本研究中,我们评估了五种常见的灭菌方式对硅基底上三种超薄表面修饰——聚乙二醇(PEG)、pSBMA和pMPC的影响。7,9,35这些聚合物薄膜<10 nm厚,并以刷状结构接枝到/自表面,在两性离子聚合物(pSBMA和pMPC)的情况下含有带电基团。由于灭菌过程是用于消除活体生物的严苛处理,预计其可能对聚合物的化学和物理特性及其功能产生不利影响。
高压蒸汽灭菌和干热是本研究中测试的两种高温灭菌过程。对于聚合物而言,高温可能通过氧化导致热降解,以及引起分子重排和交联,从而影响其化学性质。38,39尽管高压蒸汽灭菌是医疗器械最广泛使用的灭菌方法,但蒸汽会通过自发重排影响许多聚合物的表面能,导致其亲水性发生变化。40
相比之下,H₂O₂、EtO和电子束均为室温处理方式。然而,H₂O₂等离子体灭菌是一种相当具有腐蚀性的过程:活性自由基轰击表面以杀灭微生物。此外,研究还表明该方法会改性暴露的表面,降低聚合物强度、形貌、成分和润湿性。40有毒的环氧乙烷气体灭菌通常用于无法耐受蒸汽、干热或辐射的医疗器械。然而,它可能在聚合物中留下溶解残留物,因此需要较长的通风时间进行灭菌后处理。41最后,电子束灭菌利用一束带电电子来改变生物材料(如脱氧核糖核酸链)中的化学键,导致链断裂和交联。42
考虑到这些灭菌过程会使生物体内的化学结构发生变性、交联和降解,显然聚合物尤其是超薄表面涂层的性能可能会发生显著变化。因此,为了分析这些聚合物在灭菌后的变化,测量了其亲水性、元素组成、厚度和抗污能力的改变。表 IV总结了基于亲水性、涂层厚度和蛋白质抗性,灭菌对每种表面改性的影响。
PEG‐硅
与未灭菌硅相比,未灭菌PEG‐硅仅表现出蛋白质吸附减少11%。以往文献表明,硅表面的聚乙二醇可使其白蛋白吸附量比硅对照材料降低75%。19,43我们通过化学组成、接触角和厚度分析证实了聚乙二醇在硅表面的存在。然而,聚乙二醇链长和表面接枝密度会影响蛋白质抗性,而本研究中用于聚乙二醇表面改性的“接枝到”方法通常相较于“从接枝”方法获得较低的表面密度。44因此,我们观察到的蛋白质吸附降低程度较低可能是由于接枝密度较低所致。
硅上的PEG涂层受高压蒸汽灭菌和环氧乙烷处理的影响最小,而干热、H₂O₂和电子束处理则影响其性能和蛋白质抗性。在PEG子集中比较时,干热、H₂O₂和电子束处理分别导致涂层厚度减少32%、64%和47%。此外,除干热处理外,其他所有灭菌过程通过X射线光电子能谱分析均显示C–O键减少。这些负面的物理和化学表面变化与酶联免疫吸附试验数据相关,表现出蛋白质吸附的相应增加。H₂O₂等离子体也导致了显著的亲水性降低,这可能表明聚乙二醇聚合物在处理后发生了链断裂和电离。尽管C–O键减少,但综合考虑所有指标,环氧乙烷和高压蒸汽灭菌对聚乙二醇涂层的影响最小。
pSBMA‐硅
pSBMA‐硅的表面元素组成和涂层厚度表明,灭菌后 pSBMA聚合物链可能发生构象变化或交联。X射线光电子能谱数据显示,在五种灭菌过程后,硅含量减少,碳含量增加。氮和硫的含量也有所增加,而氮和硫是pSBMA的特征元素。除电子束灭菌外,其余灭菌后基底的涂层厚度均有所降低。尽管部分厚度减少可能源于聚合物的链断裂,但结合XPS中 pSBMA特征元素的增加,涂层厚度降低表明聚合物层因交联或构象变化而被压缩。为深入研究交联情况,未来可对聚合物的溶胀行为进行研究。然而,这些可能的结构变化并未对蛋白质抗性产生显著负面影响。
在所研究的三种表面修饰中,pSBMA的初始涂层厚度最高,未灭菌对照样品的测量值为7.1 nm。可能是聚合物链长使其在不损害蛋白质抗性效果的情况下发生了构象和交联变化。
电子束灭菌对pSBMA涂层的影响最小,而高压蒸汽灭菌、干热、H₂O₂或环氧乙烷处理对各项性能的影响则表现出低、中到严重的不同程度。当在pSBMA样本子集中比较不同灭菌组时,X射线光电子能谱显示,H₂O₂等离子体处理样品的碳浓度最低,其次是环氧乙烷处理样品。H₂O₂处理样品也表现出相应的最低的接触角和最大的厚度变化,厚度减少了超过43%。这一变化表明可能发生链断裂。然而,似乎pSBMA的抗污性能仍然得以保留,因为原始聚合物涂层的厚度大于这些灭菌过程造成的损伤。
pMPC‐硅
所测试的五种灭菌方法均对聚甲基丙烯酰氧基乙基磷酸胆碱涂层产生不利影响。除环氧乙烷处理外,所有灭菌方法均使其涂层厚度发生至少10%的变化,其中H₂O₂处理导致最大厚度减少达30%。然而,X射线光电子能谱结果表明,与未灭菌样品相比,碳浓度仅有轻微变化。与聚磺基甜菜碱甲基丙烯酸酯不同,聚甲基丙烯酰氧基乙基磷酸胆碱链较短(未灭菌基底为2.7 nm厚),其较低的自由度会限制链构象的改变。经H₂O₂处理的聚甲基丙烯酰氧基乙基磷酸胆碱样品碳浓度相较于未灭菌对照组显著下降(从31%降至25%),表明可能发生链断裂和聚合物降解。总体而言,所有测试的灭菌方法均使其pMPC‐硅基底的接触角和蛋白质吸附显著增加。然而,若涂层更厚,灭菌造成的损伤可能更具耐受性。根据结果,环氧乙烷处理对聚甲基丙烯酰氧基乙基磷酸胆碱样品的不利影响最小。
结论
灭菌对植入式医疗设备上的聚合物表面改性可能尤为严苛。因此,我们提供了研究数据,考察了不同灭菌工艺对硅基底上薄膜聚合物刷的影响。我们的研究表明,H₂O₂等离子体处理对所有三种聚合物涂层均产生不利影响。相比之下,高压蒸汽灭菌和环氧乙烷处理适用于聚乙二醇涂层,电子束灭菌适用于pSBMA涂层,环氧乙烷处理适用于pMPC涂层。这些结果将对任何在其应用中使用超薄两性离子或聚乙二醇涂层的硅基医疗设备具有参考价值。
随着新型聚合物和功能表面在医疗设备中的应用日益广泛,必须评估灭菌可能对其产生的影响。我们的结果表明,这些影响因表面涂层的化学和物理特性而异。因此,本研究为确定灭菌对任何表面改性的影响提供了一项指南。




















 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








