基于聚己内酯的三维打印可植入医疗器械原型样品用于控制药物递送
摘要
本研究旨在基于熔融沉积成型(FDM™)3D打印技术,制造将药物均匀载入整个主体结构的含药T型宫内系统(IUS)原型样品。采用吲哚美辛作为模型药物,通过热熔挤出法制备了三种不同药物含量(5%、15%和30%)的载药聚(ε‐己内酯)基丝材。随后利用所得丝材进行IUS的3D打印。结果表明,丝材及3D原型样品的形态和药物固态特性均依赖于载药量。由于IUS中药物结晶度较低,且产品外部/内部结构和几何形状存在差异,打印器件的药物释放速度较相应丝材更快。药物从聚合物中的扩散是药物释放的主要机制,而聚(ε‐己内酯)的生物降解影响较小。本研究表明,3D打印是一种适用于含药IUS生产的可行方法,并为可控释放可植入设备的制造开辟了新的途径。
引言
每年上市的新化学实体数量减少,以及来自仿制药的竞争,迫使制药公司寻求产品制造方面的创新途径。现有药物的新剂型及其递送方法可以延长产品的生命周期,并改善制药业务的财务状况。此外,个性化医疗和定制化的需求可能促使制药公司在产品制造中采用更具创新性的制造方法。
许多已用于其他领域的技术和制造工艺最近已被引入生物医学和制药领域,例如热熔挤出(HME)以及不同的三维(3D)打印技术。在热熔挤出过程(HME process)中,活性药物成分(API)在热应力作用下与热塑性聚合物混合,然后挤出成型为丝材或薄膜。该技术相较于传统方法的主要优势在于使用简便,并且无残留溶剂,从而降低环境危害和药品生产成本。热熔挤出(HME)已被广泛应用于长效植入装置、口服缓释制剂以及经皮和经甲药物递送系统(DDS)的生产。
在不同的3D打印技术中,熔融沉积成型(FDM™)作为热熔挤出(HME)的延伸,可通过熔融和打印热熔挤出丝材,很好地用于制造几乎所有类型的特殊形状的药物递送系统。FDM™工艺包括使用计算机软件设计物品,随后通过打印机进行制造。该技术已应用于化学、生物医学和制药领域。
自1960年代以来,人们一直在研究用于避孕的可植入药物递送系统。它们已通过挤出成型和/或注射成型工艺被制造成棒状物、宫内系统(IUS)和阴道环(IVR)。可用于制造IUS或IVR的聚合物种类有限,因为这些材料必须是非溶胀性的,并且为非生物降解材料,或其降解速率必须非常缓慢。已上市 IUS 和 IVR 由不可降解的聚合物组成,例如聚‐二甲基硅氧烷(PDMS)或乙烯‐醋酸乙烯共聚物。Mirena® 是目前市场上可获得的长效避孕 IUS 的一个例子,基于 PDMS。该装置的主体结构是由聚乙烯制成,带有药物递送圆筒和一个速率‐控制用 PDMS 膜包裹其外。这种复杂系统的制造需要多个生产步骤。
缓慢生物降解的聚ε‐己内酯)(PCL)是通过3D打印制备可植入药物递送系统所用热塑性材料的一种潜在替代品。在药物递送系统中使用 PCL,由于该聚合物的特定性质,可实现长期持续的药物释放速率。特别是,PCL对多种药物具有高渗透性,并且具有优异的生物相容性。PCL已被用于制备含有抗蠕虫药物吡喹酮的长效圆柱形植入剂。此外,基于PCL的药物洗脱支架和“外科糊剂”被用于研究抗癌药物向肿瘤组织的释放速率。PCL有利的生物降解动力学使其可用于制备可植入式避孕装置。Capro‐TM 就是一个基于PCL的1年期可植入避孕胶囊的良好实例,该胶囊在2‐3年后通过生物侵蚀从体内完全消除。除此之外,PCL还被用作FDM灵活材料,应用于除制药以外其他用途的3D打印技术。
本研究的主要目标是采用基于熔融沉积成型的3D打印技术,通过热熔挤出过程的延伸,制造出药物均匀分布于聚己内酯基材主体结构中的宫内系统。简而言之,通过热熔挤出法制备了不同载药量的丝材,并进一步用于通过3D打印创建独特的宫内系统结构。研究了处方中各组分的固态特性、载药量对可打印性的影响以及设备的药物释放行为。
材料与方法
材料
微粉化吲哚美辛(埃斯特韦化学股份公司,西班牙,99.9%)被用作难溶于水的模型药物。聚己内酯(CAPA™ 6500;珀斯托;平均分子量Mw ¼ 50,000)以柔性丝材形式作为3D打印机的原始进料材料,用于制备无药物和载药纤维以及3D打印原型样品。氯化钠(西格玛奥德里奇,中国)用于配制0.9%的释放介质,以进行体外释放研究。纯化水(Milli‐Q)用作溶剂。氯仿(默克公司,德国)购自西格玛奥德里奇,用于药物含量分析。
热熔挤出
本研究中,采用热熔挤出(HME)法制备载有活性药物成分的聚合物丝材,用于3D打印机。热熔挤出使用配备反向旋转螺杆的 HAAKE miniCTW微锥型双螺杆挤出机(赛默飞世尔科技,德国卡尔施鲁厄)进行。挤出成型温度为100°C,熔融和混合过程的转速为30转/分钟。批次量为 5 g(挤出机的最大装料量)。聚合物中吲哚美辛的浓度分为三种不同水平,即5%、15%和30%被选用于挤出过程。首先,将约五分之一所需量的聚己内酯加入挤出机中,待其熔融后,随后加入预先称重的微粉化吲哚美辛和剩余的聚合物。混合10分钟后,将转速设为10转/分钟,并通过位于料筒末端的1.5毫米口模将药物‐聚合物混合物挤出成丝材。使用基于激光的直径测量工具(HAAKE,德国卡尔斯鲁厄)在线控制挤出丝材的直径。采用赛默飞世尔科技的传送带,通过调节传送带速度将丝材直径调整至所需范围。仅使用直径在1.75 ± 0.05毫米可接受尺寸范围内的丝材进行3D打印。
采用FDM™ 技术的3D打印
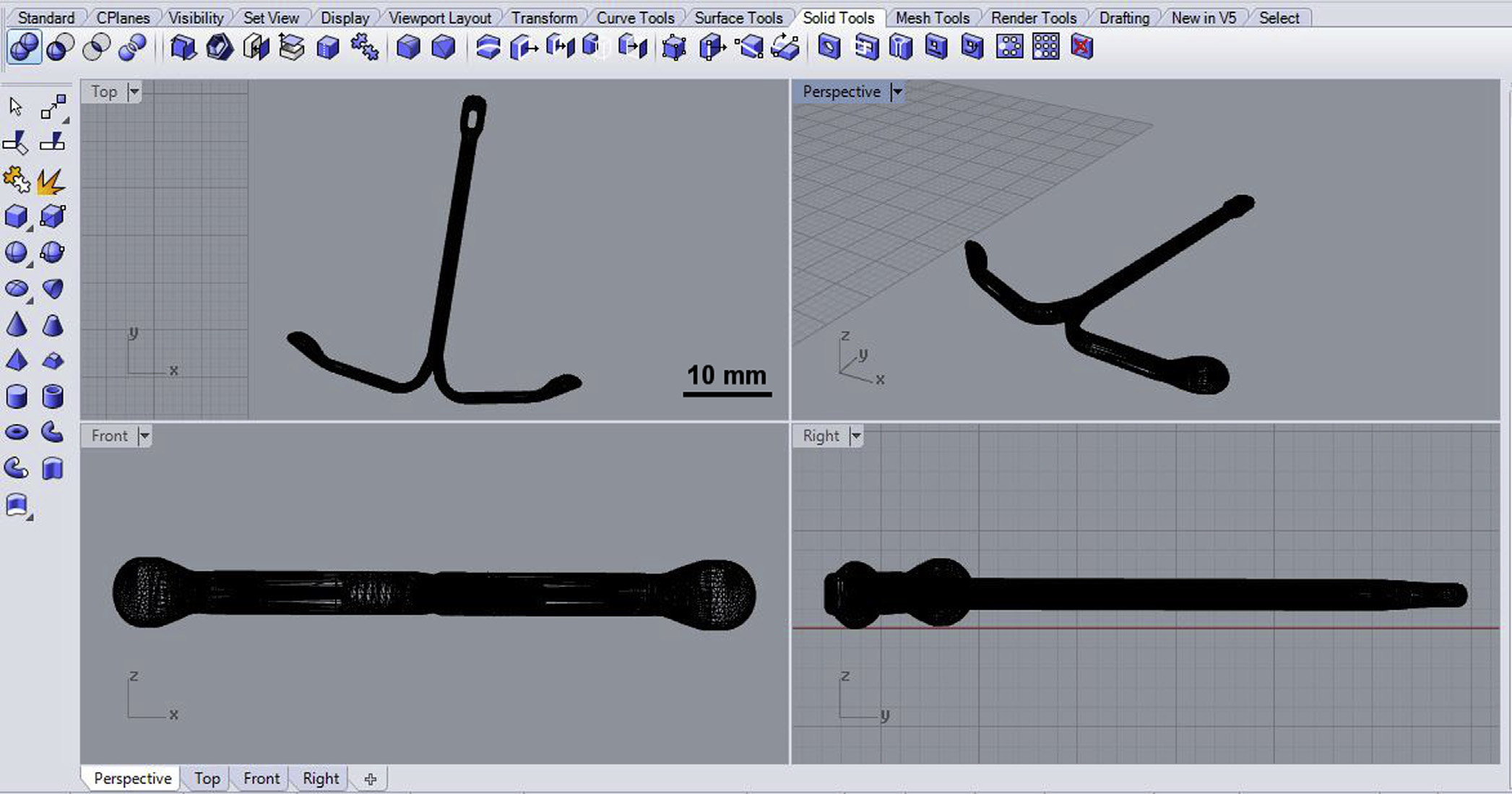
IUS的原型设计由拜耳医药保健有限公司以立体光刻文件(.stl)形式提供,该文件在打印前已上传至打印机的MakerWare软件中。该原型在3D计算机辅助设计程序Rhinoceros 5.0中的截图如图1所示。

使用MakerBot Replicator 2台式打印机进行3D打印,该打印机采用熔融丝材制造(FFF)技术。FFF是一种基于FDM™的无模成形制造技术,由Stratasys公司专利持有。在3D打印实验中,进料温度为120°C,打印温度为100°C,打印速度为45毫米/秒,挤出机在构建平台上的物体之间移动时的移动速度为150 毫米/秒。质量参数设置如下:(i) 填充率为10%,用于定义物体的致密程度;(ii) 层高为0.1 毫米,用于描述每一层的厚度;(iii) 壳层数为3,用于定义物体每一层所打印的轮廓数量。曾尝试在165°C(高于药物熔点160°C)下使用与100°C相同的打印参数打印载药30%的丝材。原型样品在预先打印的无药物支撑结构和底板上构建,打印完成后将这些支撑结构和底板去除。构建平台表面使用Kapton®聚酰亚胺胶带作为材料,在其上打印带有必要支撑的三维结构。
流变学
采用旋转流变仪AR 200ex(TA仪器公司)对挤出的无药和载药 PCL丝材在100°C(使用的打印温度)和 165°C(高于活性药物成分熔点的测试打印温度)下的黏度随剪切速率的变化进行流变学测量,仪器配备直径为15毫米的平行板。简要步骤如下:将0.6克样品置于下板上并使其熔融。当样品完全熔融后,降低上板直至两板之间形成1毫米间隙,并在两板间对样品进行剪切。黏度通过所施加的剪切应力与剪切速率之比计算得出。
药物含量
对热熔挤出丝材进行了药物含量分析,以确定样品中吲哚美辛的准确含量以及丝材内药物分布的均匀性。简而言之,从挤出机中随机取出的重量在 130 ± 1 mg范围内的丝材(相当于3D打印宫内系统原型的重量)溶解于5 mL氯仿中,氯仿是吲哚美辛和聚己内酯的良好溶剂。溶液被用氯仿进一步稀释至可检测浓度。使用紫外‐可见分光光度计( PerkinElmer Lambda 35)在265 nm处测定所得稀释液的吸光度。吲哚美辛在氯仿中的浓度范围为1.25至25 mg/mL时呈现良好线性(R² ¼ 0.9996)。每个样品均进行三次分析。
扫描电子显微镜
采用扫描电子显微镜(SEM;LEO Gemini,德国奥伯科亨)研究了热熔挤出丝材及3D打印原型在释放实验前后表面和横截面的形貌。样品在分析前使用真空蒸发仪进行碳涂层处理。获取SEM图像时采用的加速电压为8 kV和15 kV。
X射线衍射
采用X射线衍射仪(X‐Pert PRO MPD;Philips, Holland)研究了原料、其二元混合物(指在研钵中制备的药物与聚合物组分的混合物)以及热熔挤出丝材的结晶度。纯物质和二元混合物直接加载到金属样品架上并以此状态进行分析。丝材被切割成适合样品架的相同尺寸的条状物后进行X射线衍射(XRD)测量(长度为12毫米,直径为1.75毫米,每次测量使用6‐7根条状物)。打印样品使用与原型系统相同的打印参数,以对应于样品架尺寸的尺寸(12 × 15 × 1毫米)进行3D打印。
XRD扫描采用q/2q BraggeBrentano几何结构,使用CuKα辐射(λ ¼ 1.54 Å),电压为40 kV,电流为50 mA,并配备PIXcel1D探测器( Panalytical, Holland)。打印样品和二元混合物在XRD实验时已存放 1天,而丝材则略超过1个月。
差示扫描量热法
为了确定原料、其二元混合物、丝材以及打印样品的热行为,使用 DSC Q 2000仪器(TA Instruments)进行了差示扫描量热法(DSC)分析,该仪器配备有制冷冷却系统,可使温度降至-40°C。对纯活性药物成分取样 2 ± 1 mg,含聚合物材料取样 10 ± 1 mg,在封闭的 Tzero铝坩埚中以标准模式运行,采用三阶段分析,包括连续的加热、冷却和再次加热循环。温度范围为-40°C至 180°C,升降温速率为10°C/min。使用氮气作为吹扫气体,流速为50毫升/分钟。所得热谱图使用 TA仪器公司Universal软件进行分析。
溶解度的测定
为了测定吲哚美辛在释放介质中的溶解度,将过量的IND悬浮于 0.9%氯化钠溶液中。样品在 37°C下,使用恒温振荡器(BioSan恒温振荡器PST‐100)以700转/分钟振荡21小时,同时在室温下使用多管振荡器(BioSan多管振荡器PSU‐20)以110转/分钟进行振荡。随后在 13,000转/分钟下离心10分钟。选择对样品进行离心而非过滤,是因为该药物容易吸附在滤膜上。上清液通过紫外‐可见分光光度计( PerkinElmer Lambda 35)在265纳米处进行分析。该方法在1.25至 20 μg/mL浓度范围内呈线性(R² ¼ 0.9998)。所获得的药物溶解度数值用于在释放实验期间维持漏槽条件。
体外药物释放
药物释放实验采用含有不同含量药物的3D打印原型(IUS)和热熔挤出丝材进行。

每个样品精确称重后置于由不锈钢制成的压缩弹簧中,该压缩弹簧固定在连接至250‐mL瓶瓶盖的金属杆上。此装置用于防止样品因 PCL的密度高于释放介质的密度且等于1.1 g/cm³。每个样品浸入 200 mL 0.9%氯化钠溶液中。将瓶子置于振荡水浴(Julabo SW22, Seelbach, Germany)中,37.0 ± 0.2°C、100 rpm条件下持续30天。根据需要更换释放介质以维持漏槽条件。在预定时间点取样,并通过分光光度法在265 nm处测定释放介质中吲哚美辛的浓度。
体外释放试验期间的基质降解
为了测定聚合物的质量损失,溶解试验后的样品在室温下过夜干燥,然后称重。质量损失的计算基于药物含量分析得到的实际药物‐聚合物比例。释放的吲哚美辛百分比和聚合物质量损失计算如下:
$$
\text{Drug release percent } (\%) = \frac{\text{Weight of drug released}}{\text{Total actual weight of drug}} \times 100\%
$$
$$
\text{Polymer mass loss } (\%) = \frac{\text{Initial weight of sample} - \text{Final weight of sample} - \text{Weight of released drug}}{\text{Actual total weight of polymer}} \times 100\%
$$
结果与讨论
载药丝材的热熔挤出
在基于熔融长丝制造的3D打印过程中,丝材被用作制造目标三维结构的原料。为了生产将药物掺入聚合物基质内的合适丝材,采用热熔挤出对原始药物和聚合物材料进行处理。丝材直径是成功进行3D打印最关键的参数之一。本研究中影响丝材制造过程的因素包括:(i) 螺杆转速,(ii) 口模直径,以及 (iii) 挤出机的填充水平。挤出开始时螺杆转速设定为10转/分钟,并在过程中逐渐提高,以便获得更多具有正确直径的丝材。初始螺杆转速过高会导致无法获得尺寸均匀且合适的丝材。根据聚合物的熔体指数和溶胀能力,发现使用1.5毫米口模是制备所需尺寸范围内载药丝材的最佳选择。尽管整个挤出过程使用的口模相同,但挤出的丝材直径仍存在变化。这是由于随着挤出过程的进行,挤出机的填充水平逐渐降低,导致料筒内压力下降,进而影响供给口模的物料量。
3D打印可植入原型样品
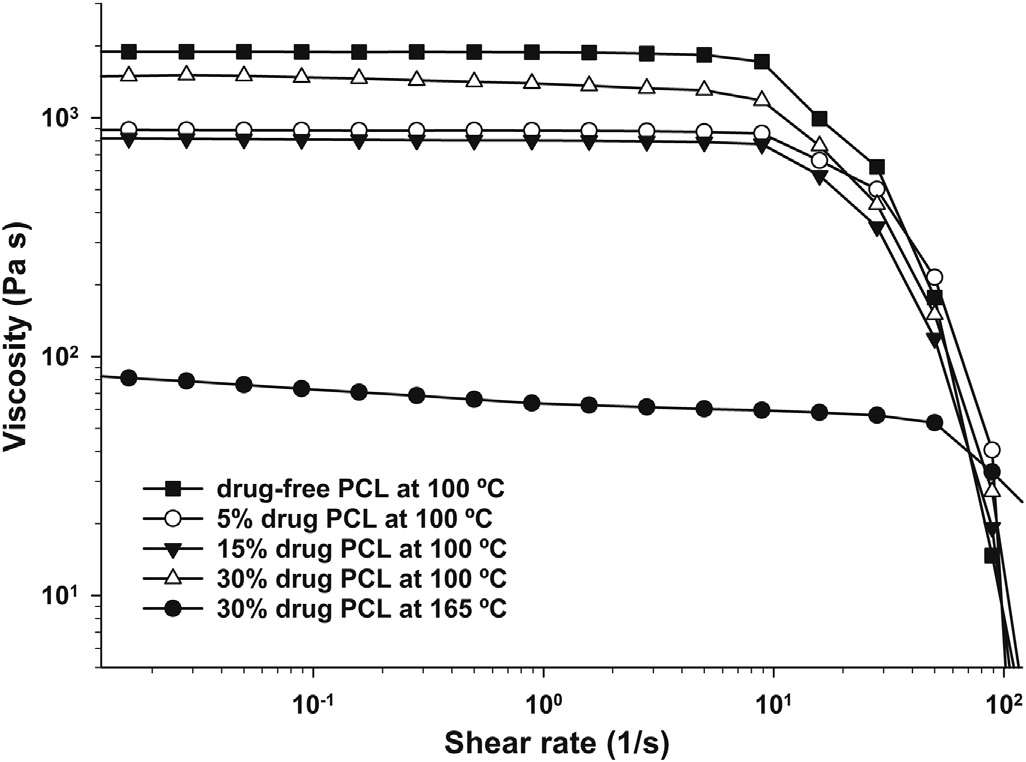
聚己内酯(PCL)是本研究所用打印机类型的原始进料材料之一(另一种是聚乳酸)。无药和载药filaments的打印在默认打印速度45 毫米/秒下进行。更高的打印速度会导致聚合物熔体从喷嘴流出不足,从而造成所构建的三维结构打印质量差。材料的最大打印速度取决于工艺参数,例如打印杆的宽度和高度、喷嘴尺寸和几何结构,以及打印温度和聚合物fl的熔体黏度。在本研究中,使用无药物和载药filaments打印时,工艺参数和喷嘴形态保持一致。纯PCLfilament与载药 filament在施加剪切速率下的黏度变化在100°C时表现出相似的剪切变稀行为(图2)。基于PCL的非牛顿流体的剪切黏度曲线在5每秒之前表现为牛顿平台区,在5至40每秒之间为过渡区,末端为剪切变稀区。这可能是所有载药PCLfilaments均能顺利送入熔融器并在设定的打印温度下无问题打印的原因之一。在牛顿区域内的熔体黏度范围为800‐2000毫帕·秒:其中15%药物含量的filament黏度最低,而无药PCL的黏度最高。这一发现可能表明,由于药物在聚合物中的溶解导致聚合物结构受到破坏,且在15%含药丝材。Chokshi 等人已证明药物在聚合物中的增溶现象。根据后续给出的X射线衍射和差示扫描量热法数据,吲哚美辛在载药量最高的原型样品中至少部分处于结晶态。
由于打印温度远低于原料吲哚美辛的熔点。在高于原料吲哚美辛熔点(160°C)的165°C打印温度下,对含有30%吲哚美辛的fiament进行了打印实验。在165°C下可以实现打印,但产品的质量较100°C时更差。显然,这是由于聚合物熔体在打印层之间的黏附性较差所致。当打印温度高于默认温度时,打印出的聚合物需要更长时间才能冷却。Sun et al.曾报道,材料的热历史会影响相邻层以及打印过程中产生的棒状物之间的结合强度。此外,在165°C和100°C下,30%载药fiament在施加剪切速率下的黏度变化曲线存在差异,这在一定程度上可能导致在 165°C打印的原型样品质量 unacceptable 地变差。
除了打印温度和速度对处方可打印性的影响外,还需考虑其他参数。丝材在整个长度上必须具有均匀的尺寸,因为不均匀的丝材会导致挤出材料流速波动,从而在打印原型中产生缺陷以及层间结合不良,严重时甚至会导致整个打印过程停止。本研究中,由于此前讨论的热熔挤出过程生产上的挑战,挤出的丝材直径存在变化,这导致了3D打印过程中丝材进料困难。简而言之,丝材通过夹紧辊送入3D打印机的熔融腔,其中一个辊由步进电机驱动,为丝材向下输送提供动力。本研究所用的打印机配有反向旋转的钢制辊,直径分别约为5毫米和10毫米。较小的辊表面光滑,而连接电机的较大辊则具有沟槽纹理的表面。过粗的丝材无法送入,因为熔融腔的直径仅略大于丝材所需尺寸(1.75 þ 0.05毫米)。直径小于1.70毫米的丝材也无法顺利送入,原因是辊之间摩擦力不足,导致施加在丝材上的压力过低,从而发生打滑。通过改变辊的特性(其尺寸和材料),可以拓宽丝材理想直径的适用范围。Comb 和 Priedeman研究了不同辊尺寸和表面材料的送料系统所需的驱动牵引力,以确保丝材在无打滑的情况下被送入熔融腔。据报道,较小的(1/200)弹性轮由于具有更高的摩擦系数,能够增加牵引力,因此相比大尺寸辊轮更能适应丝材尺寸的变化。另一个影响可打印结构质量的参数是构建平台的表面特性。本研究使用的打印机默认配置为亚克力构建平台。然而,聚己内酯无法在其上良好粘附。因此,医疗原型被打印在 Kapton®聚酰亚胺胶带上,这是打印机制造商推荐的做法。此外,原型的几何结构也会影响打印质量。宫内给药系统原型具有相对复杂的结构,因此打印时使用了无药物底板,因为无支撑的原型在构建平台上打印时会发生翘曲。底板与平台的接触面积更大,因而能更好地粘附于构建平台。支撑结构在冷却后被手动从原型上切除。去除支撑结构会影响原型表面。无需任何支撑结构即可成型的原型,其表面光洁度优于需要额外支撑元件的原型。使用双挤出机打印机可以在一定程度上减少支撑结构对最终原型表面的影响。使用此类打印机时,支撑结构可采用另一种构建材料制成,该材料与实际构建材料之间的界面较弱,因此更容易去除。利用本研究中所用类型的打印机打印具有非常复杂几何形状的精细结构可能是一项真正的挑战。可以尝试使用分辨率更高的打印机来解决这一问题。除了原型的复杂几何形状和构建平台不合适的表面特性外,粘附问题也可能由不适当的环境条件引起,例如打印过程中的环境温度。材料的热容和热导率决定了打印过程中可行的工艺温度。Agarwala 等人报告指出,成功打印某种材料需要环境温度达到一定临界值。当打印温度低于理想范围时,与构建平台、相邻棒状物及层间的结合或粘附效果较差。当打印温度超过临界温度时,原型表面质量也会受到影响。配备可调腔体温度以及加热型或真空型构建平台的打印机,可有效减少与构建平台之间的粘附问题。此外,正确选择打印温度对于确保药物‐聚合物混合物在打印过程中从喷嘴顺畅流出至关重要。温度过低将无法充分降低聚合物熔体的黏度,使其难以顺利从喷嘴流出,从而导致打印物体质量不佳。
形态学性质
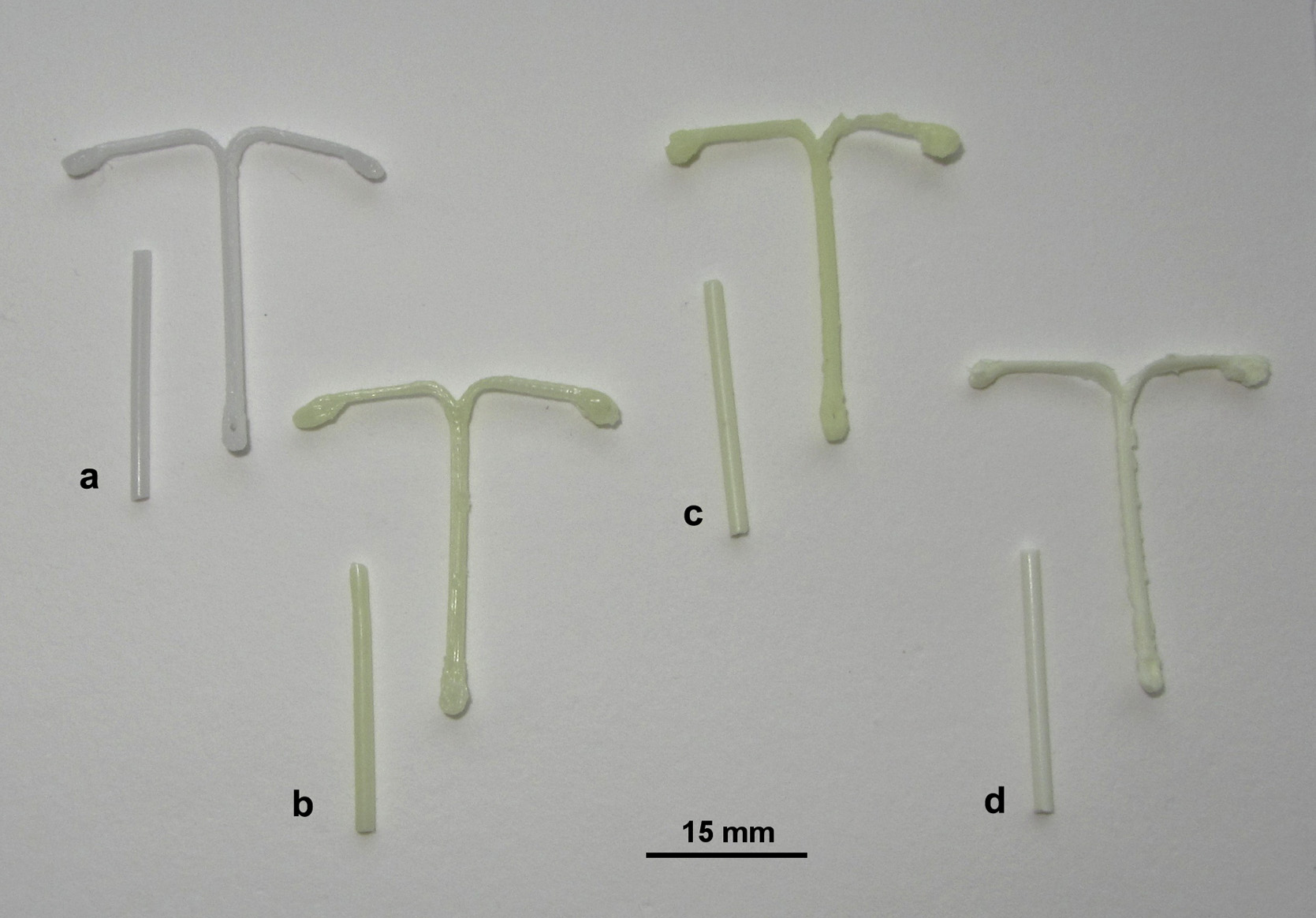
未载药的PCL 挤出后的丝材呈白色不透明。含有吲哚美辛三种不同规格的制备丝材均呈现黄色(图3)。含5%吲哚美辛的丝材为黄色且半透明。15%药物含量的载药丝材呈稍亮的黄色且不透明。含30%吲哚美辛的丝材为不透明,但比15%药物含量的丝材黄色更浅。已知溶解在聚合物中的无定形吲哚美辛呈黄色,而晶体药物为白色。进一步的研究(例如X射线衍射和差示扫描量热法,后续提供数据)证实了药物至少在一定程度上溶解在聚合物熔体中。不同的黄色色调是由于每根丝材中晶体药物的含量不同所致。filament。
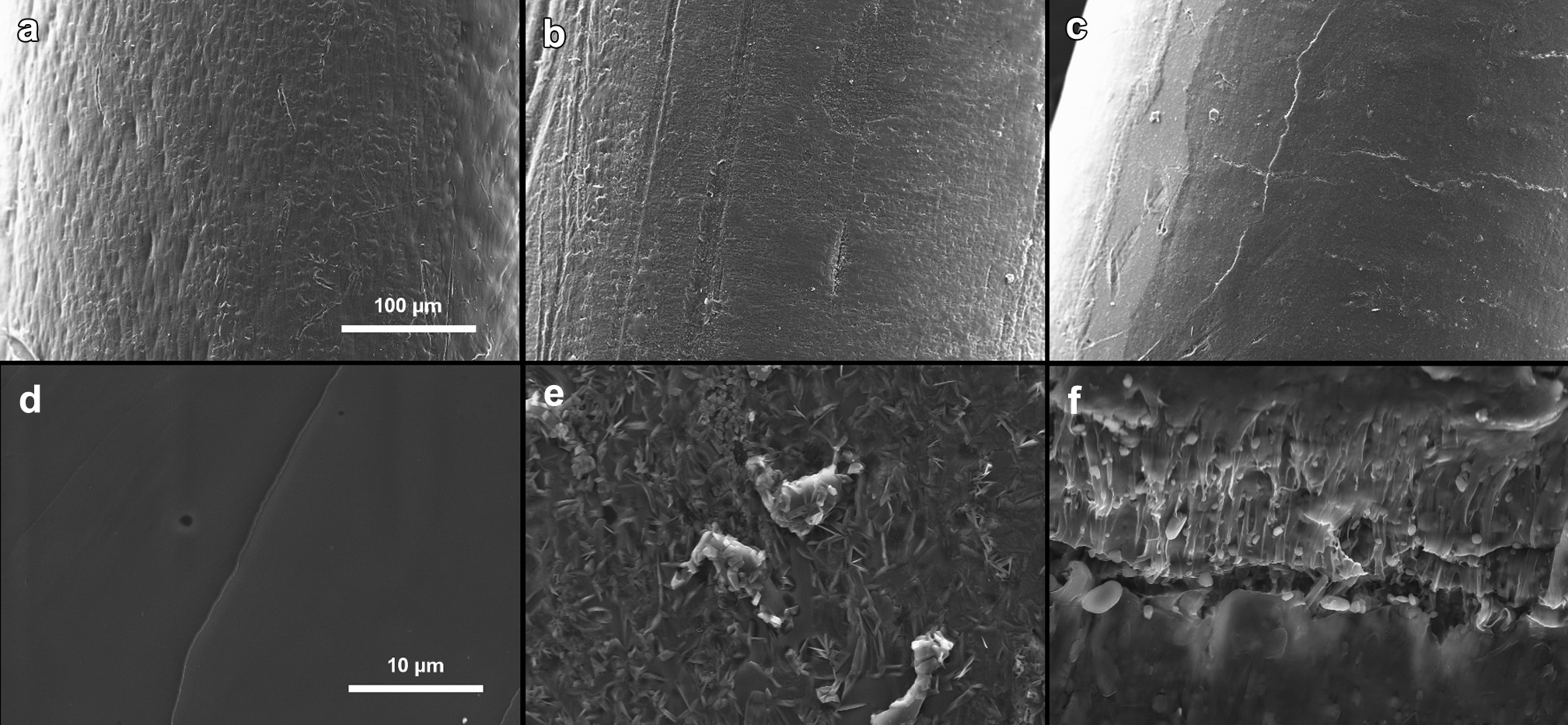
用于制造PCLfilaments的HME过程在100°C下进行,该温度高于 PCL的熔点但低于吲哚美辛的熔点(160°C,对应于稳定g‐型吲哚美辛)。在加工温度低于药物熔点的HME过程中,固体药物作为溶质,而聚合物则作为黏性溶剂。药物逐渐溶解到聚合物熔体中,形成药物e聚合物固体分散体。药物颗粒完全减小,或直至达到加工温度下药物在聚合物中的溶解度极限。PCL的溶解度参数为19.1–19.3 MPa¹/²,而吲哚美辛的溶解度参数为22.1 MPa¹/²(按Hoftyzer/Van Krevelan和Hoy溶解度参数的平均值计算),两者之间相差2.8–3.0 MPA¹/²。根据 Greenhalgh等人 的观点,若差值小于7 MPa¹/²,则化合物至少表现出一定的相容性。数值越接近,相容程度应越高。因此可以推断,吲哚美辛在HME过程中至少能在一定程度上溶解于熔融的PCL中。进一步的研究,例如DSC,证实了这一结论。对约3个月大的filaments进行了 SEM分析,以进一步了解样品的形态(图4)。结果显示,无药物及载药量高达15%的filaments表面相对光滑且致密,而在载药量最高的丝材表面则可见一些裂纹。载药丝材横截面的质地不如无药物丝材那样光滑,这是由于丝材内部存在细小的药物颗粒所致。
含有5%吲哚美辛的3D打印原型的颜色与相应的丝材相同。使用15 %载药丝材打印的原型样品比丝材略呈更亮的黄色。原型样品含有30%吲哚美辛的样品比丝材略黄,但不如含有15%吲哚美辛的原型那么亮黄。颜色的变化表明,在打印过程中,由于打印时加热至100‐120°C,更多的吲哚美辛在聚合物中溶解或熔化。值得一提的是,在环境条件下储存超过4个月后,丝材和原型样品的外观(颜色和不透明度)均未观察到明显的视觉变化。
根据扫描电镜分析,所有打印原型的表面均显示出层状结构(图5)。无药物和5%载药原型的横截面光滑。在5%载药原型的横截面上可以看到一些药物颗粒。观察到的药物晶核(尺寸为<1 mm)可能是由于未溶解和/或重结晶药物的存在,因为扫描电镜分析是在存放2个月的样品上进行的。30%载药原型的横截面因存在晶体药物而不平整。
HME丝材与3D打印原型之间在表面和横截面形貌上的差异可能对药物释放速率产生显著影响,因为3D打印原型的层状结构具有更大的表面积,有利于药物溶解和吸水,而丝材的表面相对均匀且呈整体性。
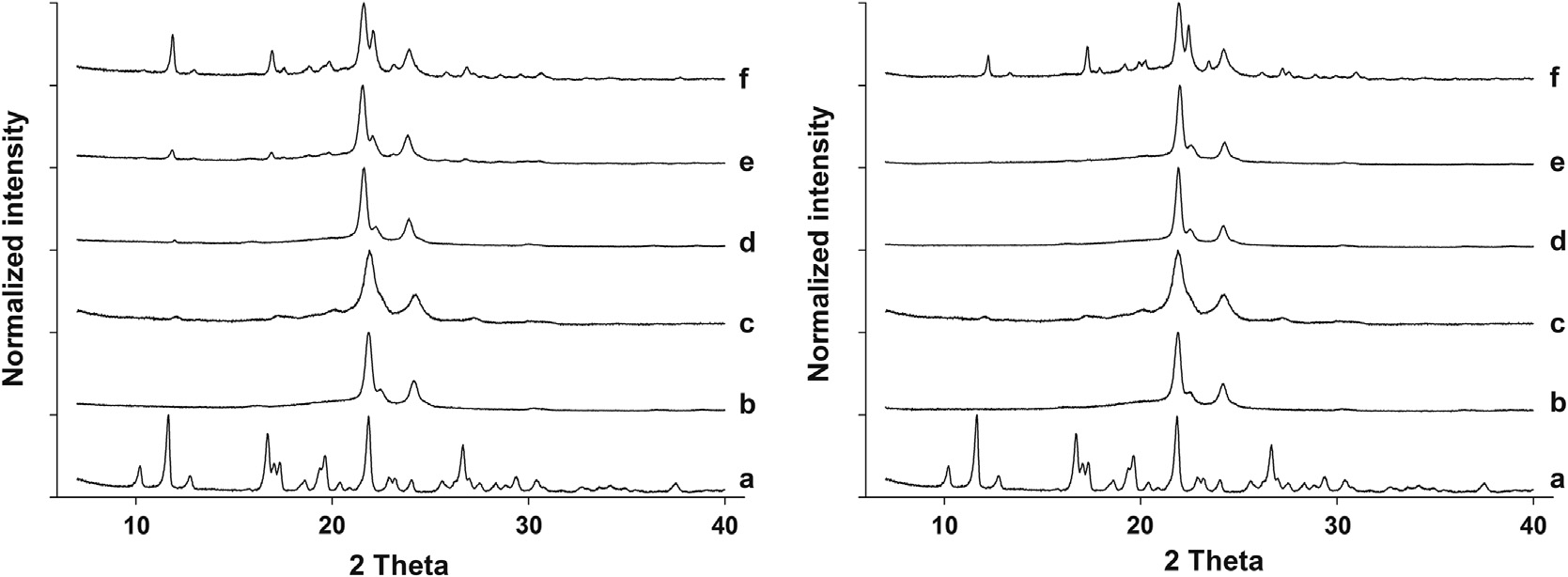
X射线衍射分析
为验证处方中药物的结晶度,进行了X射线衍射分析。原料被确认为稳定的结晶型g型吲哚美辛,其主要特征峰位于10.2°, 11.7°, 12.7°,和 17.0°(图6)。根据文献,亚稳态a型吲哚美辛在7.0°, 8.5°, 11.5°, 12.0°,和14.0°,处有X射线衍射峰,而无定形态则表现出晕环图案。半结晶态聚己内酯在 20°和 25°之间具有两个特征布拉格峰。本研究中准备的所有丝材和打印原型的X射线衍射图谱均显示出位于21‐22°和23‐24°,的峰,表明聚己内酯在挤出和打印后仍保持半结晶态。所有制备的丝材均在一定程度上含有晶体药物(图6,左)。含5%药物的丝材的X射线衍射图谱在约12°,处显示一个与吲哚美辛相关的单峰,而含15%药物的丝材已出现额外的特征峰(较明显的分别位于约 12°和17°处)。含30 %药物的丝材结晶度进一步增加,几乎所有吲哚美辛的特征峰均出现在图谱上。可以得出结论,在三种配方中,并非所有使用的药物都完全溶解。在HME过程中,活性药物成分完全溶解于熔融聚合物中和/或在储存期间溶解的药物可能发生再结晶。存放1天的3D打印样品的X射线衍射图谱显示,仅在含有最高药物含量的处方中存在结晶吲哚美辛(图6,右);在100‐120°C温度下进行的3D打印过程可能导致活性药物成分在熔融聚合物中的进一步溶解。刘等人已在文献中报道,在升高温度下延长加工时间会减少熔融聚合物中固体吲哚美辛颗粒的含量。
为检查药物在HME和3D打印样品中随时间的固态稳定性,研究人员在储存1个月后进行了第二次X射线衍射分析(数据未显示)。丝材的 X射线衍射图谱与之前的完全相同,表明丝材中药物的固态未发生变化。然而,在储存期间,打印样品中的药物发生了重结晶,因为在所有含5 %和15%载药量的原型样品的X射线衍射图谱上均出现了吲哚美辛相关峰。对于含30%药物的样品,由于储存前后X射线衍射图谱相似,无法揭示其重结晶程度。由此得出结论:刚打印完成的样品(5%和15%载药量)中药物基本处于过饱和状态,在储存过程中逐渐向饱和状态缓慢重结晶。其他研究人员此前已在热处理样品中观察到药物从固态中结晶的现象。
在热熔挤出和3D打印过程中,结晶态的活性药物成分可能发生固相转变。然而,由于α型和γ型吲哚美辛的X射线衍射峰相互重叠,且非晶态没有任何衍射峰,因此无法通过XRD区分吲哚美辛的不同晶型。
热分析
为了进一步了解二元混合物(ex tempore制备)各组分的固态特性、HME filaments(1个月大)和3D打印原型(1周大),进行了 DSC分析(图7)。吲哚美辛(原料)的DSC热谱图显示了一个起始点为温度为 160°C,这是由于g型的熔融所致。已知a型的起始熔融温度为148‐155°C。无定形吲哚美辛的热谱图显示出在约43 ± 6°C处的玻璃化转变(Tg),在80 ± 20°C处由于无定形药物重结晶引起的放热事件,以及由于a型或g型的熔融引起的吸热事件,具体取决于制备方法。所有PCL丝材的热谱图均显示一个宽的吸热事件,起始温度为54°C,峰最大值约为60°C。含有5%吲哚美辛的丝材的DSC热谱图与纯PCL的 DSC曲线几乎相同。对于15%载药量的丝材,热谱图显示出两个吸热事件,起始温度分别为55°C和 78°C,峰最大值分别在 60°C和 97°C。最高载药量丝材的热谱图也显示出两个吸热事件,起始温度分别为55°C和 101°C,峰最大值分别为60°C和 125°C。显然,这两个热谱图中的前一个峰对应于PCL的熔融,而后一个峰应为吲哚美辛的熔点。吲哚美辛熔点的降低是由于在热熔挤出过程中部分药物溶解在聚合物中所致。该现象在文献中已有报道。X射线衍射分析显示,含有5%吲哚美辛的丝材具有一定程度的结晶性,而差示扫描量热分析未检测到任何特征峰。这可能是由于现有的结晶吲哚美辛在熔融PCL中开始溶解所致在升高温度下进行DSC实验时,该现象已被其他研究人员观察到。DSC运行时间足以使最低载药量丝材中结晶吲哚美辛的含量降低至检测限以下,而在另外两种配方中,结晶度的降低并不显著。含有5%吲哚美辛的二元混合物的DSC曲线显示,吲哚美辛熔融峰的起始点降至155°C,峰最大值出现在160°C,表明在DSC实验过程中药物在熔融聚合物中开始溶解。3D打印样品的热谱图结果与对1天龄3D样品的X射线衍射分析趋势一致。在含有最高API含量的原型样品中,结晶吲哚美辛被明显检测到。在30%载药量的原型样品热谱图中,吲哚美辛的熔融峰进一步降低,起始温度为99°C,峰最大值为 123°C。这说明3D打印样品中的溶解药物比相应丝材更多。在含有15%药物的原型样品中观察到微量结晶吲哚美辛,而XRD未在此样品中检测到任何药物结晶度。显然,药物的重结晶可能已经发生,因为DSC分析是在样品制备后7天进行的,而XRD分析是在制备后1天完成的。除了分子分散和结晶态的吲哚美辛外,15% 载药量原型样品可能含有无定形吲哚美辛,因为相应丝材的打印是在高于药物熔点的温度(100°C)下进行的。研究发现, freshly prepared quenched-cooled 无定形吲哚美辛的Tg为45‐48°C(数据未显示)。然而,由于PCL熔融掩盖了药物可能的Tg,未能检测到药物单独的无定形相。由于存在熔点降低的现象,无法确定丝材和3D打印装置中结晶态吲哚美辛以何种多晶型形式存在。
药物含量分析
通过热熔挤出制备载药filament的目标是生产三种不同规格的产品,即药物含量分别为5%、15%和30%。然而,实际药物含量低于理论值(表1)。这可能是由于挤出过程初期存在明显的药物损失所致,因为微粉化吲哚美辛是一种粘性极强且具有高度黏附性的粉末,流动性很差。显然,在最低载药量(5%)的情况下损失百分比最高,这是因为三种配方的物料损失量大致相同。需要指出的是,本实验采用小型挤出机进行热熔挤出,该装置仅包含一种类型的双螺杆元件,最大装料量为7 mL。这种热熔挤出装置可能导致三种配方的药物含量均偏低,并且高药物含量拉丝的均匀性较差,因为设备无法实现高粘性粉末与熔融聚合物的有效混合。此外,吲哚美辛在熔融聚己内酯中的溶解度有限(Figs. 3 和 7)。在低药物含量拉丝中,吲哚美辛在热熔挤出过程中几乎完全溶解于熔融聚己内酯中,从而提高了混合效率,进而改善了剂量均匀性。此外,混合物在挤出机内的停留时间也会影响处方的均匀性。停留时间必须足够长,以确保材料在料筒内充分熔融和混合;同时又必须足够短,以防止热敏性和剪切敏感性材料发生降解,并降低工艺成本。本研究中,适当停留时间的确定基于挤出过程中扭矩的变化:当扭矩下降并趋于稳定时,停止挤出过程,表明已达到一定程度的均匀性。本次研究中停留时间不足应该不是问题,因为在文献报道中,同类挤出机采用更短的停留时间仍获得了可接受的聚(D,L‐乳酸)基e处方的包封效率结果。在该研究中,载药量虽低于预期,但结果优于本研究。根据所获得的结果可以明显看出,本研究所采用的热熔挤出过程需要进一步优化。
体外药物释放
吲哚美辛在室温和 37°C的0.9%氯化钠溶液中的溶解度分别为6.77 ± 0.07和7.48 ± 0.07mg/mL。后者参数用于计算药物在介质中的最大释放浓度,以上其中无法维持漏槽条件。在漏槽条件下,PCL体外药物释放数据从 PCL丝材(1‐3周龄)在30天内的释放情况如图8所示。所有丝材均表现出初始突释相,随后为缓慢的持续释放相。初始快速释放是由于位于丝材表面或近表面的药物迅速溶解所致。第一阶段后,药物通过从聚合物基质内部扩散而缓慢释放。最低载药量的丝材表现出最快的初始释放速率和最高的总体释放量,而30%载药量的样品则表现出最慢的释放曲线和最低的释放量。文献中报道了相反的结果,即高载药量PCL植入物的药物释放速度比低载药量PCL植入物更快。然而,在那些研究中,药物主要以结晶态存在。在本研究中,掺入药物的最大比例是以分子分散形式存在于含5%药物的丝材的聚合物基质中,其次是含15%和30%药物的丝材。分子分散或无定形吲哚美辛的溶出速率快于其结晶态,因此含有较高溶解度吲哚美辛的丝材药物释放百分比更高。含15%吲哚美辛的丝材在最初几天内释放的药物量高于其他丝材。显然,该丝材表面存在最大量的分子分散药物。数天后,所有丝材的释放速率均减缓。
所有3个原型样品(1‐2周龄)均显示出与丝材相似的药物释放曲线。突释相之后,药物通过已释放药物分子和晶体后残留的孔隙从内部向外部缓慢扩散。含5%吲哚美辛的原型样品药物释放最快,而含30%吲哚美辛的原型样品释放最慢。3D原型样品的整体药物释放速度均快于相应的丝材。丝材与3D原型样品之间在外部和内部结构及几何结构上的差异,以及药物结晶度的差异,是影响这些配方药物释放模式的主要因素。最佳载药量百分比取决于所用PCL聚合物中吲哚美辛的期望的药物释放特性。如果需要最快的释放速率,应选择最低的载药量,反之亦然。对于宫内系统(IUS),需要缓慢释放速率;因此,应在仍可进行热熔挤出和3D打印的前提下,为药物‐聚合物混合物选择较高的载药量水平。
药物释放机制
对体外PCL样品的药物释放数据进行了零级、一级、希古奇和 Korsmeyer ePeppas模型拟合(表2)。最佳拟合结果由希古奇平方根模型获得(R² > 0.99 values for all samples),表明扩散是药物从PCL聚合物中释放的主要释放机制,而与样品的几何结构和载药量无关。释放常数k H与观察到的释放曲线数据一致(file data(图8),即不同配方的释放曲线越接近,其常数值越相似。files of the different formulations, the more similar values of their constants are。
聚己内酯在体外释放中的降解
聚己内酯的降解是一个两阶段过程,初始阶段由于链断裂导致分子量损失,但无明显质量损失。当分子量损失达到5000时,由于小分子聚合物片段从基质中扩散出去,开始出现质量损失。在本研究中,聚己内酯在体外释放条件下的降解体外释放条件下,通过计算聚合物随时间的质量损失来监测。在5%载药量的产品中,聚合物质量损失最低,无论是filament还是IUS样品,与载药量较高的样品相比(表3)。聚合物质量损失最高的样品是载药量最高的样品。根据Cheng et al.的观点,这可能是由于掺入的药物量越多,在药物释放后产生的孔隙和通道也越多。增加的表面积有助于释放介质更好地渗透到PCL基质中,从而促进降解过程。此外,弱酸性吲哚美辛(pKa 4.5)可能会加速酸性降解产物的形成,从而缩短PCL 的降解半衰期。不同载药量的打印样品的质量损失高于相应的 HME filament,但5%载药量的样品除外。然而,5%吲哚美辛的打印原型与filament之间的差异不显著(p > 0.05,非配对t检验)。原型较高的质量损失可归因于其结构较相应的filament更为疏松。IUS原型以10%的infill参数进行打印,导致内部结构部分中空,而filament则是挤出成内部均匀致密的固体。实验结果表明,在30天释放试验中 PCL的降解速率较低(≤3.12%),这与早期研究结果一致。由此我们得出结论:PCL的降解对所有处方中药物的释放机制影响较小。
结论
将3D打印与热熔挤出(HME)相结合,被证实是一种适用于基于打印机原始原料聚己内酯(PCL)制造长效可植入载药宫内系统(IUS)的有效方法。所制备的T型原型样品在其主体结构全长范围内含有不同量的药物。较高的载药量导致医疗器械质量下降。在所有经过HME和 3D打印的产品中,药物至少部分溶解于聚合物中。药物含量较低的产品中,溶解药物的比例更高。结晶度的差异以及产品几何结构和内外部结构对药物释放速率的影响最为显著。体外研究表明,扩散是丝材和原型样品中药物释放的主要机制,而PCL的生物降解影响甚微。3D原型样品中药物的固态性质不稳定。吲哚美辛在储存过程中表现出重结晶倾向。后续将开展进一步研究,以控制这些3D打印原型中成分的固态特性,若作为实际IUS使用,其稳定性需满足3至5年的要求。
 )
)

| 样品 | 理论值 (mg) | 理论值 (%) | 理论值 (比例) | 实际值 (mg) | 实际值 (%) | 实际值 (比例) |
|---|---|---|---|---|---|---|
| 5%丝材 | 6.5 ± 0.1 | 100 ± 0.1 | 5.0:95.0 | 4.8 ± 0.1 | 73.6 ± 0.3 | 3.7:96.3 |
| 灯丝 15% | 19.5 ± 0.2 | 100 ± 0.2 | 15.0:85.0 | 15.0 ± 0.2 | 76.8 ± 1.1 | 11.5:88.5 |
| 灯丝 30% | 39 ± 0.1 | 100 ± 0.1 | 30.0:70.0 | 35.3 ± 4.0 | 89.8 ± 10.3 | 27.0:73.0 |
数据以均值 ± SD,n ¼ 3 表示。
| 模型 | 零级 | 一级 | 希古奇 | Korsmeyer ePeppas |
|---|---|---|---|---|
| R² | R² | k H | R² | |
| 5%丝材 | 0.9391 | 0.9351 | 6.01 | 0.9986 |
| 灯丝 15% | 0.9620 | 0.9741 | 2.67 | 0.9980 |
| 灯丝 30% | 0.9323 | 0.9795 | 1.37 | 0.9974 |
| 宫内节育系统 5% | 0.9380 | 0.9801 | 7.05 | 0.9978 |
| 宫内节育系统 15% | 0.9031 | 0.9567 | 6.10 | 0.9926 |
| 宫内节育系统 30% | 0.9072 | 0.9608 | 2.87 | 0.9961 |
在模型中使用了前60%的药物释放数据以获得相关系数 R²。
| 样品 | 药物释放率(%) | PCL质量损失(%) |
|---|---|---|
| 5%丝材 | 104.1 ± 8.5 | 1.3 ± 0.2 |
| 灯丝 15% | 64.4 ± 1.3 | 1.5 ± 0.1 |
| 灯丝 30% | 34.9 ± 0.6 | 2.1 ± 0.1 |
| 宫内节育系统 5% | 99.4 ± 2.5 | 1.0 ± 0.4 |
| 宫内节育系统 15% | 87.4 ± 0.4 | 2.4 ± 0.2 |
| 宫内节育系统 30% | 67.6 ± 2.0 | 3.1 ± 0.8 |




















 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








