
免疫组织化学 (Immunohistochemistry,IHC),一种用于检测组织切片中特定抗原或蛋白质的方法。以已知的抗体为探针,与组织或细胞中的特定抗原 (如多肽、蛋白质等) 进行特异性的结合。随后,利用化学反应将这些抗原-抗体复合物进行可视化,从而实现对未知抗原在组织或细胞中的定性、定位甚至定量研究。

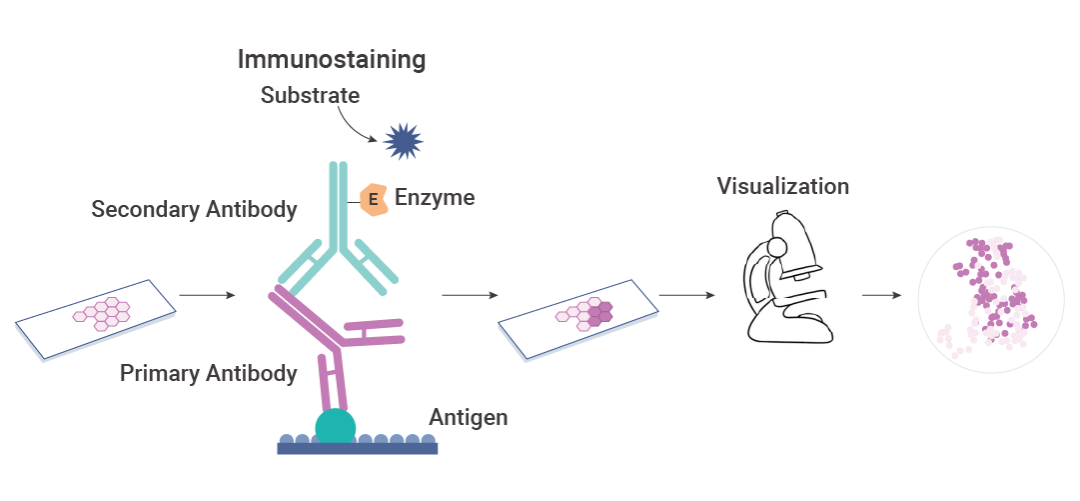
图 1. 免疫组织化学 (IHC) 原理图。
IHC 检测可分为直接法 (又称一步法) 和间接法 (二步、三步或多步法)。直接检测方法是直接与偶联物 (例如荧光染料、酶、胶体金或生物素) 结合标记的一抗的一步过程。直接法快速,但对于检测常规处理的组织中的大多数抗原缺乏足够的灵敏度 (图 2)。

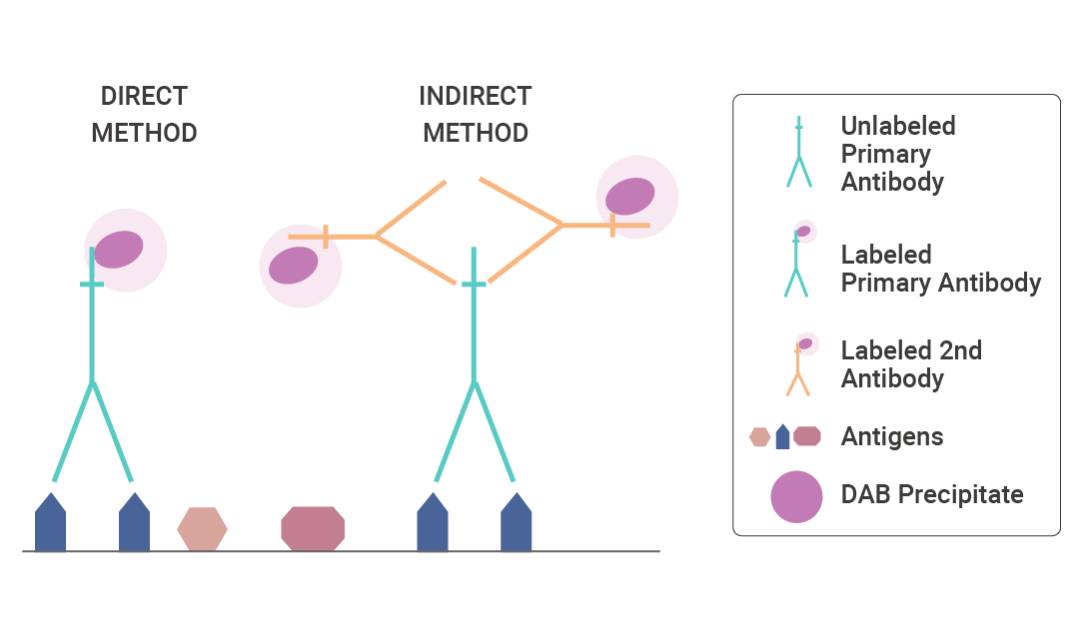
图 2. 直接和间接免疫组织化学 (IHC) 方法[1]。
为了满足灵敏度更高的抗原检测的需求,Coons 等人开发了一种两步法。第一层抗体未标记,而第二层抗体 (针对一抗而产生) 则被标记 (图 2)。
间接法的灵敏度高于直接法:
未标记的一抗保留了完全的亲和力,具有更强的抗原结合力,并且每分子一抗的标记物(例如过氧化物酶)数量更多,从而增加了反应强度。
-
间接法可以用较少的一抗检测较少量的抗原,用于放大一抗信号,因为一个一抗至少可以结合两个带标记的二抗。
-
间接法也比直接法更方便,因为相同的二抗可用于检测不同的一抗,前提是后者是在同一物种中产生的。

IHC 实验流程:通常包括样本固定、包埋、切片、脱蜡水化、抗原修复、灭活、封闭、一抗孵育、二抗孵育、显色、复染、封片观察 12 个部分。

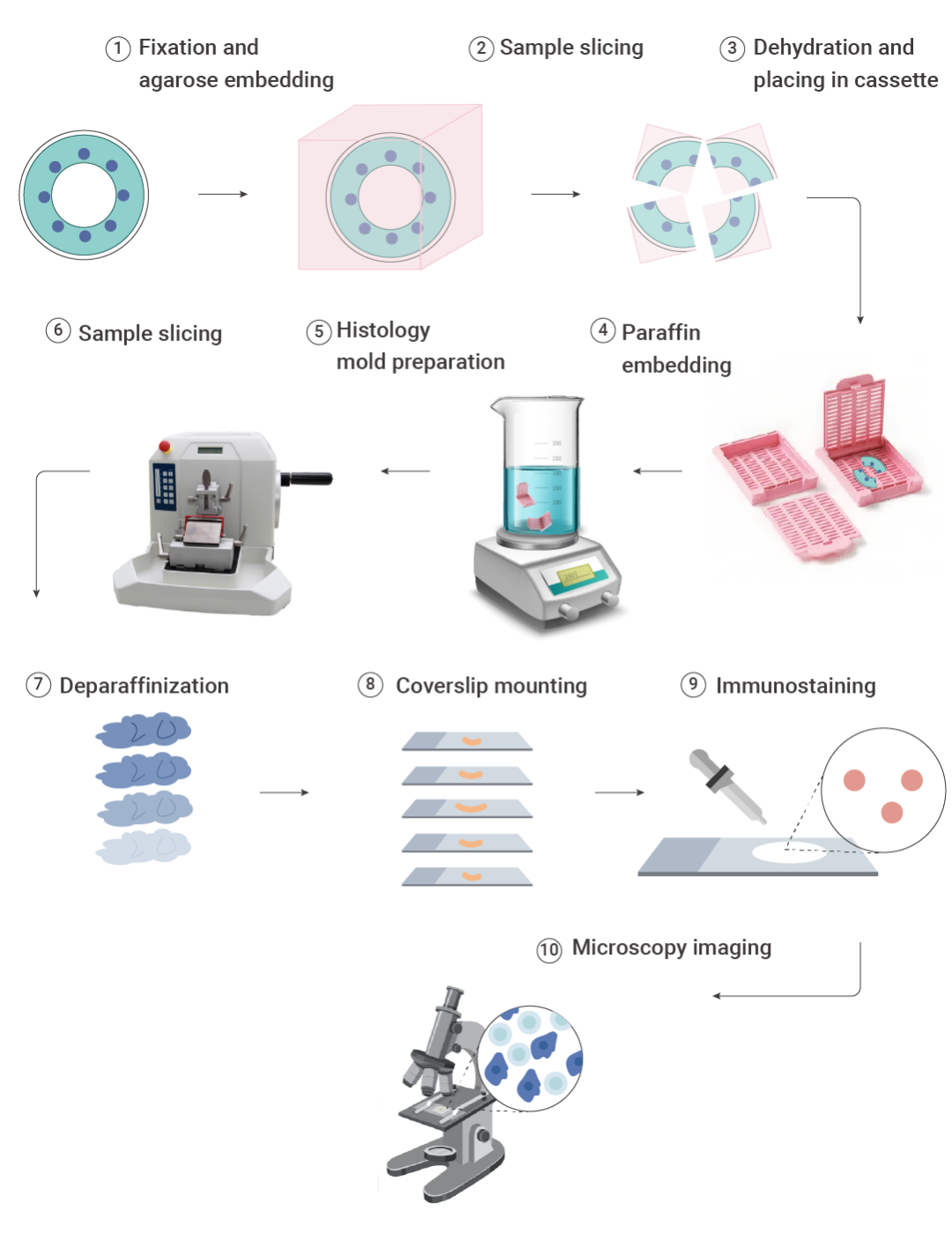
图 3. 免疫组化(IHC)流程图[2]。
1
样本固定
目的
1) 充分保存细胞成分,包括可溶性和结构性蛋白质;
2) 防止细胞成分 (包括抗原和酶) 自溶和置换;
3) 稳定细胞材料,避免后续程序产生有害影响;
4) 便于常规染色和免疫染色[1]。
甲醛是常规组织学和免疫组织化学固定剂的金标准。甲醛主要保存肽和细胞器的一般结构。
向上滑动阅览
基本步骤:
1)取材:从动物或人体取得所需的组织样本。对于组织块,要确保其大小适中,不宜过大,以便于固定液能够充分渗透。
2)初步处理:如果组织样本带有血液或其他体液,应先用生理盐水或 PBS 进行冲洗,以去除这些可能影响固定效果的物质。
3)固定:将组织样本放入固定液中。常用的固定液包括 10% 中性缓冲福尔马林 (Formalin,也称为甲醛)、甲醇、乙醇或它们的混合液等。固定液的量通常为组织体积的 10-20 倍,以确保组织能够充分浸入固定液中。大组织标本应切开固定,以免中间部分自溶解腐败。
☑ 固定时间根据组织类型和实验要求而定,一般固定时间室温 18-24 h。
4)固定后的处理:固定完成后,将组织从固定液中取出,用流水冲洗数分钟,以去除残留的固定液和可能产生的结晶。
注意事项:
-
固定的时间不宜过长,以免导致组织过度硬化和抗原性的丧失。
-
固定的温度通常为室温或 4°C,避免高温导致组织损伤。
-
在固定过程中,要确保组织样本完全浸入固定液中,避免出现未固定的部分。
-
固定的容器应干净、无杂质,避免对组织造成污染。
2
包埋
目的
保护和支撑组织样本,以便在切片时保持其完整性。通过将组织样本嵌入到固体介质中,可以制作出适合在显微镜下观察的薄切片。
常用的包埋介质包括石蜡、树脂等。石蜡包埋是免疫组化中最常用的方法,因为它可以有效保存组织形态,提升切片质量。树脂包埋则常用于需要更高分辨率或特殊染色方法的样本。
向上滑动阅览
基本步骤:
1)脱水:在组织





 最低0.47元/天 解锁文章
最低0.47元/天 解锁文章

















 8411
8411

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








