基于多模态超声和光声断层扫描的乳腺肿瘤切缘高速术中评估
摘要
传统的乳腺肿瘤切缘评估方法需要较长的周转时间,可能导致接受保乳手术的患者需要再次手术。光声断层扫描(PAT)已被证明可用于小动物和人体乳腺中脂肪组织的成像。在此,我们展示了一种定制的多模态超声和光声断层扫描系统,用于对66名患者的新鲜保乳手术标本进行术中乳腺肿瘤切缘评估。该系统可在10分钟内提供整个切除组织的切缘状态。通过三名研究人员的主观判读,与术后组织学结果对比显示,其敏感性分别为85.7% [95% 置信区间(CI),42.0% ‐ 99.2%] ,特异性为84.6%(95% 置信区间,53.7% ‐ 97.3%); 71.4%(95% 置信区间,30.3% ‐ 94.9%)敏感性和92.3%(95% 置信区间,62.1% ‐ 99.6%) 特异性;以及100%(95% 置信区间,56.1% ‐ 100%)敏感性和53.9%(95% 置信区间,26.1% ‐ 79.6%)特异性。此外,针对具有挑战性的导管原位癌 in situ 组织,部署了一种基于机器学习的算法进行切缘评估,实现了85.5%(95% 置信区间,75.2% ‐ 92.2%)的敏感性和90%(95% 置信区间,79.9% ‐ 95.5%)的特异性。这些结果表明,多模态超声和光声断层扫描技术在术中乳腺肿瘤切缘快速且准确评估方面具有巨大应用潜力。
1. 简介
每年,美国有~249,000例新诊断的乳腺癌病例,其中70%接受保乳手术,即乳房肿瘤切除术 [1]。与乳房切除术相比,乳房肿瘤切除术联合放射治疗在早期乳腺癌治疗中具有相当的生存结果,是早期乳腺癌首选的外科干预方式[2‐5]。然而,由于乳房肿瘤切除术中未能获得清晰或阴性切缘,20%至40%的患者需要进一步手术干预,形式为再次切除或乳房切除术[6‐10]。因此,获得准确的术中切缘状态反馈的能力将减少再次切除的需求以及手术相关费用。目前,已有多种现有的或新兴的术中乳腺肿瘤切缘评估的成像工具(表S1)。冰冻切片和印片细胞学已应用于临床,但由于取样率限制[11‐14],存在操作时间长和敏感性低(70%)的问题。射频光谱学可缩短操作时间,但仍因缺乏化学选择性而受限于较低的敏感性(70%)和特异性(68%)[15,16]。术中X射线可在几分钟内通过显示二维投影提供深度方向上的切缘状态,但由于组织边界定义不清,其敏感性(49%)被报道为非常低[17,18]。新兴的光学技术,包括光学相干断层扫描(OCT)、拉曼光谱学和漫反射成像,虽然提高了敏感性和特异性,但仍存在操作时间长、成像深度不足或检测区域有限等问题[19‐22]。因此,开发一种快速、准确且能够对整个组织表面进行充分成像深度测量的术中切缘评估工具仍存在未满足的需求[22,23]。
术中超声已被用作保乳手术中的引导工具,以定位肿瘤位置[24]。最近的一项研究表明,高频超声在导管原位癌中用于术中乳腺肿瘤切缘评估具有74%的敏感性和85%的特异性 in situ[25]。光声断层扫描(PAT)与传统超声检查兼容,已被证明能够在深层组织成像中实现快速成像,具备光学吸收对比和亚毫米分辨率[26,27]。基于血红蛋白或外源性对比剂的电子吸收,PAT已被用于在小鼠模型中研究脑功能、肝脏疾病、牙齿健康以及乳腺肿瘤切缘[28‐32]。特别是,基于血红蛋白吸收,PAT在近期的临床研究中被用于检测因异常血管生成引起的乳腺癌[33‐37]。此外,基于DNA和RNA的电子吸收,光声显微镜被用于分析肿块切除标本以进行切缘评估[38]。更近的研究发现,利用第二光学窗口中脂质倍频吸收为基础的PAT(图S1)开辟了多种应用,包括血管内斑块成像、外周神经成像等[39‐41]。由于人体乳腺具有丰富的脂质含量,这些先前的技术进步阐明了第二窗口光声成像技术结合超声在乳腺肿瘤切缘评估中的应用。
本文中,我们展示了多模态超声和光声成像系统首次应用于乳腺肿瘤切缘的术中快速评估,具有高敏感性和特异性。通过采用定制自动组织扫描仪,该系统可在10分钟内提供整个组织表面的二维图像堆栈,光声成像深度为6毫米,轴向分辨率为~200μm。该系统输出两个成像通道:显示组织形态的高频超声图像,以及指示脂质分布的光声图像,而脂质是人体乳腺中健康组织的主要成分。在一项针对66名患者的临床研究中,我们对全部新鲜切除的乳腺肿瘤组织进行了成像,并将其与相应的组织学结果进行对照,以确定敏感性和特异性。通过三名研究人员的主观判读,结果显示敏感性分别为85.7%(95% 置信区间,42.0% ‐ 99.2%),特异性为84.6%(95% 置信区间,53.7% ‐ 97.3%);敏感性为71.4%(95% 置信区间,30.3% ‐ 94.9%),特异性为92.3%(95% 置信区间,62.1% ‐ 99.6%);以及敏感性为100%(95% 置信区间,56.1% ‐ 100%),特异性为53.9%(95% 置信区间,26.1% ‐ 79.6%)。此外,为了减少读片者的主观差异并缩短判读时间,我们采用深度卷积神经网络(CNN)机器学习算法来区分导管原位癌的阳性切缘与阴性切缘,实现了85.5%(95% 置信区间,75.2% ‐ 92.2%)的敏感性和90%(95% 置信区间,79.9% ‐ 95.5%)的特异性。综上所述,这些结果表明多模态超声和光声成像技术在保乳手术中对乳腺肿瘤切缘评估具有转化潜力和术中实用性。
2. 结果与讨论
2.1. 术中多模态超声和光声断层扫描系统的工程设计
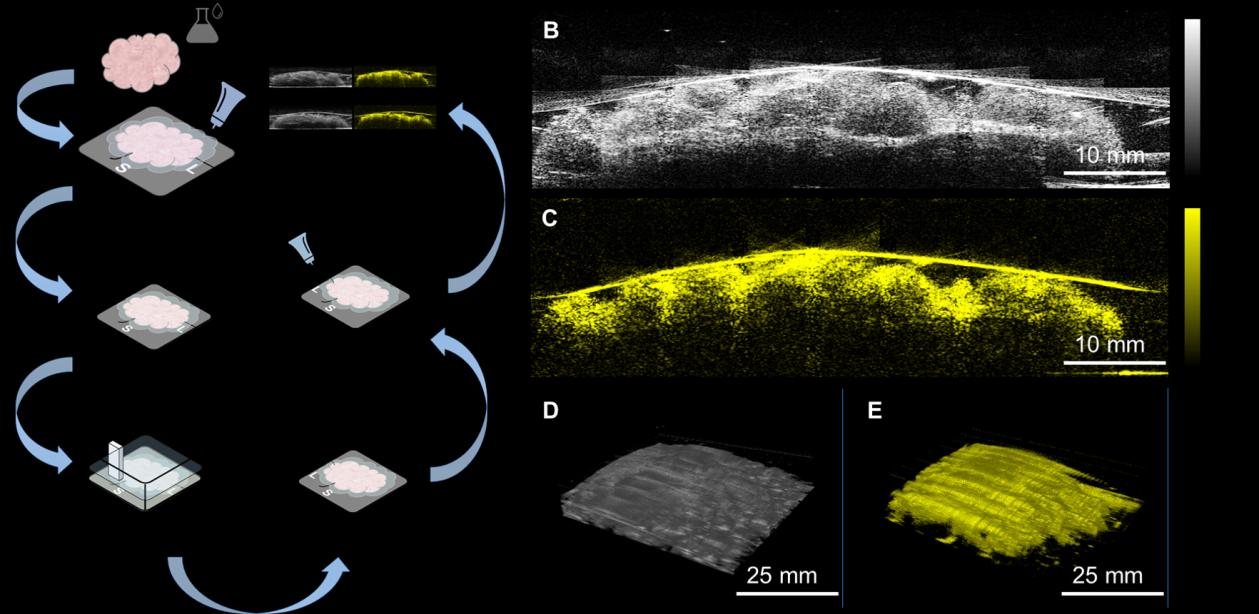
利用脂质的倍频吸收作为对比机制,我们构建了一套多模态超声和光声成像系统,能够快速自动地检测超声/光声信号(图1),目标是在10分钟内区分乳腺癌与非癌组织,检测深度达表面下2 mm。该系统采用定制的全固态拉曼激光器作为激发源,因其输出波长位于光学窗口内,可特异性地可视化乳腺中的脂质 [42,43]。在1197纳米波长下,以10赫兹频率发射、脉冲能量为100毫焦的10纳秒脉冲序列通过光纤束传输至切除的乳腺组织,从而有效且充分地激发乳腺组织中的脂质产生光声信号(图S2)。所产生的光声信号由一个定制的18兆赫高频超声阵列(含128个元件,50%带宽)接收。同时,同一换能器阵列发射并接收超声信号,并由高频超声成像系统进行处理。激光器与超声系统连接至计算机,用于同步触发并可视化配准的超声/光声图像。为了满足快速术中切缘评估的需求,基于对来自总共36名患者的标本进行的一系列临床测试,设计并构建了一个自动组织扫描仪(图S3)。在最终版本中,实现了10 x 10 cm²范围内的二维扫描,耗时仅2分钟,覆盖了大多数乳房肿瘤切除术中切除的乳腺肿瘤组织的尺寸 [22]。为适应扫描过程中组织表面的不规则性,采用了共线设计来制备成像探头(图S4),该探头由超声换能器、光纤束、一对柱面透镜和两片玻璃片组成。成像探头的光照情况与使用MATLAB中的射线光学仿真工具箱进行的传输模拟结果一致(图S5),表明从探头末端发出的光是准直的。借助这种共线设计,对新鲜切除的乳腺肿瘤组织进行了成像结果显示6毫米光声成像深度和13.4毫米适应性,是传统分叉设计的两倍(图S6)。
2.2. 成像方案的开发
共纳入30名女性患者(表S3)进行一项研究,以确定多模态超声和光声成像系统的敏感性和特异性。研究在印第安纳大学健康西蒙癌症中心招募了因乳腺癌诊断需进行乳房肿瘤切除术的患者,这些患者经术前影像和核心活检诊断为导管原位癌(DCIS)和浸润性导管癌(IDC)。所有患者均在手术前一天签署了知情同意书,并按照印第安纳大学健康机构审查委员会批准的方案参与本研究。研究中所有部分均已去除患者姓名及其他HIPAA标识符。
在乳房肿瘤切除术中,肿瘤团块被切除后,首先用一条长缝线标记外侧边缘,一条短缝线标记上缘进行定位。然后将其放置在样本托盘上,并在其表面涂抹透明超声凝胶以实现信号耦合(图2A)。将涂有凝胶的标本托盘插入组织扫描仪中,关闭扫描仪盖子,使凝胶与水箱的塑料薄膜接触。同时,当盖子关闭时,蒸馏水会自动注入水箱。在2分钟内,对10×10 cm²区域采集了共1000幅二维(2D)超声/光声图像(图2B、C),并以三维(3D)布局呈现(图2D、E)。首次成像完成后,将组织从扫描仪中取出,翻转180度,重复上述步骤以获取另一表面的边缘信息。通过自动扫描设计,我们将整个操作时间缩短至<10分钟。最后,组织被清洁并送至组织学室进行进一步的标准组织病理学分析。参与数据采集的研究人员对最终组织学结果完全不知情。
2.3. 图像分析与评估方案
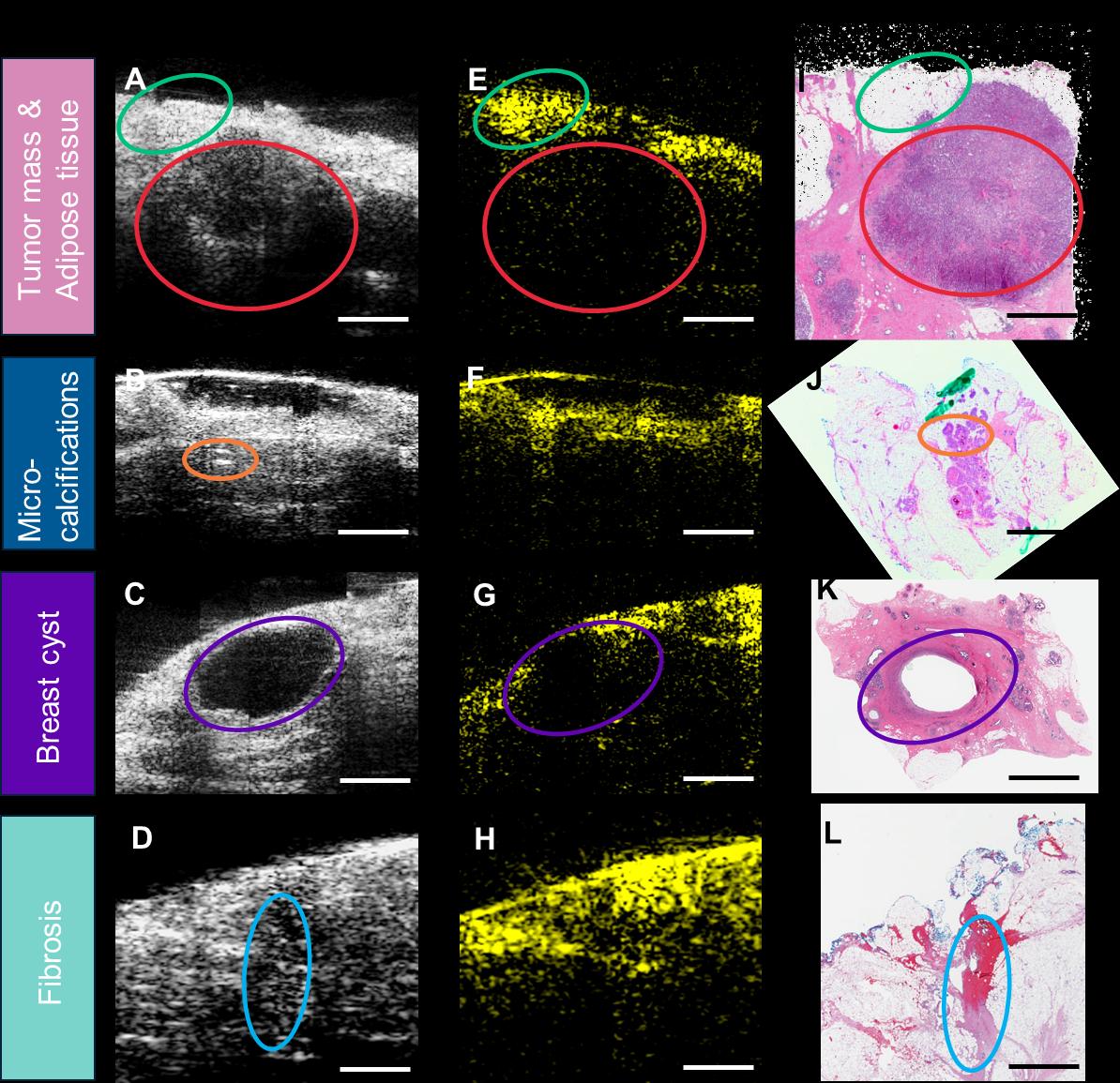
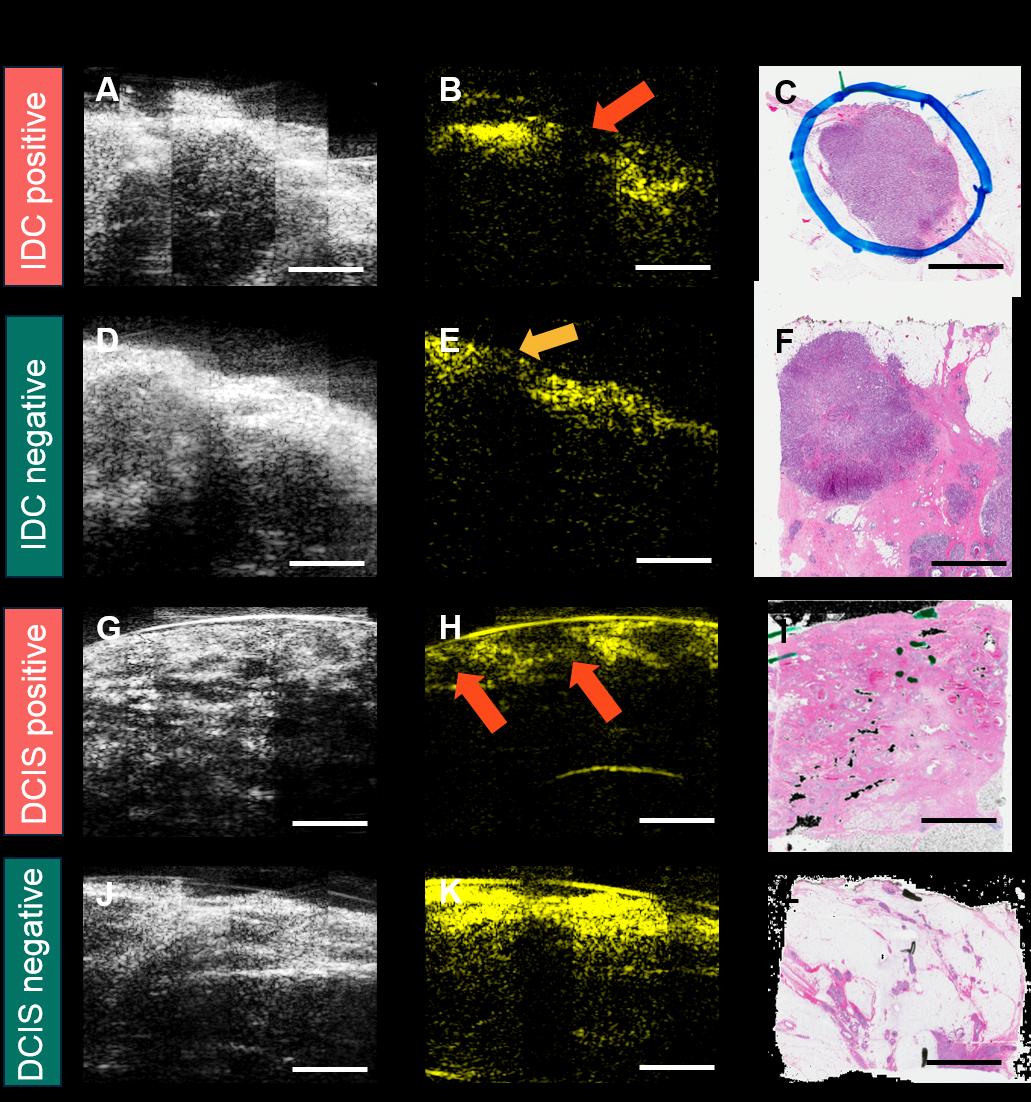
所有超声/光声图像均按照经乳腺成像专科培训的经委员会认证的放射科医生所推荐的相同标准进行采集和处理,并以相同的亮度水平和对比度尺度显示。前10例入组患者的数据被用作训练集以建立评估标准。训练数据集中具有不同特征的代表性图像如图3所示。第一列(图 3A‐D)为二维超声图像,显示了肿瘤团块(红色椭圆)、微钙化(组织内部的亮斑,橙色椭圆)、乳腺囊肿(紫色椭圆)以及纤维化(蓝色椭圆)。第二列(图3E‐H)为二维光声图像,显示了脂肪组织分布(绿色椭圆)。所有图像均通过第三列对应的苏木精和伊红(H&E)染色组织学图像(图3I‐L)进行确认[44,45]。根据外科学会肿瘤学分会‐美国放射肿瘤学会‐美国临床肿瘤学会2016年发布的最新共识指南,浸润性导管癌(IDC)要求墨水线清晰切缘,而导管原位癌(DCIS)则要求距组织表面至少2毫米清晰切缘[23]。因此,对于IDC,如果其表面未完全被脂肪组织覆盖(表面无光声信号),则判定为阳性切缘(图4A‐C),这与当前侵袭性乳腺切缘指南中关于墨水线切缘的标准一致。对于DCIS,若其表面未被至少2毫米厚的脂肪组织覆盖,或在距表面2毫米范围内发现微钙化,则判定为阳性切缘(图4G‐I)。切缘评估基于每份组织的全部超声/光声图像进行,只要至少有一个图像帧显示异常,该组织即被判定为切缘阳性。
2.4. 基于主观阅读的性能
进行了一项盲法主观阅片人研究,以评估术中多模态超声和光声断层扫描系统在统计学上的性能。使用其余20名患者的数据来计算与组织/患者层面乳腺肿瘤组织切缘判读相关的敏感性和特异性(表1)。本研究招募了三名阅片者,包括一名影像学研究人员、一名乳腺外科医生和一名经认证的放射科医师。首先为阅片者提供一组包含肿瘤团块、微钙化、脂肪组织和乳腺囊肿的超声/光声图像样本作为训练集,以帮助其熟悉成像系统所获取的图像。然后,要求每位阅片者观察20个乳腺组织的图像,并按照1到4的等级对组织进行评分:i)评分为1表示阅片者确信切缘无癌;ii)评分为2表示阅片者认为切缘可能无癌,但存在一定不确定性;iii)评分为3表示阅片者认为切缘可能有癌,但存在一定不确定性;iv)评分为4表示阅片者确信切缘有癌。阅片结束后,仅当评分为1时,判定切缘为阴性,若评分为2、3或4,则判定为阳性,这代表一种保守临床情景。在阅片过程中,每位阅片者首先被要求仅通过观察每个组织的超声图像来评估组织切缘。随后,再要求每位阅片者通过观察每个组织的超声加光声图像来评估切缘,以判断光声图像是否能够改善阅片结果。表1列出了每位阅片者的统计结果。结果显示,仅使用超声图像时,三位阅片者的敏感性分别为71.4%(95% 置信区间,30.3% ‐ 94.9%),特异性分别为76.9%(95% 置信区间,46.0% ‐ 93.9%)、71.4%(95% 置信区间,30.3% ‐ 94.9%)敏感性和53.9%(95% 置信区间,26.2% ‐ 79.6%)特异性,以及71.4%(95% 置信区间,30.3% ‐ 94.9%)敏感性和61.5%(95% 置信区间,32.3% ‐ 84.9%)特异性。然而,使用超声图像加光声图像后,结果分别为85.7%(95% 置信区间,42.0% ‐ 99.2%)敏感性和84.6%(95% 置信区间,53.7% ‐ 97.3%)特异性,71.4%(95% 置信区间,30.3% ‐ 94.9%)敏感性为92.3%(95% 置信区间,62.1% ‐ 99.6%),特异性为53.9%(95% 置信区间,26.1% ‐ 79.6 %);以及敏感性为100%(95% 置信区间,56.1% ‐ 100%),特异性为53.9%(95% 置信区间,26.1% ‐ 79.6%)。


2.5. 基于机器学习的性能
乳腺外科医生或放射科医生对超声/光声图像的主观解读耗时较长(每组织10至15分钟,每帧3至5秒),且存在读片者偏差。因此,在保乳手术中,人们更倾向于使用能够快速提供一致且准确切缘评估的系统。我们采用了一种名为深度卷积神经网络(CNN)的基于机器学习的算法进行乳腺肿瘤切缘评估,因为该方法所需的预处理较少,并可实现端到端的有监督学习[46,47]。在本研究中,应用并通过对迁移学习进行调整的GoogLeNet Inception v3 CNN架构用于切缘评估。基于在ImageNet数据集上预训练的Inception v3架构,首先将原始的叶节点替换为我们自定义的双节点(阳性对阴性)。然后,分别通过受试者工作特征(ROC)曲线中距对角线最远点的准则,确定超声模型和光声模型的最佳阈值。
通过翻转和旋转多模态PAT系统生成的图像,构建了一个包含1052个阳性帧和918个阴性帧的训练数据集。这些帧被判定为阳性或阴性是基于经过培训的放射科医师对超声和光声图像的判读结果,并且还与病理学家判读的病理H&E染色结果进行了关联。分别使用仅超声数据和仅光声数据独立训练了两个卷积神经网络模型。然后通过或方法(OR method)将这两个模型结合起来,即如果超声模型或光声模型中任一模型预测为阳性,则该图像被分类为阳性(图5)。测试集由76个阳性帧和70个阴性帧组成,其中的切缘状态由一名经认证的放射科医师确定。仅超声CNN模型在切缘评估中的最佳敏感性为57.9%(95% 置信区间,46.0% ‐ 69.0%),特异性为100%(95% 置信区间,93.5% ‐ 100%),对应的曲线下面积(AUC)为0.81。仅光声CNN模型在切缘评估中的最佳敏感性为77.6%(95% 置信区间,66.4% ‐ 86.1%),特异性为90.0%(95% 置信区间,79.9% ‐ 95.5%),AUC为0.87。超声‐光声联合模型在切缘评估中取得了最佳敏感性85.53%(95% 置信区间,75.2% ‐ 92.2%),特异性90.0%(95% 置信区间,79.9% ‐ 95.5%),对应的AUC为0.93(超声阈值固定)或0.88(光声阈值固定)。
2.6 讨论
乳腺保留手术的目标是在尽可能保留正常组织以获得最佳美容效果的同时,切除所有癌组织。实现切除的乳腺肿瘤组织的阴性切缘状态——局部复发的关键预测因素[48,49], ——需要一种快速且准确的术中切缘评估工具。目前的方法要么操作时间较长,要么缺乏敏感性和特异性。在此,我们展示了一种用于20名患者乳腺肿瘤切缘高速且准确评估的术中多模态超声和光声断层扫描系统。
理想的术中组织切缘评估工具应能够快速成像整个组织表面。在乳腺保留手术中,切除组织可能具有任意形状和大尺寸,其组织表面积通常在1 cm² 到100 cm²之间。组织表面不可避免地存在大量波动和不规则性,例如组织峰谷之间的高度差可达10毫米。传统切缘评估工具,如电共振光谱和光学相干断层扫描,其成像深度仅为< 2毫米,并且在扫描模式下无法适应此类组织表面的波动,这显著影响了评估时间。为克服这一挑战,我们开发了两个新型组件。首先,我们的共线成像探头能够提供6毫米成像深度可达13毫米,并能适应组织表面的波动。其次,我们开发了一种成像腔室,显著简化并缩短了超声/光声成像的组织制备时间。对于标本的传统扫描,需要预先准备琼脂糖凝胶溶液,倒入组织容器中,自然固化以固定组织,然后加入水以耦合组织与成像探头之间的信号。这种组织制备方法不仅复杂,而且耗时。在此,我们设计了组织盒和组织容器,可在4个步骤内5分钟内完成组织扫描准备并重建三维图像:1)成像前,用0.9%生理盐水溶液冲洗新鲜切除的乳腺组织,耗时1分钟;2)在组织表面涂抹超声耦合凝胶,耗时不到1.5分钟(取决于组织大小);3)将带有组织的组织盒插入成像腔室,耗时不到0.5分钟;4)按下按钮后,组织表面在2分钟内完成扫描。因此,用户可在5分钟内可视化一个表面的组织切缘。在本研究中,对每个组织成像两个相对的面,总耗时少于10分钟,这是迄今为止最快的术中乳腺肿瘤切缘评估工具。此外,还可重建乳腺组织的三维图像,显示肿瘤位置和大小。通过将可疑区域与乳房肿瘤切除术后形成的肿块切除腔相关联,外科医生能够定位相应的关注区域以便后续切除。
在主观判读中,读片者1仅使用超声图像时敏感性为71.4%(95% 置信区间,30.3% ‐ 94.9%),特异性为76.9%(95% 置信区间,46.0% ‐ 93.9%);而使用超声加光声图像时,敏感性为85.7%(95% 置信区间,42.0% ‐ 99.2%),特异性为84.6%(95% 置信区间,53.7% ‐ 97.3%)。读者2仅使用超声图像时敏感性为71.4%(95% 置信区间,30.3% ‐ 94.9%),特异性为53.9%(95% 置信区间,26.2% ‐ 79.6%);而使用超声加光声图像时,敏感性为71.4%(95% 置信区间,30.3% ‐ 94.9%),特异性为92.3%(95% 置信区间,62.1% ‐ 99.6%)。读者3仅使用超声图像时敏感性为71.4%(95% 置信区间,30.3% ‐ 94.9%),特异性为61.5%(95% 置信区间,32.3% ‐ 84.9%);而使用超声加光声图像时,敏感性为100%(95% 置信区间,56.1% ‐ 100%),特异性为53.9%(95% 置信区间,26.1% ‐ 79.6 %)。显然,不同读片者的判断存在明显差异。对判定图像阳性的阈值存在不同解读,且读片者之间存在差异(读片者1与读片者2、读片者1与读片者3、读片者2与读片者3之间的科恩卡帕系数分别为0.565、0.340和0.205)。然而,即使是最保守的判读方式,其敏感性仍达到71%,特异性达到92%,优于当前的射频光谱学(敏感性71%,特异性68%)和术中X射线(敏感性49%,特异性73%)。已有报道的光学相干断层扫描技术可实现100%的敏感性和82%的特异性,但其判读标准是所有肿瘤类型均以表面墨水为切缘。然而,最新发布的乳腺切缘共识指南要求导管原位癌至少达到2毫米切缘,由于前述光学相干断层扫描探头在成像深度上的限制,在最近一项临床研究[50]中导致其敏感性仅为63%。高频超声本身在评估乳腺肿瘤切缘方面提供了较好的敏感性,特别是在浸润性导管癌标本中。然而,结合光声断层扫描后,浸润性导管癌标本中乳腺切缘的检测特异性得到提高,从而可避免不必要的组织切除。此外,通过增加光声成像通道,多模态超声和光声成像系统在in situ癌症2毫米切缘内的检测敏感性和特异性均有所提升(补充表4–6)。
基于机器学习的算法可能提高保乳手术术中切缘评估的速度、一致性和准确性。我们的结果表明,基于卷积神经网络(CNN)的模型在准确性和适应性方面优于其他自动化方法。理想的基于CNN的分类算法应仅需少量预处理,并能实时为所有肿瘤类型提供通用切缘评估。本文报道的基于CNN的分类算法能够在0.7秒/帧的速度下,区分原位肿瘤2 mm边缘区域的阳性和阴性切缘状态。我们预计,通过以下方式可进一步提高分类算法的准确性:(1)收集更多患者数据(包括阳性和阴性病例);(2)降低背景噪声并优化图像预处理参数。我们还期望获得一种更具广义性的分类算法,可用于更多类型的乳腺肿瘤通过以下方式:(1)训练更多专注于不同类型肿瘤的卷积神经网络模型;或(2)在切缘评估之前添加另一层预分类器。
3. 结论
随着乳腺癌筛查的普及,越来越多的病变在早期被发现,从而推动了乳腺保留手术的应用。实现阴性或清晰切缘对于改善临床结果至关重要。然而,在手术过程中实现高效且高敏感性的术中乳腺癌切缘评估仍存在未满足的需求。在此,我们展示了首个定制的多模态超声和PAT系统结合紧凑便携的基于拉曼激光的系统及66名患者的新鲜保乳手术标本,用于术中乳腺肿瘤切缘评估的应用。来自总共36名乳腺癌患者的新鲜保乳手术标本被用于改进系统设计,特别是共线成像探头和自动组织扫描仪。最终的系统可在10分钟内提供整个切除乳腺组织的三维组成信息。为了评估准确性,从30名患者(10名用于训练,20名用于研究)获取新鲜ex vivo人体乳腺癌组织,并在医院手术现场维持的系统上进行成像。通过三名研究人员的主观判读,与术后组织学交叉对照的结果显示分别为85.7% [95% 置信区间,42.0% ‐ 99.2%]敏感性以及84.6%(95% 置信区间,53.7% ‐ 97.3%)特异性,71.4%(95% 置信区间,30.3% ‐ 94.9%)敏感性和92.3%(95% 置信区间,62.1% ‐ 99.6%)特异性,以及100%(95% 置信区间,56.1% ‐ 100%)敏感性和53.9%(95% 置信区间,26.1% ‐ 79.6%)特异性。此外,部署了一种基于机器学习的算法——深度卷积神经网络,用于乳腺肿瘤切缘评估,达到了85.5%(95% 置信区间,75.2% ‐ 92.2%)敏感性和90%(95% 置信区间,79.9% ‐ 95.5%)特异性。这些结果表明,多模态超声和PAT技术具有作为术中乳腺肿瘤切缘评估高速且准确方法的潜力。
| 读片者 | 统计 | 超声 only | 95% 置信区间 | 超声 + 光声 | 95% 置信区间 |
|---|---|---|---|---|---|
| 读片者1 | 敏感性 | 71.4% | 30.3% ‐ 94.9% | 85.7% | 42.0% ‐ 99.2% |
| 读片者1 | 特异性 | 76.9% | 46.0% ‐ 93.9% | 84.6% | 53.7% ‐ 97.3% |
| 读者2 | 敏感性 | 71.4% | 30.3% ‐ 94.9% | 71.4% | 30.3% ‐ 94.9% |
| 读者2 | 特异性 | 53.9% | 26.2% ‐ 79.6% | 92.3% | 62.1% ‐ 99.6% |
| 读者3 | 敏感性 | 71.4% | 30.3% ‐ 94.9% | 100% | 56.1% ‐ 100% |
| 读者3 | 特异性 | 61.5% | 32.3% ‐ 84.9% | 53.9% | 26.1% ‐ 79.6% |





















 8689
8689

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








