分子动力学模拟概述:分子动力学模拟大致包括准备结构文件、预处理、能量最小化、平衡阶段和生产模拟等步骤,步骤要点如下:
- 数据准备:下载蛋白的pdb结构文件,分子的结构文件,准备相应的拓扑文件等进行后续的模拟。
- 预处理阶段:将蛋白和配体组合在一起,生成复合物的结构文件,然后需要确定模拟的体系,比如水模型(SPC、TIP3P、TIP4P等)和添加离子以中和电荷
- 能量最小化:为了消除结构中的不合理接触,比如原子间距离过近导致的高能量。通常使用最速下降法或共轭梯度法来优化结构,使得体系的总能量达到一个局部最小值,避免模拟过程中因为结构不合理而崩溃。
- 平衡阶段:分为NVT和NPT平衡。NVT平衡是为了让体系在恒定粒子数、体积和温度下达到热平衡,通常使用Berendsen或V-rescale温度耦合方法。而NPT平衡则是在恒定粒子数、压力和温度下进行,让体系的密度趋于稳定,常用的压力耦合方法有Berendsen和Parrinello-Rahman。这一步可能需要运行一段时间,确保温度和压力稳定。
- 生产模拟:长时间的数据采集阶段,生成轨迹文件用于后续分析。分析部分包括RMSD、RMSF、氢键分析、相互作用能计算等,可能需要使用GROMACS自带的工具或者第三方软件如VMD、PyMOL、MDTraj等。
基本信息
服务器内核
uname -aLinux amax 5.4.0-59-generic #65-Ubuntu SMP Thu Dec 10 12:01:51 UTC 2020 x86_64 x86_64 x86_64 GNU/Linux
cat /etc/issueUbuntu 20.04.1 LTS \n \l
安装
根据网上的传统教程先安装cmake(成功),FFTW(失败,原因 ./configure 一直报错 ),
configure: error: working directory cannot be determined而且没有其他的报错原因,所有能排查的错误原因我都一一确认无误,所以这种安装方法对我来说不可行
最后成功的过程记录如下:
1. 创建一个gmx环境 conda create -n gmx
2. 激活环境 conda activate gmx
3. 安装依赖库conda-forge conda config --add channels conda-forge
4. 设置安装通道 conda config --set channel_priority strict
5. 安装相关的包 conda install pocl oclgrind intel-compute-runtime beignet ocl-icd-system
6. 安装network conda install networkx=2.3
7. 安装gromacs(非gpu版,过程很慢,但能成功)conda install gromacs=2022.2
对蛋白配体复合物进行分子动力学模拟的操作流程
一、蛋白拓扑数据准备
安装SPDBV优化蛋白数据,将pdb文件存放在该文件夹下(应该是非必要,个人习惯存放在一起),在下图三的file按钮中进行导入,修复蛋白质结构,并导出保存为pdb格式


首先,准备蛋白的pdb文件,这里我使用的是FGSG678.pdb
gmx pdb2gmx -f FGSG678.pdb -o FGSG678_processed.gro -water spc提示选择立场,这里选择Amber99sb-ildn力场,输入6

生成三部分数据 gro itp top

二、配体拓扑数据准备
Gromacs无法对小分子配体进行处理生成拓扑文件,这里使用Sob老师开发的处理小分子软件Sobtop,这个软件仅需本地安装,安装网址Sobtop,找到Download下载,解压安装即可,运行exe开始使用。

需要准备mol2文件,打开pymol从file打开

将pdbqt格式的分子导出成mol2格式,File —> Export Molecule,跳出save窗口,选项默认,保存的时候选择mol2格式。

对.mol2文件进行预处理:使用文本编辑器打开.mol2文件,将图中位置(只需要修改第三行阴影处以及第八列)改成配体名称,并保存mol2文件

运行sobtop,添加分子mol2的路径,添加后回车

接下来有几个选项,第一步选择1,生成top文件;第二步选择3,尽可能使用GAFF力场;第三步选择0,进入下一步;第四步选择4,如果可能,预先构建成键参数,任意猜测缺少的选项;第五步回车,生成的top文件生成在sobtop软件根目录下;第六步回车,生成的itp位置限制文件在sobtop软件根目录下;第七步,选择2回车,生成gro文件;第八步,回车,生成的gro文件在sobtop软件根目录下;回车,退出sobtop软件(一步回车不行再多按一次回车)
生成gro、itp、top文件,再把这三个文件上传至服务器

三、数据合并(!!!)
打开配体的gro文件,复制分子的坐标(第三行至倒数第二行),也就是根据分子数18,复制第三列1~18的数据。

复制蛋白的gro文件,重命名为complex.gro,在倒数第二行后插入分子拓扑坐标信息,并修改第二行的原子总数(7195+18),保存
构建拓扑,将分子的拓扑文件引入到topol.top中,在include forcefield和molecule type中间添加如下内容
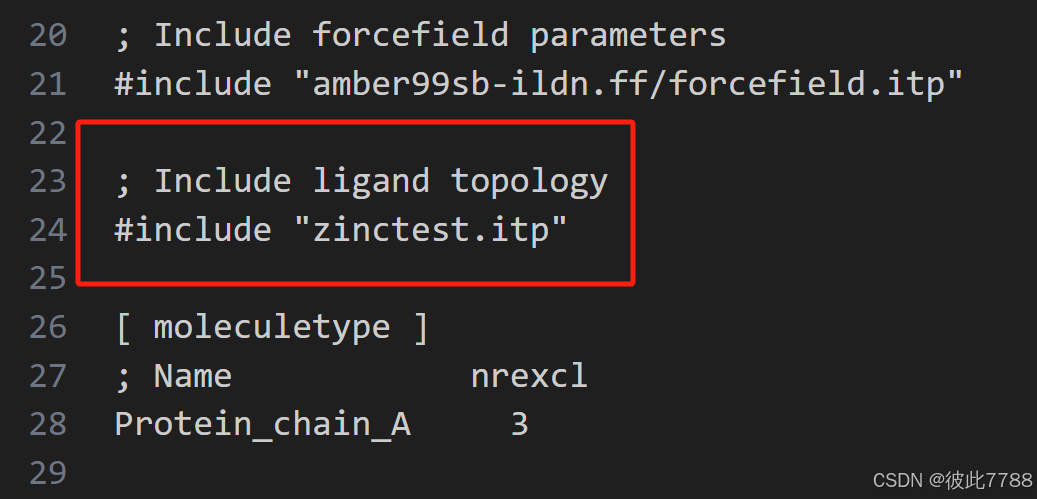
在文档末尾Molecules部分加上配体名称,保存文件。

四、体系搭建
添加盒子,
gmx editconf -f complex.gro -o newbox.gro -bt dodecahedron -d 1.0添加水模型,
gmx solvate -cp newbox.gro -cs spc216.gro -p topol.top -o solv.gro运行完命令后,打开.top文件,将最后一行SOL和后面的数字成为单独一行,保存。

添加离子
gmx grompp -f ions.mdp -c solv.gro -p topol.top -o ions.tpr选择溶剂替换分子
gmx genion -s ions.tpr -o solv_ions.gro -p topol.top -pname NA -nname CL -neutral提示选择替换溶剂分子的group时选择“SOL”(15),得到得到solv_ions.gro文件
五、能量最小化
准备em.mdp文件,其中第二行integrator=steep代表最速下降法,把 steep改为cg就代表使用共轭梯度法。可以准备两种下降法的文件,比如最速下降法保存为em1.mdp,共轭梯度法保存为em2.mdp。
; minim.mdp - used as input into grompp to generate em.tpr
integrator = steep ; Algorithm (steep = steepest descent minimization; cg)
emtol = 1000.0 ; Stop minimization when the maximum force < 1000.0 kJ/mol/nm
emstep = 0.01 ; Energy step size
nsteps = 1000 ; Maximum number of (minimization) steps to perform
; Parameters describing how to find the neighbors of each atom and how to calculate the interactions
nstlist = 1 ; Frequency to update the neighbor list and long range forces
cutoff-scheme = Verlet
ns_type = grid ; Method to determine neighbor list (simple, grid)
rlist = 1.0 ; cut-off for making neighbor list (short range forces)
coulombtype = PME ; Treatment of long range electrostatic interactions
rcoulomb = 1.0 ; Short-range electrostatic cut-off
rvdw = 1.0 ; Short-range Van der Waals cut-off
pbc = xyz ; Periodic Boundary Conditions (yes/no)
参考B站up方法,先使用steep最速下降法进行能量最小化 nsteps=10000,再进行cg共轭梯度法进行能量最小化nsteps=10000。这里使用同一个em.tpr就相当于在最速下降法处理完之后继续进行共轭梯度法处理了。
##(1)最速下降法 下降速度快但不收敛
gmx grompp -f em1.mdp -c solv_ions.gro -p topol.top -o em.tpr –maxwarn 7
gmx mdrun -v -deffnm em
##(2)共轭梯度法 下降速度慢但收敛
gmx grompp -f em2.mdp -c em.gro -p topol.top -o em.tpr –maxwarn 7
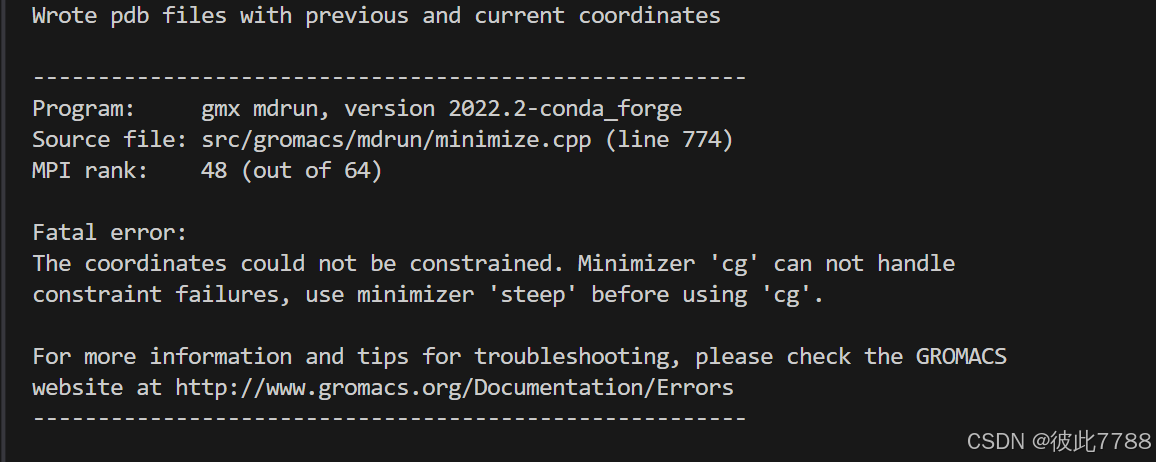
gmx mdrun -v -deffnm em在使用steep进行1000次模拟之后直接进行cg模拟出现报错,错误原因有可能是初始结构中存在原子冲突,或者steep最小化次数太少,没有达到效果。

再次设置5000次的能量最小化,进行到2000多次的时候最大力就已经低于设置的阈值1000了,所以运行结束,

最小化与最大力
在这里明确两个概念,也就是衡量能量最小化的两个指标,最小化(Energy Minimization)和最大力(Maximum Force, Fmax),这两个指标关系到模拟的稳定性和结果的可靠性,
1.最小化(Energy Minimization)
定义:
-
最小化是通过调整原子位置,使系统势能(Potential Energy)达到局部最小值的过程。
-
在模拟开始时,初始结构中可能存在原子重叠(steric clashes)或不合理的几何构型(如键长/键角偏差),导致系统势能极高。直接运行动力学模拟会因能量爆炸而失败,因此需要先进行能量最小化。
2. 最大力(Maximum Force, Fmax)
定义:
-
最大力是系统中所有原子所受力的最大值(单位为 kJ/(mol·nm))。
-
在最小化过程中,算法会迭代调整原子位置,直到最大力低于设定阈值(如
emtol = 1000或100),此时认为系统已收敛。
在上图我的输出结果中,输出信息显示 Steepest Descents converged to Fmax < 1000,说明最小化已收敛,但最大力仍较高(941.02)。
此时:
-
如果目标是初步稳定系统(例如后续进行 NVT/NPT 平衡),可以接受此结果并继续。
-
如果需进一步降低能量(例如发表级模拟或处理敏感体系),需继续优化。
在此基础上我又尝试了一下cg的能量最小化过程,发现还是出现报错,说明在cg前还是需要进行steep的能量最小化,因为只是想走一遍动力学模拟的流程,这个结果应该对后续影响不大,我就继续进行平衡阶段的模拟。
六、平衡阶段
1.限制配体
平衡蛋白配体复合物与平衡水中只包含蛋白的体系非常类似,值得注意的是:
① 对配体施加限定。
② 对于温度耦合群的处理。
为了限定配体,需要为他生成一个位置限定拓扑。首先,为zinctest创建一个只包含非氢原子的index group,逐步在命令窗口输入以下三行
gmx make_ndx -f jz4.gro -o index_jz4.ndx
> 0 & ! a H*
> q
执行genrestr模块,选择新创建的index group(在index_zinctest.ndx文件中是group 3)
gmx genrestr -f zinctest.gro -n index_zinctest.ndx -o posre_zinctest.itp -fc 1000 1000 1000选择group3

2.添加限制配体到拓扑文件中
如果我们想在无论蛋白是否被限定的条件下对配体施加限定,在拓扑文件的Include ligand topology之后中加入如下内容:
; Ligand position restraints
#ifdef POSRES
#include "posre_zinctest.itp"
#endif把这段内容添加到这两部分之间

必须要把限定这段话加在Include ligand topology之后,Include water topology之前,加在其他任何地方都会报错。
由于对只有几个原子的组在控制其动能的涨落时, 温度耦合算法不够稳定,不要对体系中的每一单个物种使用独立的耦合。创建一个特殊的组, 其中包含蛋白质和配体。
gmx make_ndx -f em.gro -o index.ndx
> 1 | 13
> q3.NVT平衡
创建nvt.mdp文件,将以下部分复制入文件中:
title = Protein-ligand complex NVT equilibration
define = -DPOSRES ; position restrain the protein and ligand
; Run parameters
integrator = md ; leap-frog integrator
nsteps = 50000 ; 2 * 50000 = 100 ps
dt = 0.002 ; 2 fs
; Output control
nstenergy = 500 ; save energies every 1.0 ps
nstlog = 500 ; update log file every 1.0 ps
nstxout-compressed = 500 ; save coordinates every 1.0 ps
; Bond parameters
continuation = no ; first dynamics run
constraint_algorithm = lincs ; holonomic constraints
constraints = h-bonds ; bonds to H are constrained
lincs_iter = 1 ; accuracy of LINCS
lincs_order = 4 ; also related to accuracy
; Neighbor searching and vdW
cutoff-scheme = Verlet
ns_type = grid ; search neighboring grid cells
nstlist = 20 ; largely irrelevant with Verlet
rlist = 1.2
vdwtype = cutoff
vdw-modifier = force-switch
rvdw-switch = 1.0
rvdw = 1.2 ; short-range van der Waals cutoff (in nm)
; Electrostatics
coulombtype = PME ; Particle Mesh Ewald for long-range electrostatics
rcoulomb = 1.2 ; short-range electrostatic cutoff (in nm)
pme_order = 4 ; cubic interpolation
fourierspacing = 0.16 ; grid spacing for FFT
; Temperature coupling
tcoupl = V-rescale ; modified Berendsen thermostat
tc-grps = Protein_MOL Water_and_ions ; two coupling groups - more accurate
tau_t = 0.1 0.1 ; time constant, in ps
ref_t = 300 300 ; reference temperature, one for each group, in K
; Pressure coupling
pcoupl = no ; no pressure coupling in NVT
; Periodic boundary conditions
pbc = xyz ; 3-D PBC
; Dispersion correction is not used for proteins with the C36 additive FF
DispCorr = no
; Velocity generation
gen_vel = yes ; assign velocities from Maxwell distribution
gen_temp = 300 ; temperature for Maxwell distribution
gen_seed = -1 ; generate a random seed






















 1006
1006

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








