小编尽量讲述一些浅显易懂的内容,避免生搬硬套那些晦涩难懂的理论,但必要的理论支撑还是需要的:实操和接地气永远是主旋律!
大肠杆菌表达操作简单,成本低廉,易于大规模生产,这些是大肠杆菌表达体系广受欢迎的主要原因。然而,外源蛋白在大肠杆菌中表达最大的问题是不能正确修饰或折叠,容易产生包涵体,导致表达的蛋白缺乏活性。但如果能够充分利用,大肠杆菌表达的蛋白可以解决90%以上的问题。目前,大肠杆菌对于异源蛋白的高级修饰(如糖基化、磷酸化等)还无法实现,但对于二硫键的形成和蛋白质的折叠问题,已经有了非常好的解决方案。
本文主要介绍适用于二硫键/分泌表达的大肠杆菌工程菌株。
许多活性蛋白的结构中都含有二硫键,二硫键的形成需要适当的环境和相关酶的参与。野生型大肠杆菌细胞质的环境是强还原性的,我们可以通过信号肽将其导入到细胞周质中,或者通过改变细胞质中的溶液环境和利用二硫键氧化酶来满足二硫键形成所需的氧化条件。
二硫键/分泌表达常用工程菌
Origami系列
Origami系列是由Novagen公司(现为EMD Millipore的一部分)开发的,用于在细胞质中表达和正确折叠含有二硫键的蛋白质。该系列是在野生大肠杆菌K12基础上,对trxB和gor基因进行突变,减少了细胞质中的还原性环境,从而完全改变了其生理功能,使得菌株无法存活。为了弥补这一缺陷,研究人员对ahpC基因进行了突变,提供了一种替代途径来维持细胞内的氧化还原平衡。
trxB基因编码硫氧还蛋白还原酶(thioredoxin reductase),它参与维持细胞内硫氧还蛋白(thioredoxin)的还原状态。抑制trxB基因的表达,使得细胞内的硫氧还蛋白不能被还原,增加了氧化环境,从而有利于二硫键的形成。
gor基因编码谷氧还蛋白还原酶(glutathione reductase),抑制它会导致细胞质中的谷胱甘肽无法被还原,增加了氧化环境,从而有利于二硫键的形成。
ahpC基因编码过氧化物酶组分,称为AhpC。AhpC与AhpF形成过氧化物酶系统,该系统能分解过氧化氢为水和氧气,从而保护细胞免受氧化应激造成的损伤。AhpC具有过氧化氢酶活性,而AhpF则作为电子供体。
ahpC基因被用作抑制子来克服trxB和gor基因突变带来的还原途径受阻的致死性。突变的ahpC基因可以产生一个突变形式的AhpC(称为AhpC*),它能够还原Grx1(一种还原型谷胱甘肽依赖的氧化还原酶),从而恢复细胞内的还原能力,提供了一种替代途径来维持必需的还原环境。
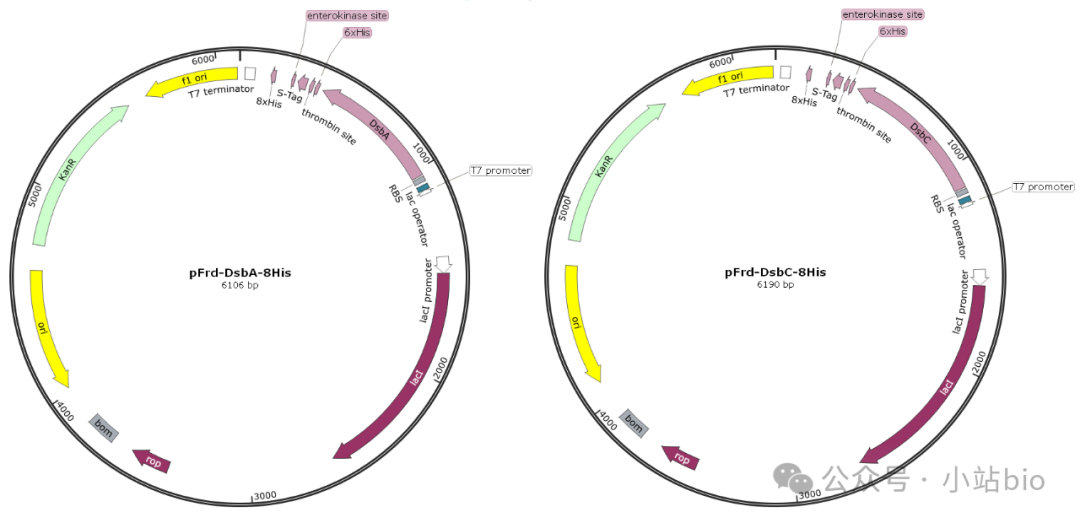
使用这些菌株时,最好融合一个具有二硫键氧化活性的酶,如DsbC基因,它既可以作为二硫键氧化酶,也可以作为分子伴侣使用。
这个系列衍生出许多变种,如Origami B、Origami 2、Origami B(DE3)、Origami 2(DE3)、Origami 2(DE3)pLysS、Rosetta-gami B、Rosetta-gami B(DE3)、Rosetta-gami B(DE3)pLacI、Rosetta-gami B(DE3)pLysS等。
Origami系列菌株配合DsbA、DsbC等融合蛋白使用,二硫键形成和蛋白折叠效果更好。
SHuffle菌株
SHuffle E. coli 菌株在上述菌株的优势基础上,染色体中整合了一个拷贝的二硫键异构酶DsbC基因,该基因蛋白不仅可以促进含有二硫键蛋白的正确折叠,还可以作为分子伴侣。该菌株可以严格控制背景渗漏表达,适合于毒性基因的原核表达。
该菌株与pET系列、pGEX系列、pMAL系列等质粒载体兼容。
上述基因工程改造的菌株在二硫键和蛋白质折叠方面做出了巨大贡献,但改造的菌株仍存在许多缺陷,如生长缓慢或生命力脆弱。特别是衍生菌株通常采用抗生素加压临时携带外源质粒来实现功能,这给菌体的生长带来了很大压力。
酵母二硫键异构酶Erv1p共表达系统
科学家们也在不断研究,发现许多细胞器膜内还有二硫键氧化酶Ero1,酿酒酵母线粒体内膜的Erv1p蛋白,但它们都需要依赖其他蛋白的辅助才能发挥作用,Ero1依赖PDI,Erv1p依赖Mia40。
世间事情总有例外:如果环境不够,酶可以来补充。如果在野生型大肠杆菌菌株细胞质的氧化环境中,能否完成二硫键的氧化呢?总有一些特殊情况。
芬兰奥卢大学(University of Oulu)的生物化学系Feras Hatahet通过在大肠杆菌中引入Erv1p(一种在线粒体膜间隙中发现的硫醇氧化酶和FAD依赖的二硫键形成催化剂),在不破坏还原途径的情况下促进细胞质中异源蛋白的二硫键形成。在含有完整还原途径的大肠杆菌BL21 (DE3) pLysSRARE菌株中,通过与Erv1p共表达,得到的活性二硫键蛋白质产量高于商业的Δgor ΔtrxB菌株Rosetta-gami。研究使用了碱性磷酸酶(PhoA)和植酸酶(AppA)作为模型蛋白来测试这一系统,通过共表达Erv1p和可能需要的二硫键异构酶(DsbC),在野生型大肠杆菌背景中实现了有效产量的活性蛋白。
以下为DsbC和Erv1p两个伴侣蛋白的核酸序列,仅供参考使用:
|
>DsbC TTTACCGCTGGTCATTTTTTGGTGTTCGTCGAGAAATTCTTTCATCTCTTTCGGCGGCTGGTAACCCGGAACAAGTGTGCCATTGCTCAGCACAACTGCCGGAGTACCGCTAACGCCAAGCTGGACGCCAAGTGCGTAATGGTCGGCAATATCCACGTCGCAACTGGCTGGTGCGACGCTTTTACCTGCCATCACATCATCAAACGCTTTGTTTTTATCTTTCGCACACCAGATAGCTTTCATTTCTTTCTCTGCATCGCTGTCCAGCCCCTGGCGCGGGAAAGCAAGATAACGCACGGTGATCCCCAGCGCGTTGTAGTCTGCCATTTGCTCATGCAGTTTGTGGCAGTAACCACAGGTAATATCAGTAAACACGGTGATGACGTGTTTTTCCTGCGGCGCTTTATAAACGATCATCTCTTTTTCAAGCGCATTCAACTGCTTTAACAGCATCTTATTGGTGACATTGACCGGAGCCGTGCCACTAACGTCATACATTGGCCCCTGAATGATATGTTTACCATCATCGGTGATGTACAACACGCCGCTGTTAGTCAGAACTGTCTTCATGCCAGCTACAGGCGCGGGCTGAATATCGCTGCTTTTGATGCCCATTTTGGCTAACGTTTGTTGAATTGCCGCGTCATCAGCCTGAGCAAAGCCTGAAAACGCCGCTAACAAAGTAAACAACATAAAACCTTTCTTCAT --------------------------------------------- >Erv1p ATGCCTGGCTCAAGAACATACAGGAAGGTTGACCCTCCTGACGTAGAGCAACTAGGTAGATCTTCATGGACGCTGTTACACTCTGTAGCTGCCAGCTATCCTGCTCAACCTACAGACCAACAGAAGGGTGAAATGAAACAGTTCTTGAATATCTTCTCACATATTTATCCTTGCAACTGGTGTGCTAAAGACTTTGAAAAATATATCAGAGAAAATGCACCACAAGTTGAGTCAAGAGAAGAACTTGGGAGGTGGATGTGTGAAGCCCACAATAAAGTCAATAAGAAATTGAGGAAGCCCAAATTTGACTGTAATTTCTGGGAAAAAAGATGGAAGGACGGCTGGGACGAATAA |
静息巯基氧化酶QSOX1共表达系统
静息巯基氧化酶(Quiescin sulfhydryl oxidase, QSOX)是一类能够催化蛋白质巯基(-SH)氧化形成二硫键(-S-S-)的酶,对于促进蛋白质的正确折叠和功能发挥至关重要。
在2012年,Abskharon等人发表了关于静息巯基氧化酶(QSOX)和朊病毒蛋白(PrP)在大肠杆菌中表达的研究。他们展示了通过共表达两种不同的PrP与人类QSOX,这种具有硫醇/二硫键氧化酶活性的人类分子伴侣,可以在大肠杆菌的细胞质中产生可溶性的重组PrP。这一成果不仅证实了在细菌中可以轻松表达出结构正确的PrP,而且使用这种方法产生的可溶性重组PrP可以用于功能性和结构性研究。
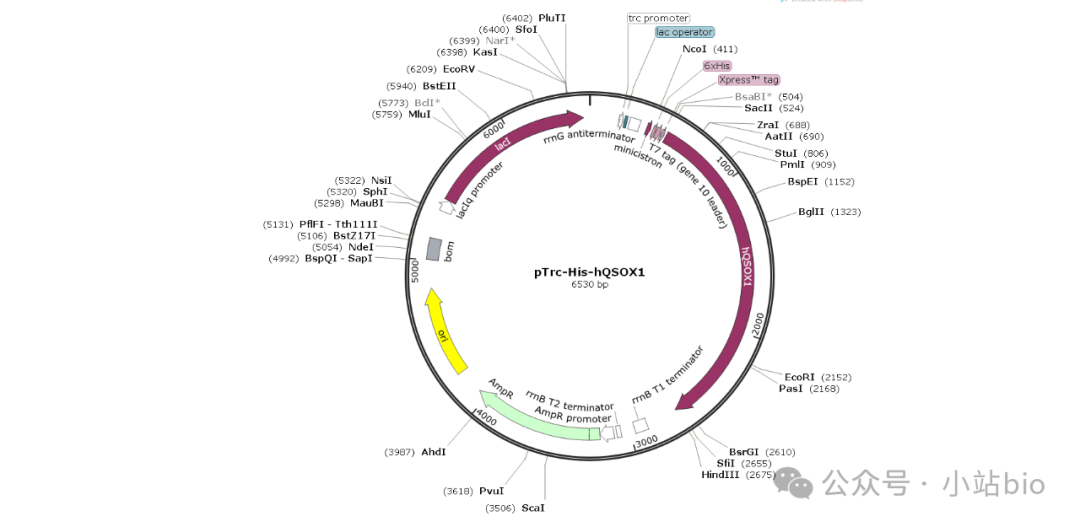
Abskharon文中所用的表达hQSOX1的质粒(抗性为Amp+),结构图如下,靶蛋白可以选用pET-28a等Kan+抗性载体进行构建表达。





















 569
569

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








