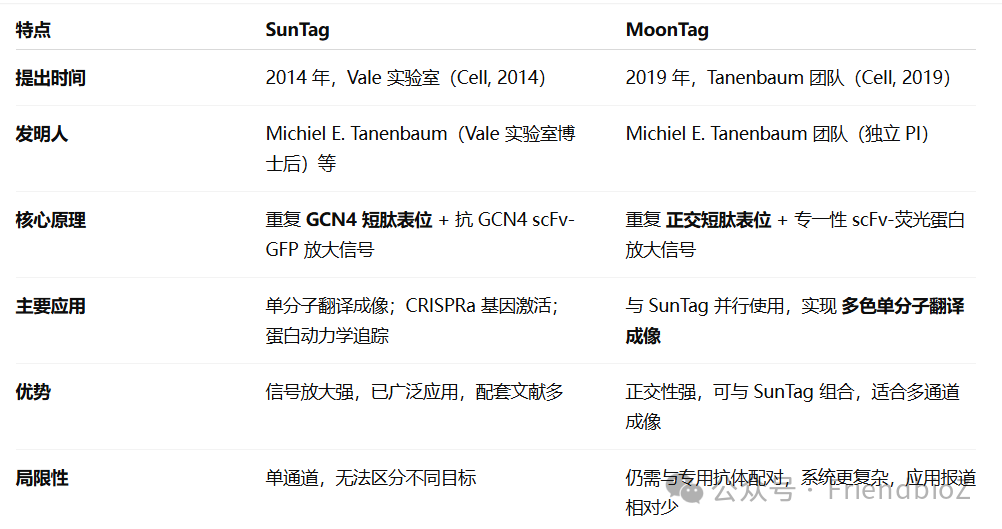
在细胞内追踪蛋白翻译与定位,是现代分子生物学和细胞生物学的重要研究方向。2014 年,Vale 实验室首次提出了SunTag系统:通过在目标蛋白上串联重复的 GCN4 短肽表位,并利用高亲和力的 anti-GCN4 单链抗体(scFv)结合荧光蛋白,实现了信号的指数级放大,从而使单分子翻译的实时成像成为可能。SunTag 的出现极大推动了分子成像的发展,但它仍存在一定局限——只能提供单通道信号,难以同时追踪多个事件。
为解决这一问题,Tanenbaum 团队在 2019 年Cell 期刊上提出了 MoonTag 系统。MoonTag 的设计理念与 SunTag 相同,都是利用“重复短肽表位–特异抗体”的组合来实现信号放大。但MoonTag 采用了一段全新的 短肽表位序列:VDEMTKKFGTLTLE
这一表位源自 HPV16 E2 蛋白的片段,研究团队筛选出与其高亲和结合的 anti-MoonTag scFv,并将其与荧光蛋白融合,从而构建出完整的 MoonTag 系统。与 SunTag 的 anti-GCN4 scFv 不同,anti-MoonTag scFv 与 SunTag 无交叉反应,具备严格的正交性。
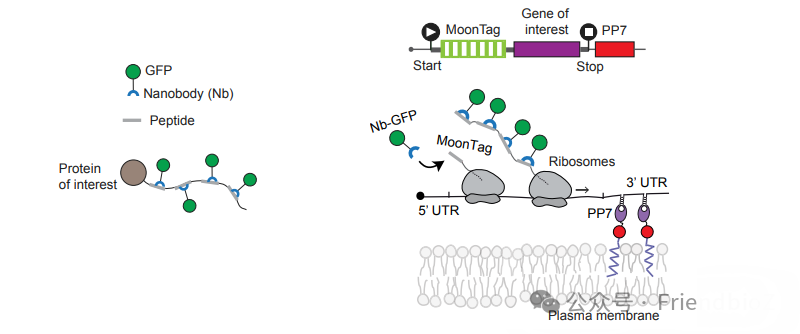
MoonTag 的发明人是 Michiel E. Tanenbaum及其团队。他们在 SunTag 的基础上进一步开发了这套正交标签,核心目的是在单个细胞中实现 多通道成像。通过将 SunTag 与 MoonTag 并行使用,研究者能够同时追踪两类不同的蛋白或 mRNA 翻译事件,互不干扰。这一突破解决了单色标签无法区分不同分子过程的难题。
MoonTag 的应用领域主要集中在单分子翻译动力学研究和多色成像实验。例如,在 2019 年的研究中,作者利用 SunTag 与 MoonTag 双标签系统,首次在同一细胞内同时观测两种 mRNA 的翻译过程,揭示了不同转录本在翻译速率和效率上的巨大差异。这一应用不仅展示了 MoonTag 的技术潜力,也为理解细胞内翻译调控的异质性提供了新的工具。
与 SunTag 相比,MoonTag 的优势在于其 正交性:两者可以搭配使用,适合多色成像和复杂的实验设计。而 SunTag 本身在信号强度和文献积累方面更为成熟,应用也更广泛。两者结合,就像“太阳”和“月亮”一样,相互辉映,为活细胞成像提供了更丰富的选择。
SunTag vs MoonTag 对比
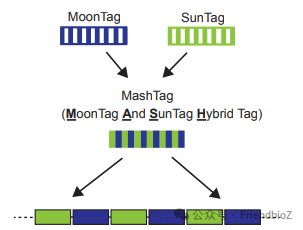
MoonTag和 SunTag都是Michiel E. Tanenbaum发明的,都属于私人定制的自嗨Tag,将两个Tag联合在一起使用就变成了Mash tag,其主要用途是细胞内单分子成像。
我们目前所用的标签,不管是用于纯化、分子示踪,还是检测,大部分标签是“半人造”的,完全取之于天然的很少。连续三篇介绍了MAP tag,Sun tag,Moon tag,这些都属于个性化制造的标签,我们在实验生产中,也可以根据自身实际需求设计出自己的“私人制造Tag”
参考文献
- Tanenbaum ME, Gilbert LA, Qi LS, Weissman JS, Vale RD. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 2014;159(3):635–646. doi:10.1016/j.cell.2014.09.039
- Boersma S, Khuperkar D, Verhagen BMP, Sonneveld S, Grimm JB, Lavis LD, Tanenbaum ME. Multi-Color Single-Molecule Imaging Uncovers Extensive Heterogeneity in mRNA Decoding. Cell. 2019;178(2):458–472.e19. doi:10.1016/j.cell.2019.05.001




















 24万+
24万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








