本文内容速览:
在分子生物学领域相关的研究中,我们经常会讨论某个蛋白丰度高低的变化,借此来解释各种生物学调控机制。当我们想进一步解析和完善调控机制时,就需要考虑蛋白丰度变化的因素,通常会考虑两个方面,一是蛋白翻译是否增强/减弱,二是蛋白降解是否增多/减少。总的来说,蛋白翻译过程受到转录和翻译两个层面的影响,这些在往期推文中已经有了不少介绍(包括转录和翻译不线性相关的问题)。当我们提及蛋白降解过程,大家是否首先想到的是泛素降解系统?虽然泛素降解系统是蛋白降解中占比最高的一个方式(Deng and Wang, 2011),但并不是所有蛋白降解都通过泛素化途径,虽然小远在“如何研究蛋白的自噬降解?”中也有介绍另外一种蛋白降解的方式——自噬,但这些并不是蛋白降解的全部途径。
根据蛋白降解方式和降解发生的位置差异,可以将植物中的蛋白降解分为五大类,分别是:泛素-26S蛋白酶体系统、自噬系统、细胞器降解系统、液泡蛋白酶降解系统、非泛素依赖降解系统。为了进一步了解蛋白降解事件,小远将从不同的蛋白降解方式出发,介绍这些方式间的区别及联系。最后,小远将分享可控蛋白质降解技术的有关内容。
01
不同的蛋白降解系统
泛素-26S蛋白酶体系统
泛素-26S蛋白酶体系统(Ubiquitin Proteasome System,UPS)是一种依赖泛素标记的选择性蛋白质降解与信号调控机制,其分子本质是通过E1、E2、E3等级联酶将泛素共价连接至特定蛋白,从而使这些被标记的蛋白进入26S蛋白酶体进行降解(图1)。在植物中,26S蛋白酶体基本保留了高度保守的结构,其主要结构成分可分为两大子复合体:核心粒(20S)和调控粒(19S)(Kim et al., 2011)。
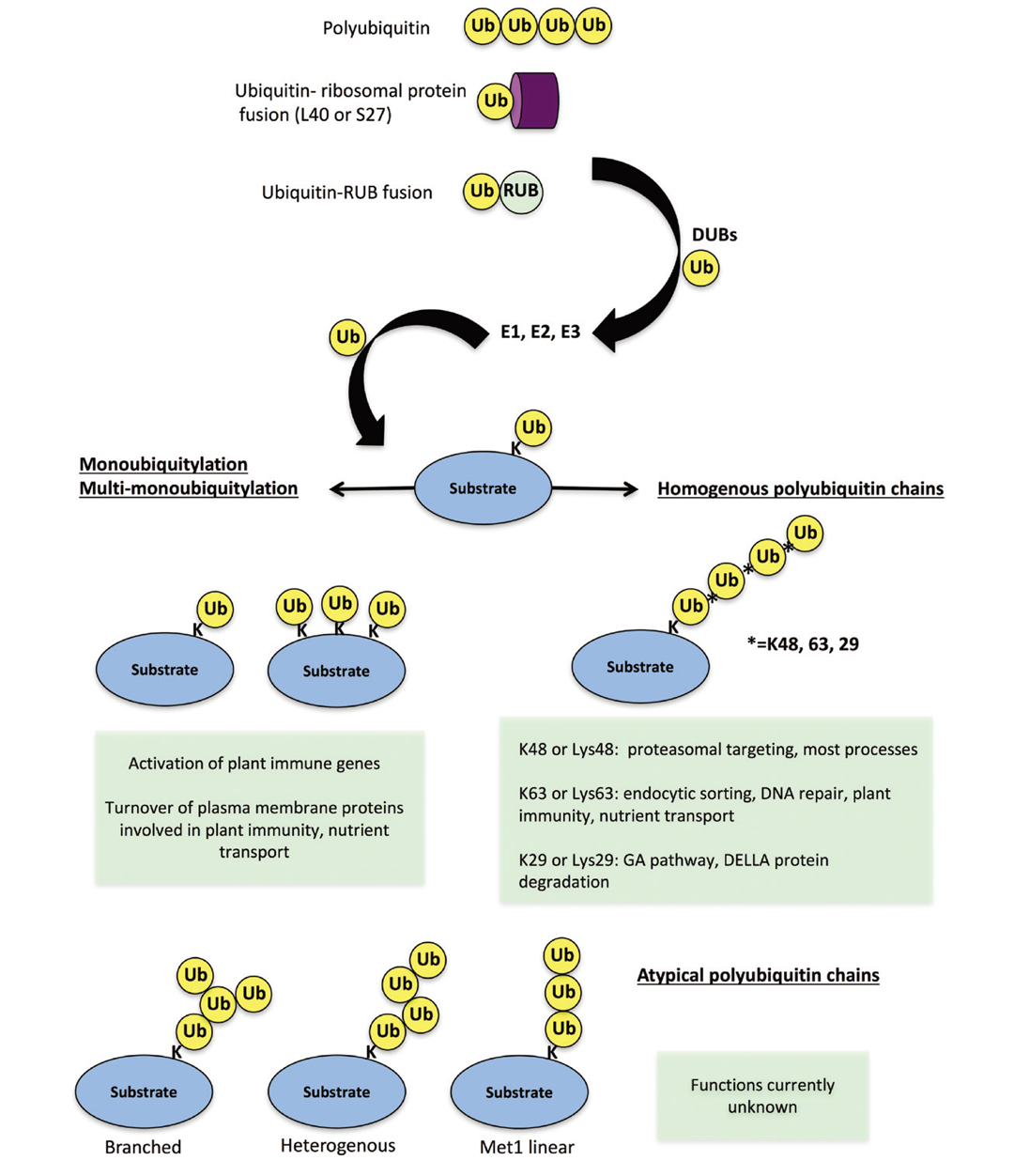
图1 植物的泛素化过程(Miricescu et al., 2018)。编码融合蛋白的泛素基因经去泛素化酶加工后产生游离泛素(Ub)。泛素随后可通过E1、E2和E3酶的作用与底物结合。结合的泛素可能以多种不同的方式进一步泛素化,从而导致不同的底物命运。
需要注意的是,并不是所有被泛素化标记的蛋白都能进入26S蛋白酶体进行降解,因为这与泛素化的类型相关。泛素化可分为三大类:单泛素化、多单泛素化、多聚泛素化,其中多聚泛素化根据泛素分子间连接的氨基酸残基的不同分为多种链型,主要包括K6、K11、K27、K29、K33、K48、K63以及N端甲硫氨酸(M1)连接等类型。植物中K48连接类型的多聚泛素化可介导蛋白通过26S蛋白酶体系统降解。此外,泛素链之间还可通过不同赖氨酸位点交叉连接形成混合链或支链结构,从而整合不同信号,实现对底物的精细调控(Zeng and Zhou., 2017)。虽然已知的泛素化类型有多种,但是植物中已有相关报道的只有一部分,以下表格中小远整理了已经报道的泛素化类型及其作用(表1)。
表1 植物中的泛素化类型。

泛素化不仅是蛋白质更新与清除的关键途径,更通过动态调节蛋白的丰度、活性和相互作用,在植物的信号感知、信号传递、反馈调控及胁迫适应过程中发挥重要作用(Miricescu et al., 2018)。有关泛素化的相关介绍及研究思路可浏览往期推文“蛋白翻译后修饰——泛素化”、“蛋白翻译后修饰——泛素化(二)”和“蛋白翻译后修饰——去泛素化”。
自噬系统
自噬(Autophagy)是细胞在进化过程中形成的一种自我降解与再循环机制,能够将完整的细胞器、蛋白质聚集体甚至入侵的微生物送入液泡进行降解,并将分解产物重新用于细胞代谢,从而维持细胞稳态。自噬共分为三种类型,分别是巨自噬、微自噬、分子伴侣介导的自噬,目前植物中的自噬主要是巨自噬和微自噬(图2)。更多有关自噬的内容可浏览往期推文“如何研究蛋白的自噬降解?”。
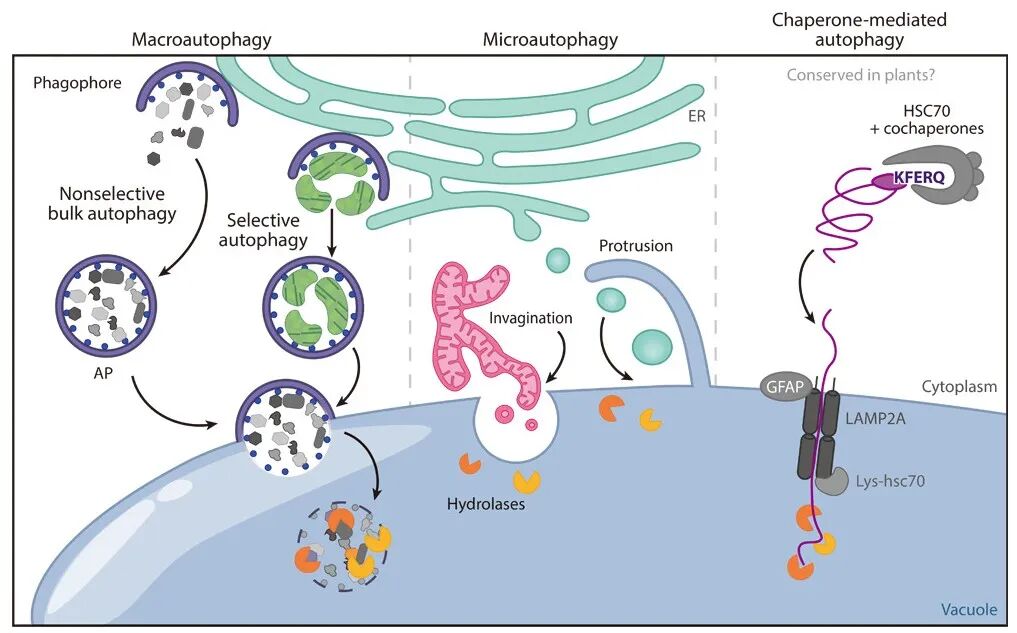
图2 三种类型自噬的过程(Gross et al., 2025)。在巨自噬过程中,自噬货物被新生的吞噬泡包裹,吞噬泡扩张并发育成双层膜囊泡。双层膜囊泡随后与液泡融合,其内容物被液泡内的水解酶(橙色)降解。该过程可以是无选择性的,也可以是选择性的。在微自噬过程中,货物被液泡内陷或外凸直接包裹。在分子伴侣介导的自噬过程中(目前仅在哺乳动物中观察到),含有KFERQ样基序的胞质蛋白被分子伴侣蛋白HSC70识别,并在与LAMP2A结合后展开,从而被递送至溶酶体进行降解。
自噬与泛素-26S蛋白酶体介导的蛋白降解作为植物中蛋白降解的两大类型,在保证植物正常的生长发育过程中都发挥着重要作用。但是两者的作用对象有着明显的区别,自噬在营养缺乏或逆境胁迫下被显著激活,主要清除体积较大的底物,而泛素–26S蛋白酶体系统则主要负责快速、精准地降解短寿命或错误折叠的可溶性蛋白(Sharma et al., 2024)。尽管两者在降解机制上有所区别,但是它们在有些降解事件中也可以相互辅助、协调,以应对复杂的生长发育环境。这两种降解系统的配合尤其常发生在选择性自噬过程中,有关不同类型降解方式之间的crosstalk将在后面单独给大家介绍。
细胞器降解系统
泛素-26S蛋白酶体系统可以介导细胞质和细胞核中蛋白的降解,自噬系统可以介导蛋白及细胞器等结构的降解。那么细胞器中蛋白的降解又是通过什么方式呢?是否也依赖于泛素-26S蛋白酶体系统?实际上,像叶绿体、线粒体这些细胞器内部的蛋白降解是通过自身的蛋白酶来介导,并不是由泛素-26S蛋白酶体系统来介导。部分细胞器内的蛋白质在受到泛素-26S蛋白酶体系统介导降解之前,必须先从细胞器中转运至细胞质中。此外,定位于细胞器膜上的蛋白质也可能通过泛素化途径被识别并降解(Ling et al., 2019; Pan et al., 2014; Sun et al., 2022)。
2021年1月,浙江大学刘建祥课题组在Molecular Plant杂志上发表了一篇题为“Protein quality control in plant organelles: current progress and future perspectives”的综述文章,该文章系统总结了植物细胞叶绿体和线粒体中蛋白质量控制的分子机制,对叶绿体和线粒体内的蛋白酶介导的蛋白降解进行了描述。文中提到,在植物细胞中,叶绿体和线粒体均具备独立的蛋白酶系统来清除受损或错误折叠的蛋白、维持细胞器稳态:在叶绿体内,Clp复合体负责降解基质中错误折叠或未正确组装的蛋白,FtsH蛋白酶(如FtsH1/2/5/8)位于类囊体膜上参与光系统II受损蛋白(如D1)的去除(图3A);在线粒体中,AAA+家族的FtsH4蛋白酶可选择性降解因氧化压力等受损的内膜蛋白及蛋白转运系统组分(图3B)。

图3 叶绿体和线粒体中的蛋白质稳态调节(Sun et al., 2021)。(A)叶绿体的稳态调节;(B)线粒体的稳态调节。
液泡蛋白酶降解系统
液泡是植物细胞内体积最大、功能最复杂的细胞器,在维持细胞生理稳态、调控生长发育与环境适应中发挥着重要作用。液泡最主要的功能之一是通过多种水解酶参与蛋白的降解,这与动物细胞中的溶酶体类似。由于液泡在蛋白降解过程中的重要地位,所以没有将其纳入上一小节的内容中,这里单独给大家分享有关液泡介导的降解的内容。
总的来说,液泡介导的降解有三种方式,分别是自噬介导的液泡降解、内体/多泡体途径介导的液泡降解、液泡破裂介导的细胞程序性死亡。由于前两种方式分别与自噬系统和泛素–26S蛋白酶体系统相关,因此这里先不作详细介绍,会在后面单独给大家分享。在细胞程序性死亡过程中,液泡的崩溃是细胞器和最终质膜分解的必要条件。目前认为细胞质游离钙离子、活性氧和MAPK激酶的增加可以激活细胞程序性死亡的级联信号,导致细胞器结构和通透性的变化,最终导致细胞死亡(Bosch et al., 2024)。
2015年4月,京都大学Ikuko Hara-Nishimura课题组在Frontiers in Plant Science杂志上发表了一篇题为“Vacuolar processing enzyme in plant programmed cell death”的综述文章,作者指出液泡加工酶(Vacuolar processing enzyme,VPE)是植物特有的半胱氨酸蛋白酶,具有类似Caspase-1(介导动物细胞程序性死亡的半胱氨酸蛋白酶)的活性,被视为植物细胞程序性死亡中的关键执行者:在逆境或病原诱导等信号作用下,VPE在液泡内激活水解酶并促使液泡膜破裂,液泡内水解酶等物质随之释放到胞质,快速引发细胞结构的全面降解,从而完成典型的液泡介导型细胞程序性死亡(图4)。

图4 VPE在植物多种胁迫响应下促进程序性细胞死亡(Hatsugai et al., 2015)。
非泛素依赖降解系统
前述几类蛋白质降解系统的降解过程都在特定结构内进行,与细胞质相互隔离。那么,是否存在能够在细胞质中直接介导蛋白降解的蛋白酶呢?实际上是没有的,由于蛋白质降解本身具有潜在的破坏性,细胞必须对其在空间和时间上加以严格控制,以防止误伤正常蛋白(Baumeister et al., 1998)。值得注意的是,除了依赖于泛素分子标记的蛋白酶体降解途径之外,还有一种蛋白酶体降解途径——非泛素依赖的20S蛋白酶体降解系统。该系统不需要泛素分子的标记,可以通过20S蛋白酶体直接降解目标蛋白。
2020年7月,德州农工大学张秀任课题组联合浙江大学王智烨课题组在Nature Plants杂志上发表了一篇题为“Degradation of SERRATE via ubiquitin-independent 20S proteasome to survey RNA metabolism”的研究论文,该研究发现植物中20S核心蛋白酶体亚基PAG1与关键RNA代谢因子SERRATE(SE)直接结合,并直接使未形成功能蛋白复合体的无序SERRATE蛋白降解(图5)。这一降解途径不同于典型的泛素-26S蛋白酶体系统,揭示了通过20S核心酶体动态调控RNA代谢关键因子稳态的新机制。
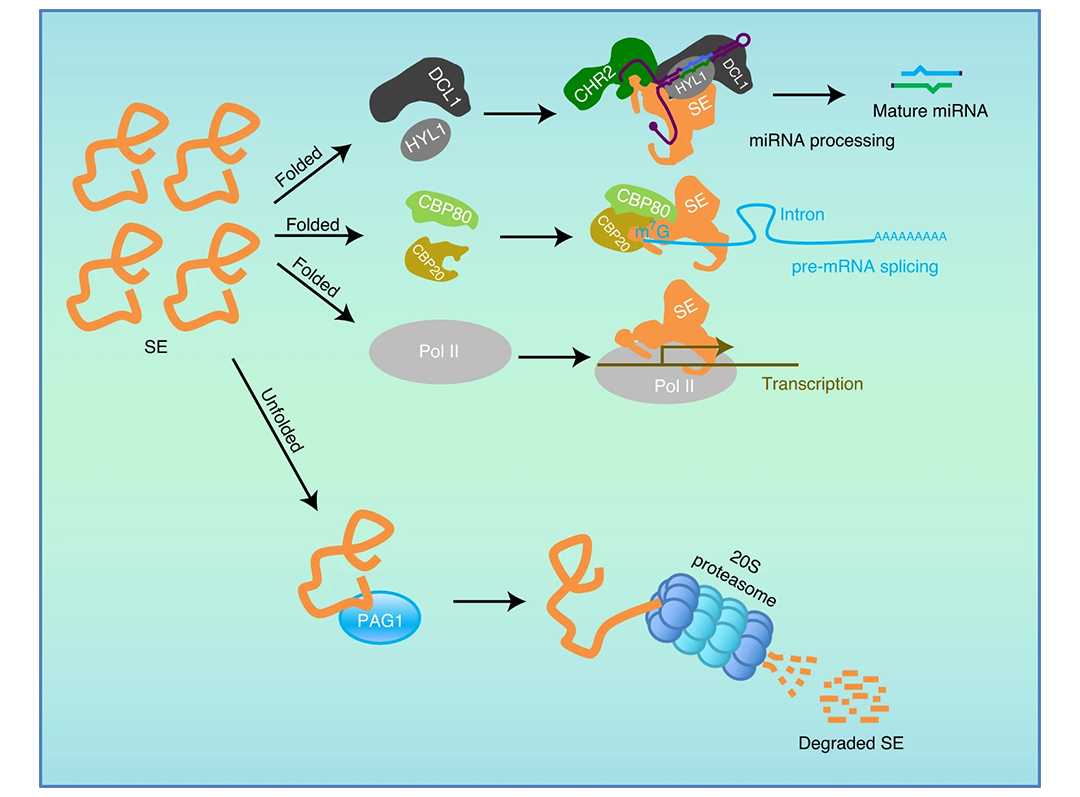
图5 PAG1介导降解RNA代谢因子SERRATE模式图(Li et al., 2020)。
02
不同降解系统间的crosstalk
泛素—26S蛋白酶体系统与自噬系统
尽管各种蛋白质降解系统的作用位点、底物类型及执行机制存在差异,但其根本目标均在于维持细胞生命活动的稳态。为了实现更精准、更高效的蛋白质质量控制,不同降解系统之间形成了复杂且动态的crosstalk网络,通过相互补偿、协同调控与信号耦联等方式,共同保障细胞内蛋白质稳态与生理功能的正常运行。
2022年7月,俄亥俄大学华志华课题组在The Plant Journal杂志上发表了一篇题为“The ubiquitin–26S proteasome system and autophagy relay proteome homeostasis regulation during silique development”的研究论文,该研究发现在拟南芥角果发育早期阶段,泛素-26S蛋白酶体系统与自噬系统表现出“接力”作用:当UPS活性下降时自噬增强,整体蛋白组稳态得以维持,表明两大降解通路互为补偿、协同维持蛋白稳态(图6)。
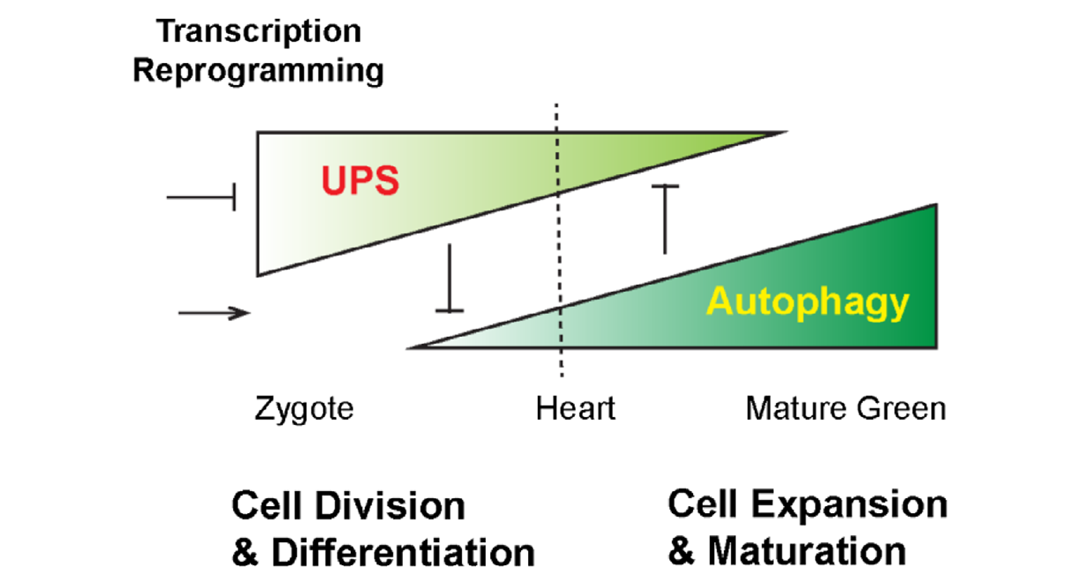
图6 角果/种子发育过程中UPS和自噬“接力”工作模型(Yu et al., 2022)。
Baena等人在“Genetic and Pharmacological Inhibition of Autophagy Increases the Monoubiquitination of Non-Photosynthetic Phosphoenolpyruvate Carboxylase”一文中指出,拟南芥NBR1可以识别单泛素化的磷酸烯醇式丙酮酸羧化酶以介导其自噬降解,这体现了泛素化与自噬之间的联系。2024年8月,华南农业大学王浩课题组在Autophagy杂志上发表了一篇题为“Dual roles of AtNBR1 in regulating selective autophagy via liquid-liquid phase separation and recognition of non-ubiquitinated substrates in Arabidopsis”的研究论文,该研究发现AtNBR1在植物选择性自噬中的双重角色:不仅可以通过识别泛素化底物促进自噬,也可通过液-液相分离识别未泛素化底物并促进自噬(图7)。这意味着泛素化标记与自噬作用之间并非简单线性通路,而是自噬系统中还存在泛素独立的识别机制,从而使自噬系统与泛素–26S蛋白酶体系统交互更为复杂。
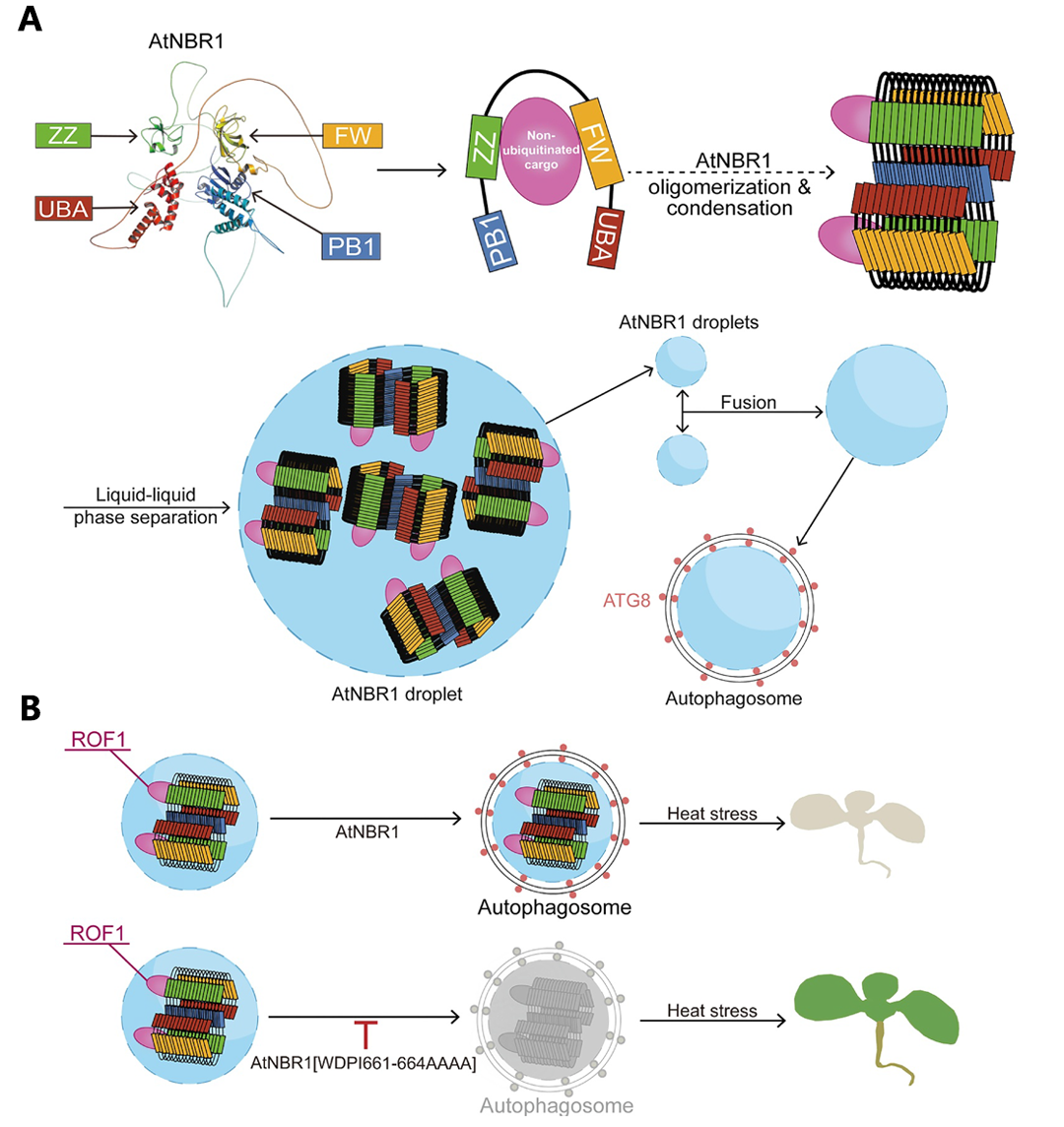
图7 AtNBR1通过液-液相分离识别未泛素化底物的分子作用机制(Yan et al., 2024)。(A) 非泛素化的货物蛋白可被AtNBR1的ZZ和FW结构域特异性识别。此外,AtNBR1表现出寡聚化和凝聚,最终导致液-液相分离并形成无膜AtNBR1液滴。在被ATG8识别后,它们被隔离到吞噬泡中,吞噬泡随后成熟为双层膜自噬体,进行后续降解;(B) ROF1与AtNBR1和AtNBR1[WDPI661-664AAAA]的相互作用和命运示意图。AtNBR1[WDPI661-664AAAA]变体停留在液-液相分离阶段。
泛素-26S蛋白酶体系统与液泡蛋白酶降解系统
2025年3月,威斯康星大学麦迪逊分校Marisa S Otegui课题组在Journal of Biological Chemistry杂志上发表了一篇题为“The green ESCRTs: Newly defined roles for ESCRT proteins in plants”的研究论文,该研究发现植物中ESCRT蛋白可以识别质膜上的泛素化底物,并促进内体的形成和向液泡的运输,最终泛素化底物在液泡中被降解(图8)。该途径即液泡蛋白酶降解系统中的内体/多泡体途径介导的液泡降解。
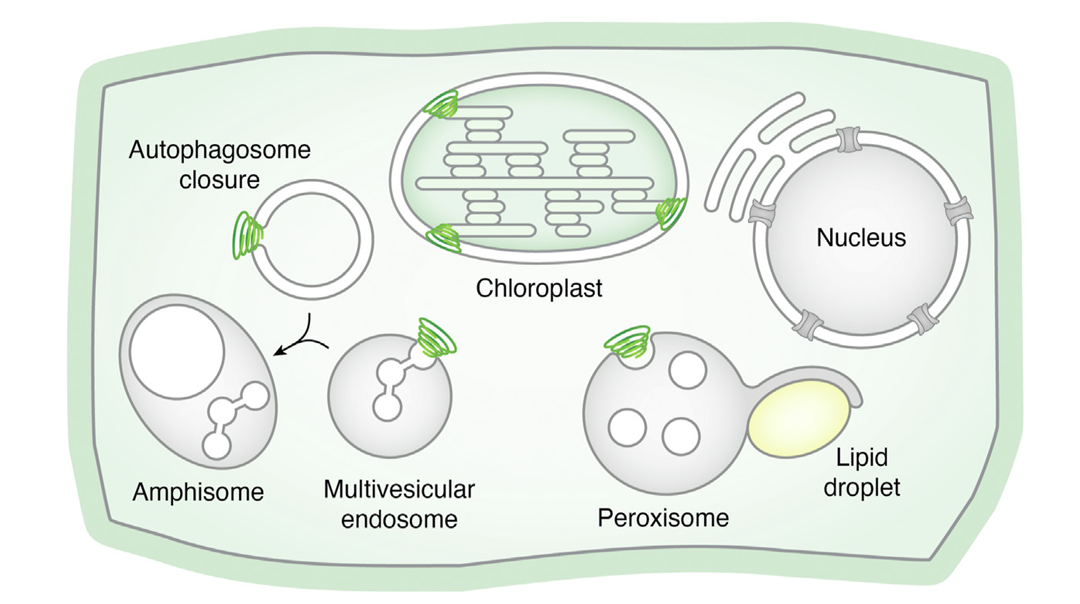
图8 ESCRT在内体/多泡体路径介导的液泡降解中发挥作用(Weiner et al., 2025)。
从以上案例中我们可以看出,泛素-26S蛋白酶体系统与自噬系统、液泡蛋白酶降解系统间都存在着降解事件的crosstalk。有关自噬介导的液泡降解的相关内容可以回顾往期推文“如何研究蛋白的自噬降解?”这里给大家列举的文献案例有限,还有其他有关不同降解系统间crosstalk的相关文章大家可以自行探索阅读哦!
03
可控的蛋白降解技术
在DNA与RNA水平,我们已经具备CRISPR基因编辑、RNAi等成熟手段,实现对基因表达的精准调控。那么进一步向下游延伸,在蛋白水平上能否同样实现人为、可控的调节?靶向蛋白降解技术(Targeted Protein Degradation,TPD)技术通过直接降解目标蛋白可以实现这一目标。该技术尤其适用于致死基因或早期发育关键蛋白的功能解析,在动物中已经有相关研究和应用,目前在植物中的相关研究还不是很多。
2025年4月,北卡罗莱纳州立大学Marcela Rojas-Pierce课题组在Biochemical Society Transactions杂志上发表了一篇题为“Manipulation of targeted protein degradation in plant biology”的综述论文,该论文总结了植物中蛋白靶向降解的四种系统,分别是(1)基于Cullin-RING E3连接酶复合体的策略,如融合F-box 或纳米抗体标签的deGradFP系统(图9A);(2)引入微生物来源的E3体系实现工程化识别(图9B);(3)利用N端规则暴露N端的不稳定残基触发降解(图9C);(4)发展化学诱导型降解剂(图9D),如PROTAC,虽在植物中仍处探索阶段,但应用潜力突出。总的来说,这几种TPD技术都依赖泛素标记使目标蛋白通过蛋白酶体或者液泡降解。这里小远就抛砖引玉,初步介绍TPD技术的几种系统,更多该技术的细节大家可以自行查阅相关文献。
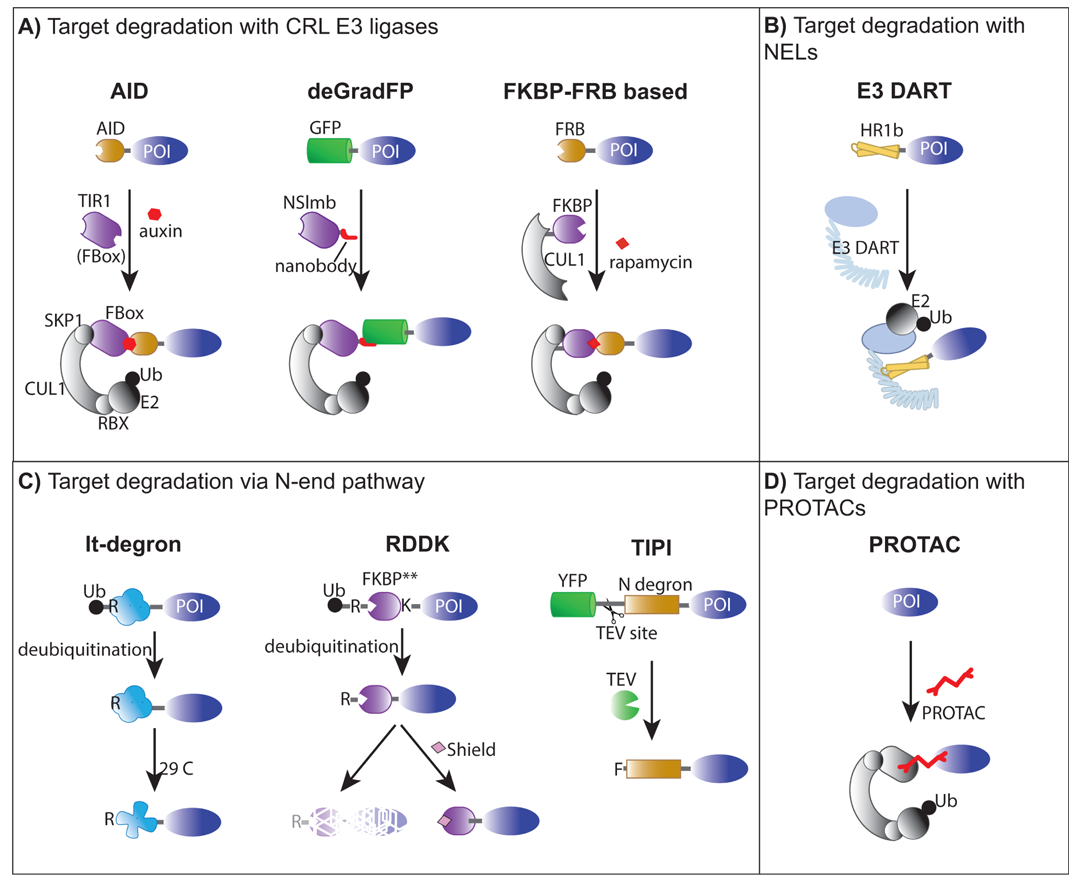
图9 四种类型的靶向蛋白质降解技术(Marcela Rojas-Pierce and Sebastian Y Bednarek, 2025)。
本期推文中,小远给大家介绍了植物细胞中蛋白降解的不同系统,各系统间有所区别但又相互联系。所有系统联合后像是个大的“垃圾回收站”,共同处理不同情况下、不同来源的“垃圾”,以维持植物正常的生命活动。蛋白降解领域还在不断发展,新的问题不断出现,以后可能还会出现不同于本篇推文中介绍的降解系统。Eckardt等人在“The lowdown on breakdown: Open questions in plant proteolysis”一文中总结了蛋白降解领域亟需解决的问题,感兴趣的读者可以去阅读一下喔!
References:
Baena G, Feria A B, Hernández-Huertas L, et al. Genetic and pharmacological inhibition of autophagy increases the monoubiquitination of non-photosynthetic phospho enol pyruvate carboxylase[J]. Plants, 2020, 10(1): 12.
Baumeister W, Walz J, Zühl F, et al. The proteasome: paradigm of a self-compartmentalizing protease[J]. Cell, 1998, 92(3): 367-380.
Bosch M, Franklin-Tong V. Regulating programmed cell death in plant cells: Intracellular acidification plays a pivotal role together with calcium signaling[J]. The Plant Cell, 2024, 36(11): 4692-4702.
Eckardt N A, Avin-Wittenberg T, Bassham D C, et al. The lowdown on breakdown: Open questions in plant proteolysis[J]. The Plant Cell, 2024, 36(9): 2931-2975.
Gross A S, Raffeiner M, Zeng Y, et al. Autophagy in plant health and disease[J]. Annual Review of Plant Biology, 2025, 76.
Hatsugai N, Yamada K, Goto-Yamada S, et al. Vacuolar processing enzyme in plant programmed cell death[J]. Frontiers in plant science, 2015, 6: 234.
Kim H M, Yu Y, Cheng Y. Structure characterization of the 26S proteasome[J]. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 2011, 1809(2): 67-79.
Kurepa J, Wang S, Li Y, et al. Proteasome regulation, plant growth and stress tolerance[J]. Plant signaling & behavior, 2009, 4(10): 924-927.
Li Y, Sun D, Ma Z, et al. Degradation of SERRATE via ubiquitin-independent 20S proteasome to survey RNA metabolism[J]. Nature plants, 2020, 6(8): 970-982.
Ling Q, Broad W, Trösch R, et al. Ubiquitin-dependent chloroplast-associated protein degradation in plants[J]. Science, 2019, 363(6429): eaav4467.
Liu Y, Xie Y, Xu D, et al. Inactivation of GH3. 5 by COP1-mediated K63-linked ubiquitination promotes seedling hypocotyl elongation[J]. Nature Communications, 2025, 16(1): 3541.
Miricescu A, Goslin K, Graciet E. Ubiquitylation in plants: signaling hub for the integration of environmental signals[J]. Journal of Experimental Botany, 2018, 69(19): 4511-4527.
Pan R, Kaur N, Hu J. The A rabidopsis mitochondrial membrane‐bound ubiquitin protease UBP 27 contributes to mitochondrial morphogenesis[J]. The Plant Journal, 2014, 78(6): 1047-1059.
Rojas-Pierce M, Bednarek S Y. Manipulation of targeted protein degradation in plant biology[J]. Biochemical Society Transactions, 2025, 53(02): 409-418.
Saeed B, Deligne F, Brillada C, et al. K63-linked ubiquitin chains are a global signal for endocytosis and contribute to selective autophagy in plants[J]. Current Biology, 2023, 33(7): 1337-1345. e5.
Sharma I, Talakayala A, Tiwari M, et al. A synchronized symphony: Intersecting roles of ubiquitin proteasome system and autophagy in cellular degradation[J]. Plant Physiology and Biochemistry, 2024, 212: 108700.
Shi H, Yin J, Zhao Z, et al. Fine-tuning of IPA1 transactivation activity by E3 ligase IPI7-mediated non-proteolytic K29-ubiquitination during Magnaporthe oryzae infection[J]. Nature Communications, 2024, 15(1): 7608.
Sun J L, Li J Y, Wang M J, et al. Protein quality control in plant organelles: current progress and future perspectives[J]. Molecular plant, 2021, 14(1): 95-114.
Sun Y, Yao Z, Ye Y, et al. Ubiquitin-based pathway acts inside chloroplasts to regulate photosynthesis[J]. Science Advances, 2022, 8(46): eabq7352.
Wang D, Li C, Song W, et al. The E3 ubiquitin ligase SCFEDL3 mediates salt stress response by degradation of IbPP2CA2 to regulate ABA signaling in sweetpotato[J]. The Plant Journal, 2025, 123(1): e70307.
Wang F, Deng X W. Plant ubiquitin-proteasome pathway and its role in gibberellin signaling[J]. Cell research, 2011, 21(9): 1286-1294.
Wang S, Cao L, Wang H. Arabidopsis ubiquitin-conjugating enzyme UBC22 is required for female gametophyte development and likely involved in Lys11-linked ubiquitination[J]. Journal of Experimental Botany, 2016, 67(11): 3277-3288.
Wang X, Zhang X, Song C P, et al. PUB25 and PUB26 dynamically modulate ICE1 stability via differential ubiquitination during cold stress in Arabidopsis[J]. The Plant Cell, 2023, 35(9): 3585-3603.
Weiner E, Berryman E, Solís A G, et al. The green ESCRTs: Newly defined roles for ESCRT proteins in plants[J]. Journal of Biological Chemistry, 2025: 108465.
Yan H, Qi A, Lu Z, et al. Dual roles of AtNBR1 in regulating selective autophagy via liquid-liquid phase separation and recognition of non-ubiquitinated substrates in Arabidopsis[J]. Autophagy, 2024, 20(12): 2804-2815.
Yu P, Hua Z. The ubiquitin–26S proteasome system and autophagy relay proteome homeostasis regulation during silique development[J]. The Plant Journal, 2022, 111(5): 1324-1339.
Zelazny E, Barberon M, Curie C, et al. Ubiquitination of transporters at the forefront of plant nutrition[J]. Plant Signaling & Behavior, 2011, 6(10): 1597-1599.
Zhou B, Zeng L. Conventional and unconventional ubiquitination in plant immunity[J]. Molecular plant pathology, 2017, 18(9): 1313-1330.




















 5万+
5万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








