本文内容速览:
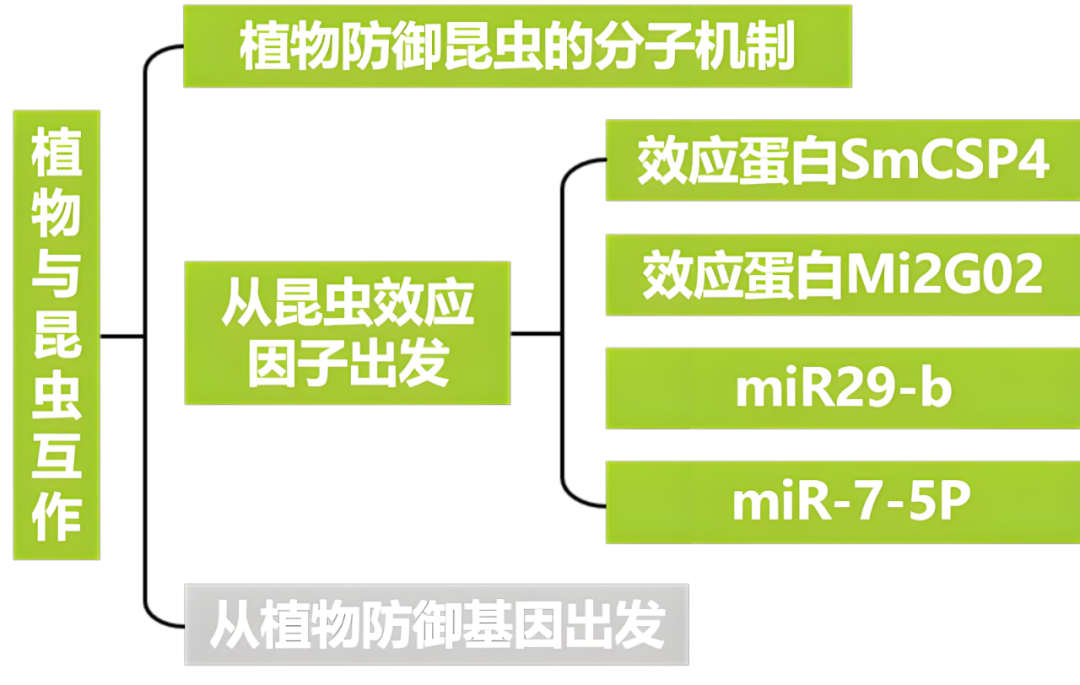
伯小远在“植物与病原菌互作机制研究——以稻瘟病为例”一文中给大家介绍了植物与病原菌之间在分子层面上的博弈,也有不少小伙伴好奇植物与昆虫互作的分子机制该怎么研究呢?今天小远就给大家简单介绍一下植物防御昆虫的分子机制,并从昆虫效应因子这个关键切入点,带大家看看如何从分子层面解析昆虫与植物的互作!
1、植物防御昆虫的分子机制
在植物与昆虫长期协同进化的过程中,二者构建起极为复杂精妙的免疫互作机制。植物首先借助细胞膜上的模式识别受体(PRRs),精准识别植食性昆虫相关分子模式(Herbivore-associated molecular patterns,HAMPs)和损伤相关分子模式(Damage-associated molecular patterns,DAMPs),从而激活模式触发免疫(PTI),这一过程会促使植物体内活性氧(ROS)爆发、强化细胞壁,并诱导防御相关基因表达,以初步抵御昆虫侵害。当昆虫通过分泌效应蛋白、miRNA等效应因子,试图抑制植物的PTI时,植物细胞内的核苷酸结合寡聚化结构域(NOD)样受体(NLRs)能特异性识别这些效应因子,引发效应子触发免疫(ETI),快速激活水杨酸(SA)、茉莉酸(JA)、乙烯(ET)等信号通路,进而合成植保素、蛋白酶抑制剂等抗虫物质,对昆虫发起更强烈的反击。
此外,植物还具备多维度感知昆虫威胁的能力。在物理层面,通过机械感受器察觉昆虫的咬噬、触碰等活动;在化学层面,依靠化学感受器识别昆虫产卵释放的化学物质,甚至能借助邻近植物释放的挥发性物质间接感知潜在威胁。这些感知信息会触发植物体内早期的电信号传导与激素调控,例如利用茉莉酸(JA)防御咬食性昆虫,用水杨酸(SA)抵御蚜虫等吸汁性昆虫。
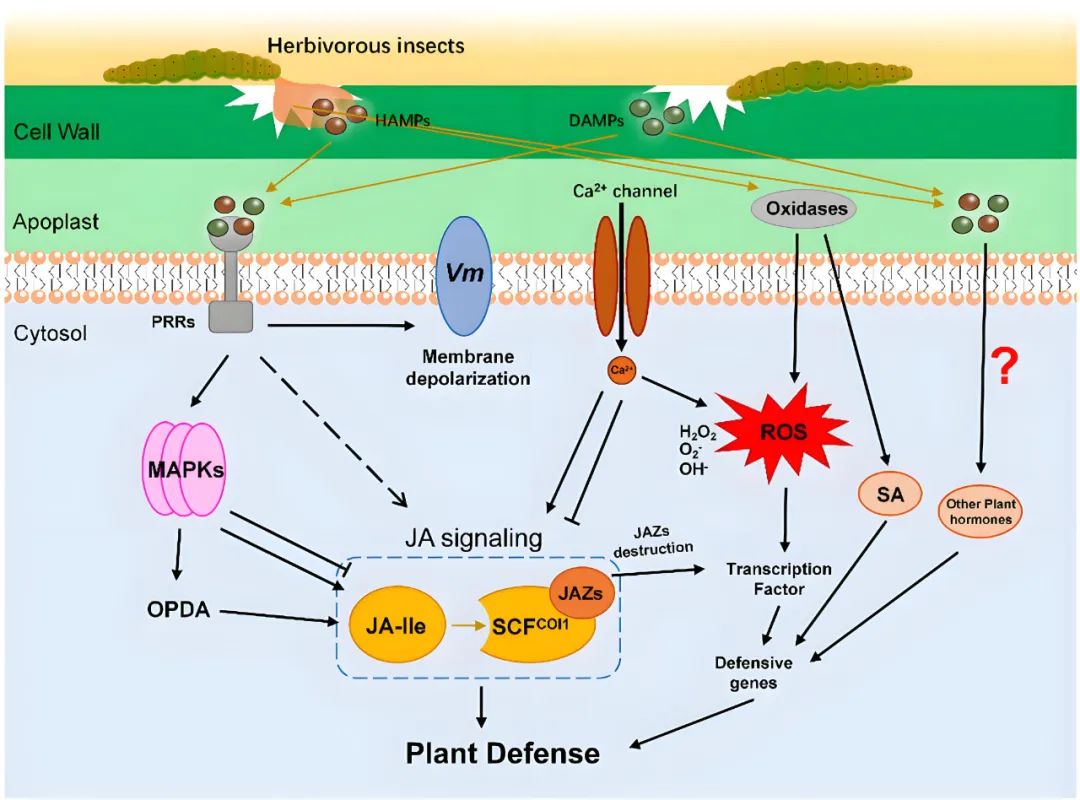
图1 植物对植食性昆虫防御反应的早期信号网络分子模型(Hu et al., 2024)。植食性昆虫口腔分泌物中HAMPs和受损植物细胞中的DAMPs被质膜上的受体感知。在昆虫取食的早期阶段,活性氧(ROS)、钙离子(Ca²⁺)、丝裂原活化蛋白激酶(MAPK)信号及膜去极化(Vm)等早期信号事件会激活茉莉酸(JA)信号通路。这些早期信号事件促进防御信号的传递并激活下游植物防御。
2、从昆虫效应因子出发
2.1
效应蛋白SmCSP4
2023年8月,中国农业科学院植物保护研究所陈巨莲课题组在Plant Biotechnology Journal杂志上发表了一篇题为“SmCSP4 from aphid saliva stimulates salicylic acid-mediated defence responses in wheat by interacting with transcription factor TaWRKY76”的研究论文,该研究发现蚜虫唾液蛋白SmCSP4作为效应因子与小麦转录因子TaWRKY76互作进而触发水杨酸(SA)介导的防御反应信号途径,增强小麦对蚜虫的抗性。
表达模式分析
作者利用RT-PCR、RT-qPCR检测了SmCSP4在蚜虫不同组织中的表达水平,发现SmCSP4在蚜虫不同组织中均有表达。利用烟草叶片进行亚细胞定位实验,发现SmCSP4定位于细胞核内。接着,作者利用RT-qPCR和WB实验测定了蚜虫取食小麦植株后小麦植株中SmCSP4的转录水平和蛋白水平,证实在蚜虫取食过程中SmCSP4可被分泌到所取食的小麦叶片组织内。
基因功能研究
(1)利用瞬时表达系统实现效应蛋白的植株导入
作者利用荧光假单胞菌EtAnH介导的递送系统,将SmCSP4或SmCSP4NLSm(带有突变核定位信号的SmCSP4)导入小麦叶片。结果显示,表达SmCSP4的EtAnH浸润小麦叶片后,叶片浸润区域出现轻微的褪绿症状,且H2O2显著积累,其含量明显高于SmCSP4NLSm浸润组(图2a、b)。此外,与对照组相比,表达SmCSP4或SmCSP4NLSm的小麦叶片中胼胝质沉积显著增多(图2c)。蚜虫在SmCSP4侵染的小麦叶片上的存活率、繁殖力和重量均显著低于对照叶片(图2d-f),并且SmCSP4侵染的小麦叶片上蚜虫的取食行为也受到了抑制(图2g)。
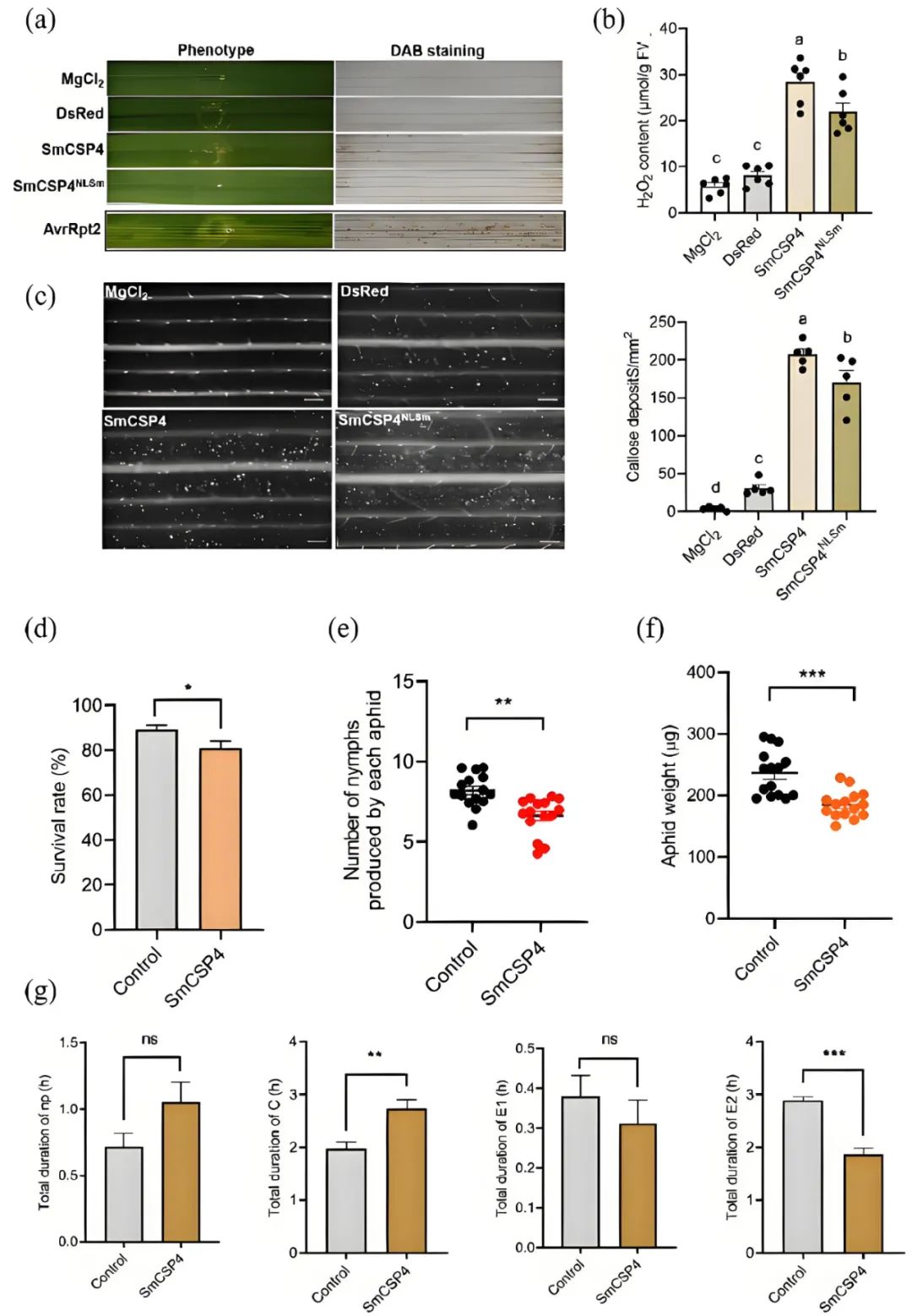
图2 SmCSP4激活植物水杨酸介导的信号防御途径(Zhang et al., 2023)。(a-c)携带pEDV6: SmCSP4或pEDV6: SmCSP4NLSm的荧光假单胞菌EtAnH浸润2天后,小麦叶片的表型(a)、H2O2含量(b)和胼胝质的沉积情况(c);(d-g)蚜虫取食接种SmCSP4的小麦叶片后的存活率(d)、产若虫数量(e)、体重变化(f)和取食行为参数(g)。
(2)通过RNAi技术沉默昆虫效应蛋白后,以效应蛋白沉默型昆虫进行植株取食实验
作者通过纳米载体介导的RNAi先沉默蚜虫中的SmCSP4,再用SmCSP4沉默型蚜虫取食小麦。结果显示,与对照组相比,SmCSP4沉默型蚜虫诱导小麦叶片产生的水杨酸(SA)减少,但对小麦叶片中茉莉酸(JA)的含量无显著影响(图3c)。此外,SmCSP4基因沉默对蚜虫的存活率无显著影响,但显著降低了蚜虫的繁殖力(图3d、e)。
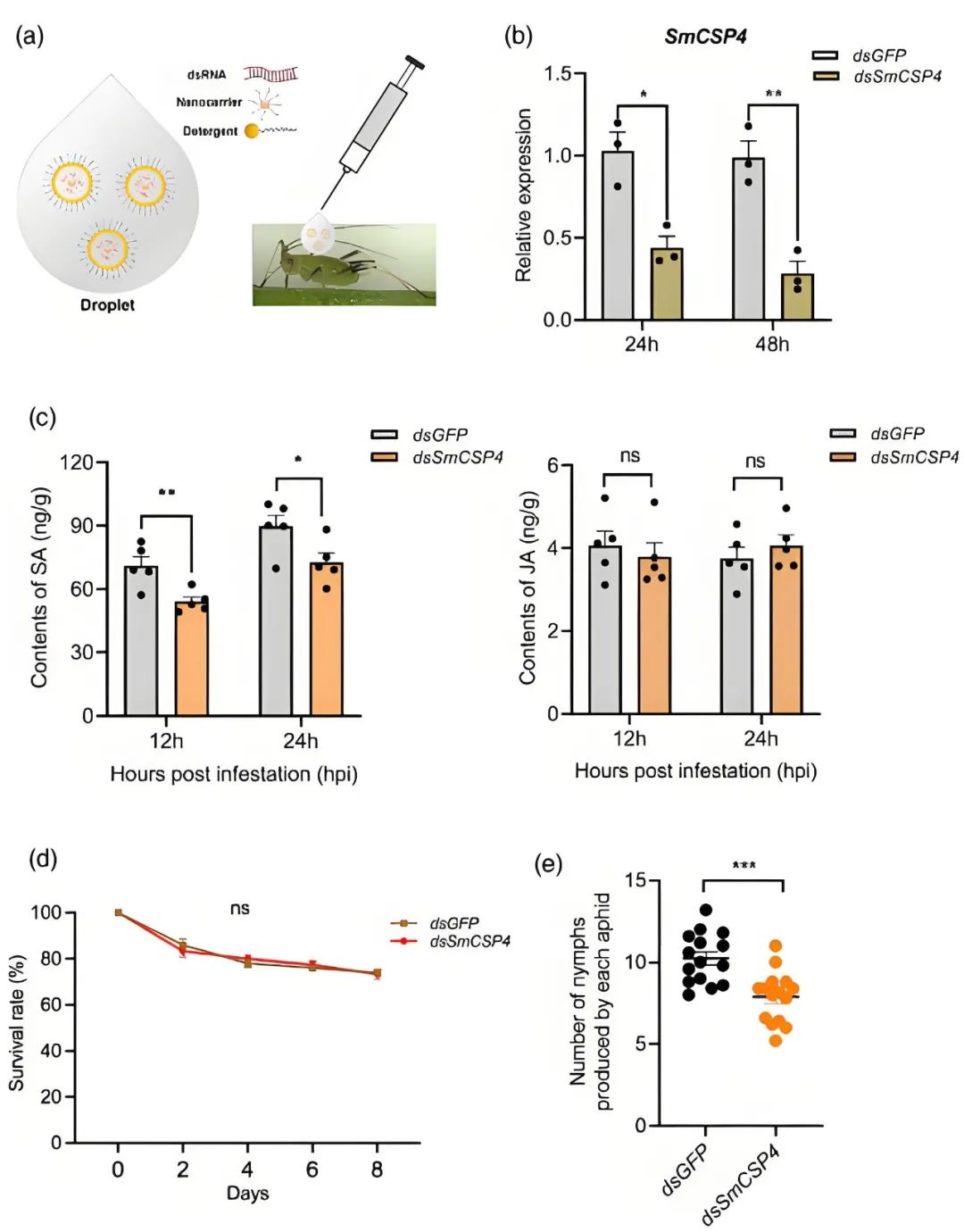
图3 通过纳米载体介导的RNAi沉默SmCSP4后的蚜虫激活了较弱的防御反应(Zhang et al., 2023)。(a)应用纳米载体介导的dsRNA递送系统的示意图;(b)dsSmCSP4/纳米载体/洗涤剂或dsGFP/纳米载体/洗涤剂(对照)处理后24h和48h SmCSP4的相对表达水平;(c)在蚜虫取食12小时和24小时时小麦叶片中SA和JA的含量;(d、e)SmCSP4沉默型蚜虫取食小麦后的存活率及产生的蚜虫数量。
分子机制解析
为了进一步解析SmCSP4调控小麦防御反应的分子机制,作者利用酵母双杂交筛库实验,以SmCSP4为诱饵,筛选了受蚜虫侵染的小麦cDNA文库。结果表明SmCSP4可与小麦转录因子TaWRKY76互作,并利用酵母双杂交点对点验证(Y2H)、双分子荧光互补(BiFC)和免疫共沉淀(Co-IP)验证了SmCSP4和TaWRKY76的互作关系(图4)。
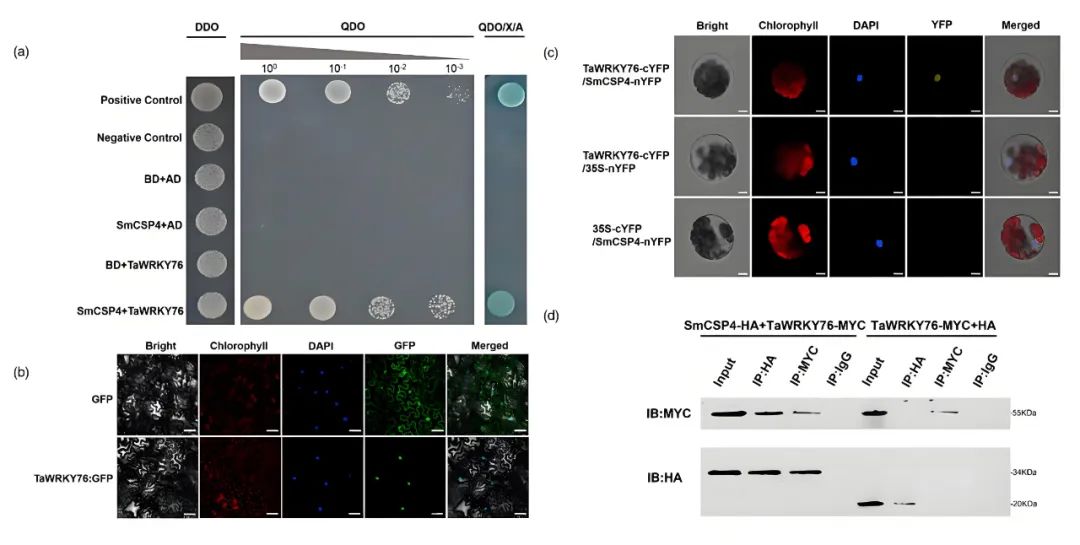
图4 SmCSP4与小麦TaWRKY76相互作用(Zhang et al., 2023)。(a)Y2H检测SmCSP4和TaWRKY76之间的相互作用;(b)TaWRKY76在本氏烟草叶片中的亚细胞定位;(c)BiFC测定SmCSP4与TaWRKY76在本氏烟草叶片原生质体中的相互作用;(d)Co‐IP测定SmCSP4和TaWRKY76之间的相互作用。
接着作者利用VIGS技术沉默小麦叶片中TaWRKY76的表达,发现TaWRKY76基因沉默后 SA 信号通路相关基因DMR6的表达水平显著降低,并且在DMR6基因启动子序列中鉴定出两个潜在的WRKY结合区。进一步利用酵母单杂交实验(Y1H)、双荧光素酶报告基因实验(Dual-LUC)、GUS染色实验发现TaWRKY76可与DMR6启动子结合并激活其基因表达,但蚜虫分泌的唾液蛋白SmCSP4与TaWRKY76互作后降低了TaWRKY76对DMR6表达的转录激活活性,导致DMR6基因表达下降,SA含量增加,进而诱导下游防御信号途径并提高小麦对蚜虫的抗性(图5)。
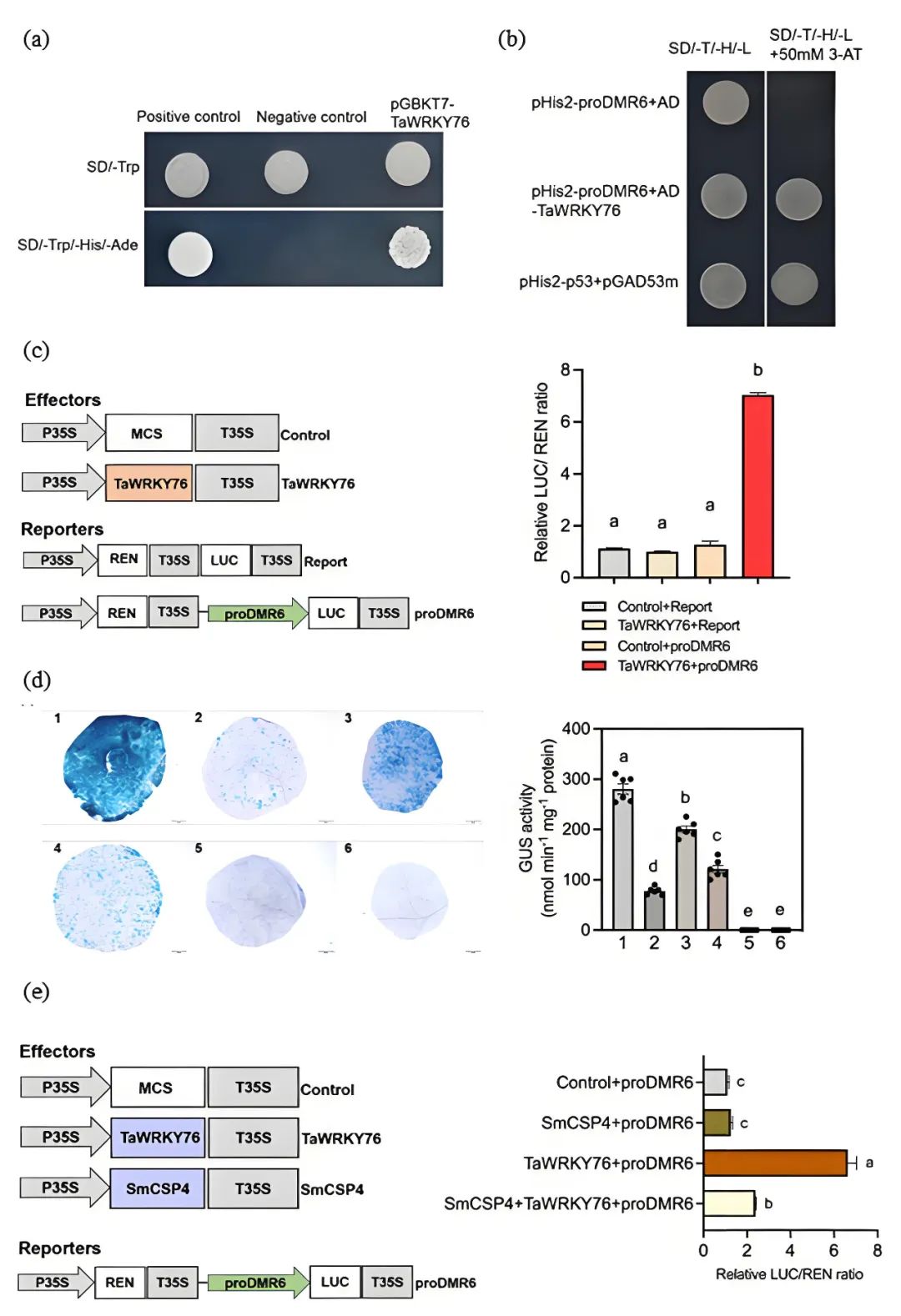
图5 SmCSP4抑制TaWRKY76对DMR6表达的转录激活活性(Zhang et al., 2023)。(a)酵母体系测定TaWRKY76的转录激活活性;(b)Y1H检测TaWRKY76与DMR6启动子的相互作用;(c)Dual-LUC检测TaWRKY76与DMR6启动子的结合活性;(d)GUS染色实验检测SmCSP4对TaWRKY76与DMR6启动子结合活性的影响;(e)Dual-LUC检测SmCSP4对TaWRKY76激活DMR6表达的影响。
上述文献在探究昆虫效应蛋白参与植物防御反应的功能时,采用了两种研究方法:(1)利用瞬时表达系统实现效应蛋白的植株导入;(2)通过RNAi技术沉默昆虫效应蛋白后,以效应蛋白沉默型昆虫取食植株。除了以上两种方法外,以下这篇文献还使用了不同的方法,快跟小远一起看看吧。
2.2
效应蛋白Mi2G02
2024年2月,中国农业科学院蔬菜花卉研究所茆振川课题组联合法国农科院Pierre Abad课题组在Plant Communications杂志上发表了一篇题为“The root-knot nematode effector Mi2G02 hijacks a host plant trihelix transcription factor to promote nematode parasitism”的研究论文,该研究报道了南方根结线虫(Meloidogyne incognita)分泌的Mi2G02效应蛋白与宿主转录因子GT-3a互作,调控下游靶基因表达帮助线虫寄生的分子机制。
(1) 构建靶向昆虫效应蛋白的RNAi载体并在植物体内表达,获得RNAi转基因植株后,用昆虫取食该转基因植株
作者构建了三个表达Mi2G02发夹双链RNA的纯合拟南芥RNAi株系,用线虫取食该转基因株系,通过对取食过该转基因植株的线虫进行RT-qPCR分析,证实宿主来源的RNAi可以沉默线虫体内Mi2G02的表达(图6A)。Mi2G02 RNAi株系中的虫瘿和卵块数量相较于两种对照株系(野生型植株和GFP RNAi株系)至少减少了60%(图6B)。Mi2G02 RNAi株系的巨细胞面积均比对照显著减小(图6C)。结果表明,Mi2G02在线虫寄生过程中发挥着重要作用。
(2) 在植物体内异源过表达昆虫效应蛋白,获得异源过表达转基因植株后,用昆虫取食该转基因植株
作者构建了两个异源过表达Mi2G02的转基因拟南芥株系,发现这两个株系的根分别比野生型植株的根长27%和33%(图6D),在线虫接种试验中,这两个株系对线虫感染的敏感性均显著高于野生型植株,且虫瘿和卵块比野生型植物多出30%左右(图6E)。因此,Mi2G02是线虫寄生所必需的效应物,并且能够调节根的生长。
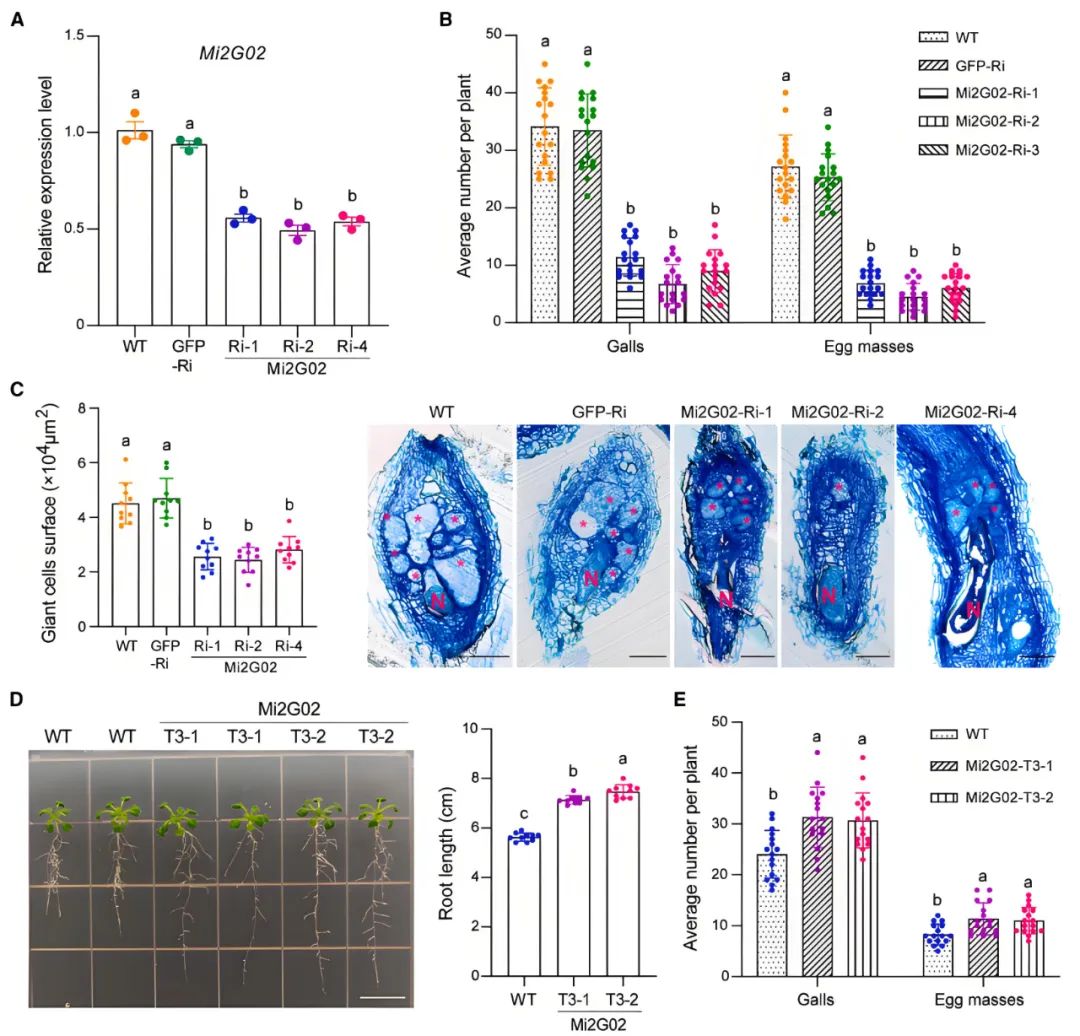
图6 拟南芥中宿主来源的RNA干扰及Mi2G02的异源过表达可改变植株对南方根结线虫的易感性及根系发育(Zhao et al.,2024)。(A)在感染南方根结线虫后第10天,通过RT-qPCR测定三个纯合RNAi株系中Mi2G02的表达水平;(B、C)拟南芥Mi2G02-RNAi株系在感染南方根结线虫后每株植物的瘿瘤数和卵块数(B)、南方根结线虫诱导的瘿瘤的巨细胞面积(C);(D)拟南芥Mi2G02异源过表达株系的根长;(E)拟南芥Mi2G02异源过表达株系在感染南方根结线虫后每株植物的瘿瘤数和卵块数。
这篇文献在探究昆虫效应蛋白参与植物防御反应的功能时,也采用了两种研究方法:(1)构建靶向昆虫效应蛋白的RNAi载体并在植物体内表达,获得RNAi转基因植株后,用昆虫取食该转基因植株;(2)在植物体内异源过表达昆虫效应蛋白,获得异源过表达转基因植株后,用昆虫取食该转基因植株。
在昆虫与植物的协同进化过程中,除效应蛋白等传统效应因子外,昆虫来源的小分子RNA(sRNA)已被证实可通过取食行为分泌至植物体内,作为新型效应因子参与调控宿主植物的防御响应。其中,miRNA作为昆虫sRNA的重要组成部分,其与植物的互作机制正成为揭示昆虫-植物互作网络的研究热点。下面让我们看看如何研究昆虫miRNA和植物互作机制。
2.3
miR29-b
2025年1月,浙江大学王晓伟课题组在Molecular Plant杂志上发表了一篇题为“A small RNA effector conserved in herbivoreinsects suppresses host plant defense bycross-kingdom gene silencing”的研究论文,作者发现昆虫来源的保守miR29-b效应因子通过跨界沉默寄主植物BAG4基因,精细调控植物SA和JA介导的防御机制,为食草性昆虫与其寄主植物之间的防御与反防御机制提供了新的见解。
表达模式分析
作者通过RT-PCR、Northern blot实验检测BtmiR29-b在粉虱体内的表达情况以及粉虱侵染后植株中BtmiR29-b的表达情况,发现BtmiR29-b在粉虱唾液腺中高表达,并且发现BtmiR29-b存在于粉虱侵染后的烟草叶片、韧皮部渗出液中,且在粉虱取食后,BtmiR29-b在烟草中的丰度随时间逐渐增加,同时BtmiR29-b也能通过粉虱取食传递至拟南芥、棉花等其他宿主植物的细胞及韧皮部汁液中,证实BtmiR29-b可作为分泌型miRNA在粉虱侵染时进入植物细胞发挥效应因子作用(图7)。
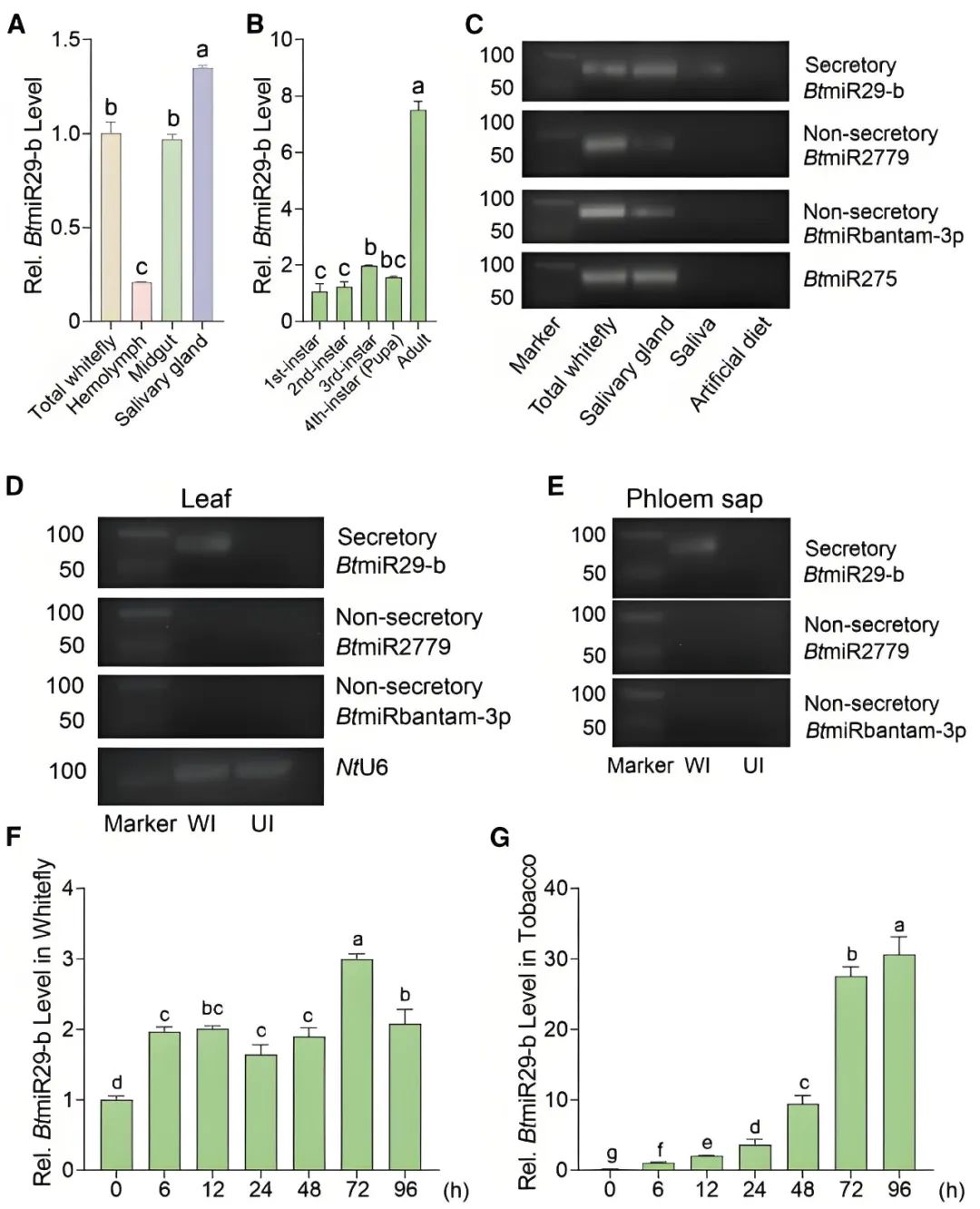
图7 释放到烟草植物细胞中的粉虱miRNA效应因子的鉴定(Han et al., 2025)。(A)BtmiR29-b在粉虱不同组织中的相对表达水平;(B)BtmiR29-b在粉虱不同发育阶段的相对表达水平;(C)RT-PCR检测显示,分泌型BtmiR29-b存在于粉虱整体、唾液腺和唾液中,而非分泌型BtmiR2779和BtmiRbantam-3p仅在粉虱整体和唾液腺中检测到;(D、E)RT-PCR检测显示,在粉虱侵染的烟草叶片(D)、烟草韧皮部汁液(E)中检测到分泌型BtmiR29-b,以非分泌型BtmiR2779和BtmiRbantam-3p作为阴性对照。WI:粉虱侵染的烟草叶片;UI:未被粉虱侵染的烟草叶片;(F)粉虱取食烟草后,不同取食时间下粉虱中BtmiR29-b的表达水平变化;(G)粉虱取食烟草后,不同取食时间下烟草中BtmiR29-b的水平变化。
基因功能研究
(1) 在植物体内异源过表达昆虫miRNA,获得异源过表达转基因植株后,用昆虫取食该转基因植株
作者利用CaMV 35S启动子和韧皮部特异性AtSUC2启动子分别驱动BtmiR29-b在烟草中表达,获得p35S::BtmiR29-b和pAtSUC2::BtmiR29-b转基因株系,发现两种转基因烟草中BtmiR29-b均显著高表达,且粉虱存活率、产卵量显著增加,表明在烟草中异源表达BtmiR29-b会使烟草对粉虱的防御能力下降。
(2) 在植物体内表达针对昆虫miRNA的竞争性结合分子,获得表达miRNA竞争性结合分子的转基因植株后,用昆虫取食该转基因植株
作者构建p35S::mimic29-b转基因烟草,其表达的mimic29-b可竞争性结合BtmiR29-b,阻断其功能,粉虱在该转基因株系上的存活率无显著变化,但产卵量显著减少,表明干扰烟草中的miRNA效应因子BtmiR29-b会影响粉虱的繁殖性能。
(3) 干扰或增强昆虫中miRNA的表达,再以miRNA差异型昆虫取食植株
作者采用Antagomir29-b(一种与BtmiR29-b互补的化学修饰单链RNA模拟物)处理粉虱,以降低粉虱体内及侵染烟草中的BtmiR29-b丰度,导致粉虱取食寄主植物后存活率和繁殖力显著下降;采用agomir29-b(一种化学修饰的双链miRNA模拟物)处理粉虱,模拟内源性BtmiR29-b并增强其表达,使粉虱释放至寄主植物的BtmiR29-b水平升高,导致粉虱取食寄主后存活率和繁殖力呈上升趋势。
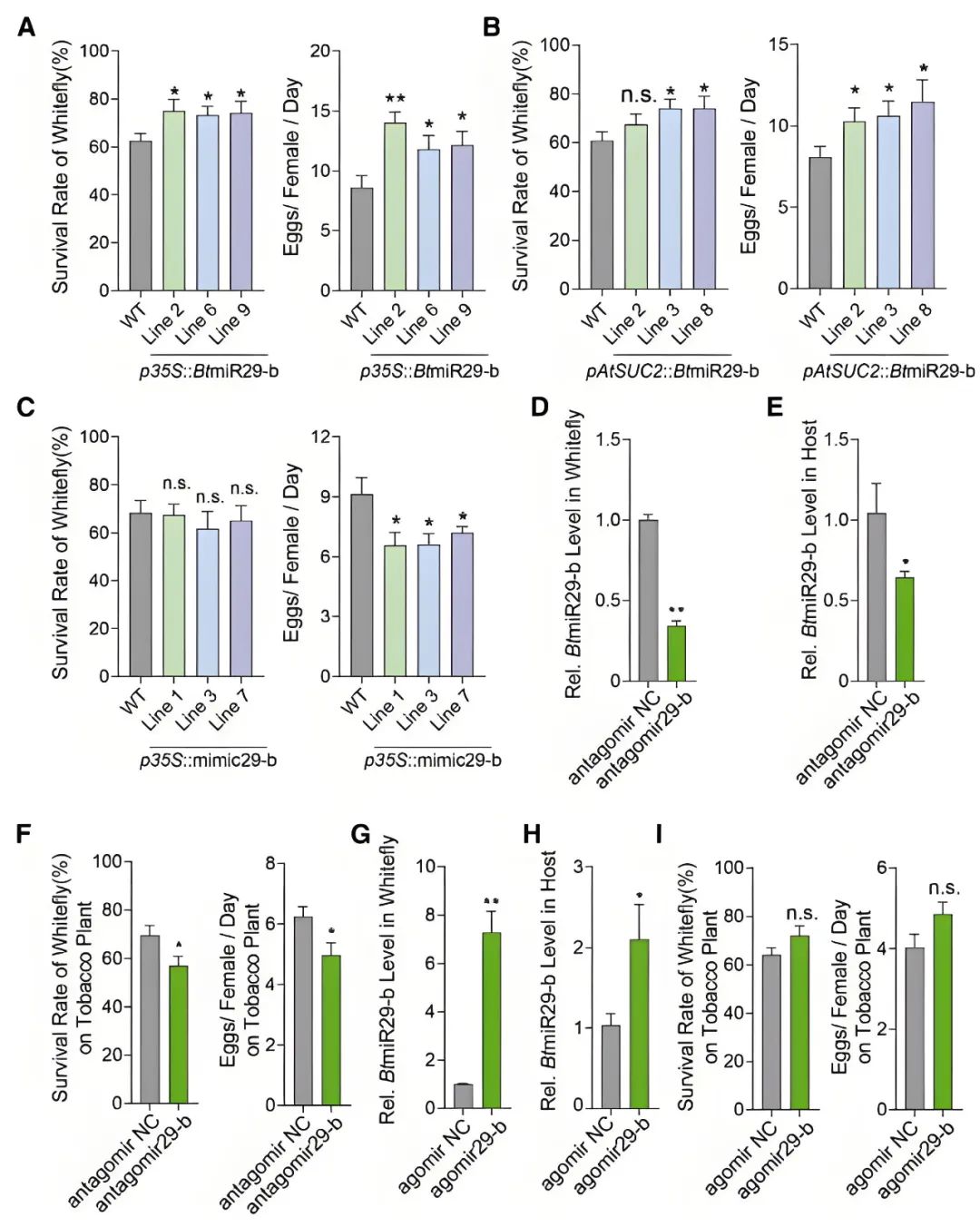
图8 BtmiR29-b效应因子增强粉虱的性能(Han et al., 2025)。(A-C)摄食WT、p35S::BtmiR29-b、pAtSUC2::BtmiR29-b、p35S::mimic29-b转基因烟草3天后每只雌性粉虱的存活率和平均产卵数;(D)粉虱在食用含有antagomir NC(阴性对照)或antagomir29-b的人工饮食24小时后,粉虱中的相对BtmiR29-b水平;(E)以antagomir NC或antagomir29-b为食的粉虱侵染48小时后释放到宿主烟草中的相对BtmiR29-b水平;(F)antagomir29-b处理的粉虱在烟草植株上的存活率和每只雌性的平均产卵数;(G)粉虱在食用含有agomir NC(阴性对照)或agomir29-b的人工饲料24小时后,粉虱的相对BtmiR29-b水平;(H)以agomir NC或agomir29-b为食的粉虱侵染48小时后释放到烟草中的相对BtmiR29-b水平;(I)agomir29-b处理的粉虱在烟草上的存活率和每只雌性的平均产卵数。
分子机制解析
通过Target Finder软件预测BtmiR29-b的靶向位点,发现BtmiR29-b可靶向烟草防御基因NtBAG4(图9J)。利用RT-qPCR检测烟草中NtBAG4的表达水平,发现粉虱侵染显著降低烟草中NtBAG4的转录水平(图9A);用antagomir29-b处理粉虱并取食烟草后,烟草中NtBAG4表达升高(图9B),而用agomir29-b处理则抑制NtBAG4表达(图9C);过表达BtmiR29-b的转基因烟草中NtBAG4表达显著下调(图9D、E)。降解组测序结果表明,在粉虱侵染的烟草中,NtBAG4 mRNA在257bp处被特异性切割,与预测的BtmiR29-b靶向位点一致(图9K)。使用GFP报告基因系统,发现野生型NtBAG4编码区与BtmiR29-b共表达时,GFP荧光显著减弱(图9L)。
随后作者研究了NtBAG4是否参与烟草对粉虱的防御,发现过表达NtBAG4的转基因烟草(p35S::NtBAG4)显著降低粉虱的存活率和繁殖力,增强植物抗性(图9F);沉默NtBAG4则提高粉虱在烟草上的存活率及对粉虱的吸引力(图9G、I),并且粉虱更偏好野生型烟草,而非过表达NtBAG4的烟草植株(图9H),表明NtBAG4是烟草防御粉虱的关键基因。
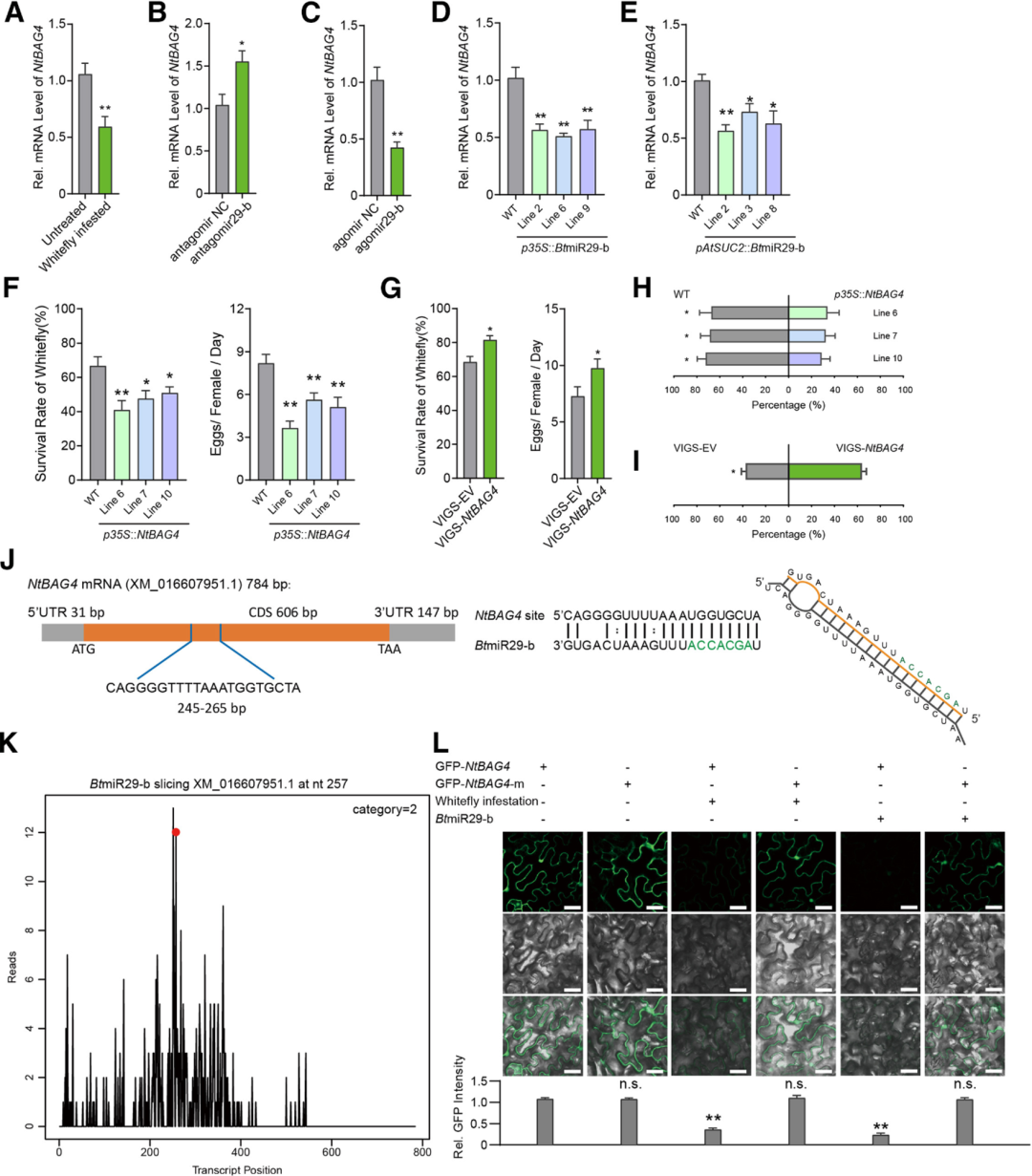
图9 BtmiR29-b抑制NtBAG4转录本的积累并抑制寄主植物防御反应(Han et al., 2025)。(A)未经处理和粉虱侵染的烟草中NtBAG4的相对mRNA水平;(B)antagomir29-b处理的粉虱侵染的烟草中NtBAG4的相对mRNA水平;(C)agomir29-b处理的粉虱侵染的烟草中NtBAG4的相对mRNA水平;(D、E)WT、p35S::BtmiR29-b、pAtSUC2::BtmiR29-b转基因烟草中NtBAG4的相对mRNA水平;(F-I)粉虱在WT、p35S::NtBAG4、NtBAG4沉默转基因烟草上的存活率和每只雌性的平均卵数及对烟草的偏好;(J)BtmiR29-b靶向烟草NtBAG4 mRNA的示意图;(K)降解组测序验证BtmiR29-b靶向NtBAG4 mRNA;(L)在粉虱侵染或BtmiR29-b共表达48h后,用共聚焦显微镜观察本氏烟草中GFP-NtBAG4的表达。
2.4
miR-7-5P
2024年4月,宁波大学黄海剑课题组在PNAS杂志上发表了一篇题为“Cross-kingdom RNA interference mediated by insect salivary microRNAs may suppress plant immunity”的研究论文,该研究揭示了稻飞虱唾液miRNA跨界调控植物的机制。作者发现miR-7-5P在褐飞虱唾液腺的表达量远高于其他组织,并且miR-7-5P分泌到宿主植物体内后能够系统性地迁移。随后作者发现转录因子bZIP43是褐飞虱唾液miR-7-5P在水稻中的重要靶标之一,沉默唾液miR-7-5P的稻飞虱取食会诱导水稻防御相关转录因子bZIP43的表达,引发抗虫反应。作者还通过转基因水稻过表达bZIP43和miR-7-5P,进一步明确了bZIP43的抗虫功能和miR-7-5P通过抑制水稻bZIP43促进褐飞虱取食。这篇文章整体研究思路与前面讲解的文献是相似的,这里仅作简单介绍,感兴趣的小伙伴可以自行下载文献阅读噢。
伯远生物在这篇文章中首先介绍了植物通过PRRs触发PTI、NLRs引发ETI的双层防御机制,以及植物在物理、化学等多维度感知昆虫威胁的能力;接着以蚜虫效应蛋白SmCSP4、根结线虫效应蛋白Mi2G02、粉虱miR29-b和褐飞虱miR-7-5P为例,介绍了研究昆虫效应因子的体内基因功能研究方法,并阐述昆虫借助效应因子跨界调控植物防御的过程以及互作分子机制,其中SmCSP4与TaWRKY76互作激活SA防御,Mi2G02通过调控GT-3a促进寄生,miR29-b和miR-7-5P分别靶向植物BAG4和bZIP43基因影响防御。
最后,根据以上文章,我们来梳理一下可以从哪些方面来探究昆虫效应蛋白与植物互作的分子机制。当然小远总结的内容也不是特别全面,仍有更多方法值得探索,如果大家有找到其他文献案例的话欢迎跟小远分享噢!
1、 表达模式分析
表达模式分析可以分为两类:一是分析效应因子在昆虫体内的表达谱;二是分析昆虫取食植物后,效应因子在植物体内的存在以及动态变化。

2、基因功能研究
基因功能研究也可以分为两类:一是通过植物转基因技术(过表达或沉默)或瞬时表达系统,直接干预效应因子在植物体内的表达或活性,观察植物抗虫表型变化;二是先在昆虫体内调节效应因子表达,再用处理后的昆虫取食植物,分析植物防御响应变化。

3、分子机制解析
对于昆虫体内的效应蛋白,可以筛选效应蛋白在植物体内的互作蛋白并进行点对点验证;其次研究效应蛋白转入植物体内对防御反应相关基因的影响。
对于昆虫体内的miRNA,可以预测miRNA在植物体内的靶基因并进行点对点验证;其次研究miRNA转入植物体内对防御反应相关基因的影响。

References:
Hu C, Li Y T, Liu Y X, et al. Molecular interaction network of plant-herbivorous insects[J]. Advanced Agrochem, 2024, 3(1): 74-82.
Zhang Y, Fu Y, Liu X, et al. SmCSP4 from aphid saliva stimulates salicylic acid-mediated defence responses in wheat by interacting with transcription factor TaWKRY76[J]. Plant Biotechnology Journal, 2023, 21(11): 2389-2407.
Zhao J, Huang K, Liu R, et al. The root-knot nematode effector Mi2G02 hijacks a host plant trihelix transcription factor to promote nematode parasitism[J]. Plant communications, 2024, 5(2).
Han W H, Ji S X, Zhang F B, et al. A small RNA effector conserved in herbivore insects suppresses host plant defense by cross-kingdom gene silencing[J]. Molecular Plant, 2025.
Zhang Z L, Wang X J, Lu J B, et al. Cross-kingdom RNA interference mediated by insect salivary microRNAs may suppress plant immunity[J]. Proceedings of the National Academy of Sciences, 2024, 121(16): e2318783121.




















 5万+
5万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








