药物亲和反应的靶点稳定性(drug affinity responsive target stability,DARTS)是一种借助“药物-靶蛋白结合增强蛋白酶抗性”分子机制解决药物靶点高通量筛选难题的技术方案。该技术由Lomenick团队于2009年首次报道,由于无需化学修饰以及兼容复杂生物体系的技术优势,成为迄今为止应用最广泛的靶点筛选方法之一。

技术原理
小分子配体(如药物)与靶蛋白结合后,可以稳定靶蛋白的构象,增强其对蛋白水解酶水解作用的抗性。当蛋白结合药物后,对亲和反应后的混合蛋白使用蛋白酶进行水解处理。与对照组相比,药物组酶解产物经凝胶电泳分离后,与药物结合的蛋白片段增多,最后借助Western blot或质谱即可鉴定与药物结合的靶点蛋白。
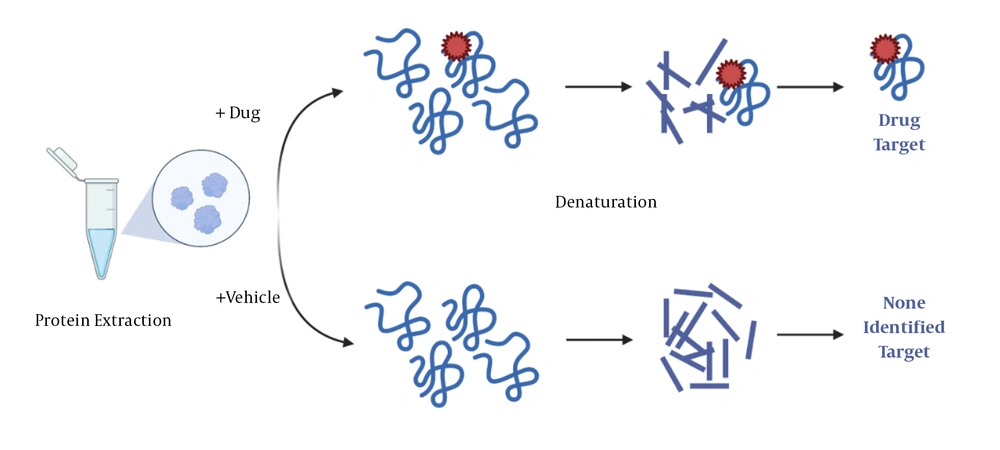
(Gholizadeh et al., 2021)
技术流程
1、样本准备:选择培养至合适状态的细胞,使用非变性裂解液裂解细胞并提取总蛋白;
2、样本孵育:蛋白裂解液分为两组,分别加入对照溶剂和小分子药物,孵育一段时间确保药物充分与靶蛋白结合;
3、酶切处理:根绝靶蛋白类型选择合适的蛋白酶(枯草杆菌蛋白酶、嗜热菌蛋白酶及链酶蛋白酶等)对总蛋白进行酶切消化;
4、结果检测:根据不同实验目的,可分别按照如下方法进行检测:
(1)电泳分析:通过SDS-PAGE凝胶电泳分析对照组和药物组目的蛋白表达量,明确药物是否影响靶蛋白稳定性;
(2)质谱鉴定:通过SDS-PAGE凝胶电泳分析对照组和药物组条带差异,并将差异条带切胶后进行质谱鉴定,筛选小分子药物的潜在靶点蛋白。
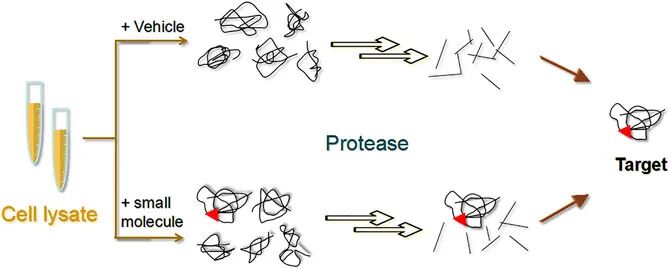
(Li et al., 2021)
技术优势
(1)药物无需固定化或修饰,保持天然结构和活性;
(2)直接在细胞裂解液中检测,保持蛋白天然构象和修饰状态;
(3)无需昂贵化学试剂和设备,操作简单;
(4)适用于各种能与蛋白结合的小分子,包括天然产物和多肽分子。
技术局限
(1)无法有效检测低亲和力或低丰度蛋白靶点,灵敏度低;
(2)非特异性蛋白聚集造成假阳性信号;
(3)高度依赖分子结合改变蛋白酶敏感性特点。
应用场景
(1)天然药物靶点发现和筛选;
(2)药物作用信号通路解析;
(3)药物安全性评估。
文献案例
2025年,Yonsei大学Lee团队利用DARTS联合LC-MS/MS蛋白质组学分析确定天然化合物醋酸酰胺素(ACA)的关键靶标LAMTOR1,明确ACA通过LAMTOR1-MTORC1-AMPK信号通路调节自噬,揭示了代谢功能障碍相关脂肪肝的潜在治疗靶点。
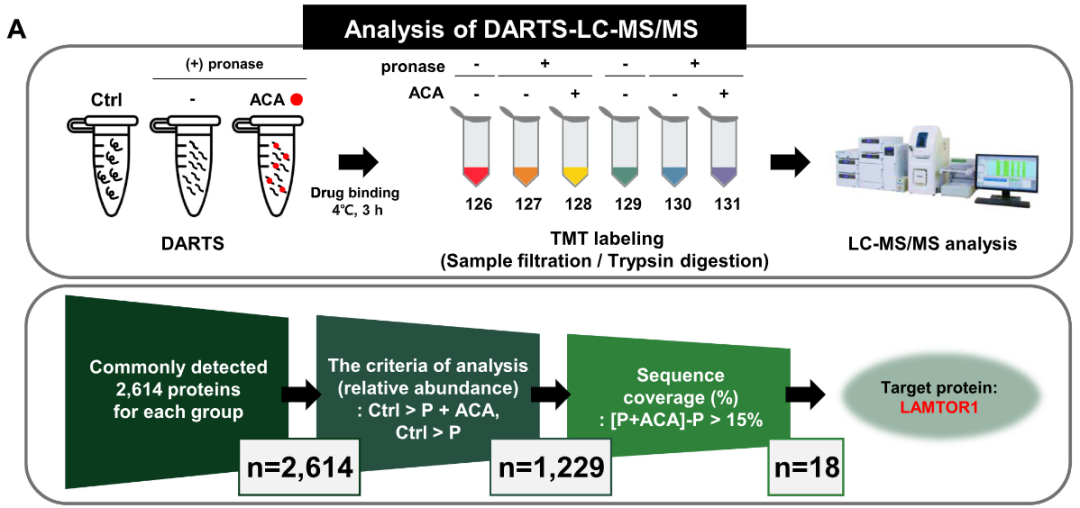
(Jang et al., 2025)
参考文献
[1] Lomenick B, Hao R, Jonai N, et al. Target identification using drug affinity responsive target stability (DARTS) [J]. Proc Natl Acad Sci USA, 2009, 106(51):21984-21989.
[2] Jang Y, Ko M, Lee JY, et al. Inhibition of lysosomal LAMTOR1 increases autophagy by suppressing the MTORC1 pathway to ameliorate lipid accumulations in MAFLD [J]. Autophagy, 2025, 6: 1-17.
[3] Li G, Peng X, Guo Y, et al. Currently Available Strategies for Target Identification of Bioactive Natural Products [J]. Front Chem, 2021, 9: 761609.





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








