
结直肠癌(Colorectal Cancer, CRC)是一种复杂的病理状态,遗传和表观遗传改变在其发病机制中都起着关键作用。在CRC的恶性转化过程中,基因启动子的超甲基化经常被观察到。然而,这种表观遗传机制在癌细胞中是起驱动作用还是仅仅是致癌过程的后果,仍有待阐明。Tejedor等人发表在《Clinical Epigenetics》杂志上的研究文章“CRISPR/dCAS9-mediated DNA demethylation screen identifes functional epigenetic determinants of colorectal cancer”,通过CRISPR/dCas9介导的DNA去甲基化筛选,为识别结直肠癌中功能性的表观遗传决定因子提供了新的视角。
研究者采用了多组学整合方法,结合计算资源和最先进的表观基因组编辑技术。首先,他们在人类CRC样本和8个结肠癌细胞系中识别出与DNA甲基化和基因表达强烈相关的基因候选者。接着,利用CRISPR-dCas9表观基因组编辑工具(dCas9-TET1、dCas9-TET-IM)和定制的gRNA库,对56个先前与CRC中强烈的表观遗传抑制相关的启动子的DNA甲基化状态进行调节,并通过高含量细胞增殖筛选监测DNA甲基化丢失的潜在功能后果。
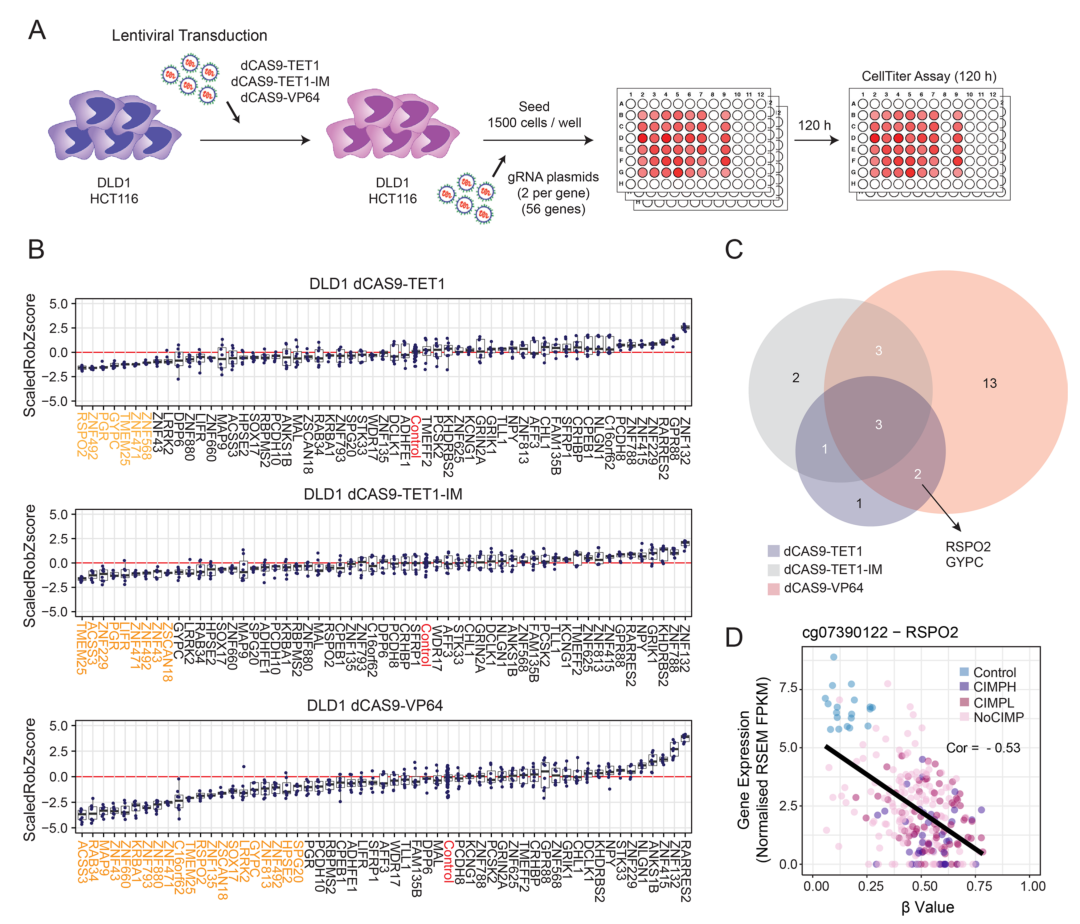
图1 CRISPR-dCas9去甲基化筛选鉴定出DLD1细胞中的功能性表观遗传驱动因子(Tejedor et al., 2023)。
然后,使用dCas9-VP64针对RSPO2基因的启动子区域进行转录激活,结果显示RSPO2表达水平显著增加(35到76倍),并且这种表达增加与DLD1和HCT116细胞系的细胞增殖能力显著降低相关。这表明RSPO2基因的表达恢复(通过转录激活)能够抑制CRC细胞的增殖,进一步支持RSPO2在CRC中作为潜在肿瘤抑制基因的功能。dCas9-VP64介导的转录激活与dCas9-TET1(DNA去甲基化工具)的效果进行对比。结果显示,虽然dCas9-TET1也能通过DNA去甲基化部分恢复RSPO2的表达并抑制细胞增殖,但其效果相对较弱(约1.7倍表达增加),而dCas9-VP64介导的转录激活效果更强。dCas9-VP64的应用证明了RSPO2基因的转录激活能够显著抑制CRC细胞的增殖,并且这种转录激活机制在研究基因功能方面可能比DNA去甲基化工具更有效。这些发现进一步支持RSPO2作为CRC的潜在治疗靶点。
参考文献
[1]Tejedor J R, Peñarroya A, Gancedo-Verdejo J, et al. CRISPR/dCAS9-mediated DNA demethylation screen identifies functional epigenetic determinants of colorectal cancer[J]. Clinical Epigenetics, 2023, 15(1): 133.





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








