
首个晚期食管癌PD-1单抗疗法
//7月31日,美国FDA批准抗PD-1疗法Keytruda作为单药治疗复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者,这些患者的肿瘤表达PD-L1(综合阳性评分[CPS]≥10),既往一线或多线全身治疗后疾病仍然进展。新的适应症获批,使Keytruda成为目前首个获批治疗先前经过治疗、复发性局部晚期或转移性食管鳞状细胞癌患者的抗PD-1疗法。
这也是Keytruda获FDA批准的继治疗非小细胞肺癌(NSCLC)、小细胞肺癌(SCLC)、头颈癌、肝细胞癌、肾癌等10多种癌症适应症的又一适应症。在国内,Keytruda的获批情况也是进展非常顺利。2018年7月,Keytruda(可瑞达,帕博利珠单抗)在中国获批,用于经一线治疗失败的不可切除或转移性黑色素瘤的治疗,成为了我国首个用于治疗晚期黑色素瘤的PD-1抑制剂药物。2019年3月,Keytruda联合培美曲塞、顺铂在中国获批,一线治疗EGFR和ALK阴性的转移性非鳞状非小细胞肺癌。显然,Keytruda越来越在免疫治疗中占据不可动摇的地位,成为越来越多患者的救命良药。
//FDA推荐使用CPS 判读标准//值得注意的是,此次对于食管癌适应症的获批,FDA特别提到PD-L1判读标准为综合阳性评分[CPS]≥10。那么问题来了,CPS是什么呢?
目前主要PD-L1检测抗体使用的判读方法有TPS、CPS以及分别计算TC和IC判读方法,不同判读方法的主要差异在与是否计算肿瘤区域阳性表达的免疫细胞数量。肿瘤细胞阳性比例分数(Tumor Proportion Score, TPS)比较容易理解, 肿瘤细胞PD-L1表达水平高低会直接影响到免疫检查点抑制剂治疗效果。但除了肿瘤细胞表达PD-L1之外,淋巴细胞、巨噬细胞等免疫细胞以及间质细胞也会有PD-L1表达,从而抑制免疫功能。例如,复发/转移性头颈部鳞癌(HNSCC)治疗一线研究KN-048、胃癌/胃食管结合部腺癌(GC/GEJA)研究KN-059、尿路上皮癌(UC)研究KN-052、宫颈癌(CC)研究KN-158以及食管癌(EC)KN-181等相关研究中,都表明上述癌种评估免疫细胞的PD-L1表达水平与免疫治疗药物响应密切相关。因此,我们需要引入另一个PD-L1表达概念:综合阳性分数(Combined Positive Score,CPS)。

所谓CPS是指样本组织中全部符合要求的阳性染色细胞占比分数,评判标准为:任意强度膜染色的肿瘤细胞、与肿瘤细胞直接关联的膜/胞质染色的淋巴/巨噬细胞,上述细胞相对于肿瘤细胞(至少一百个)的比例分数,但应排除全部坏死细胞、间质细胞、原位癌以及其它免疫细胞(包括但不限于中性粒细胞、嗜酸性细胞、浆细胞)等染色。
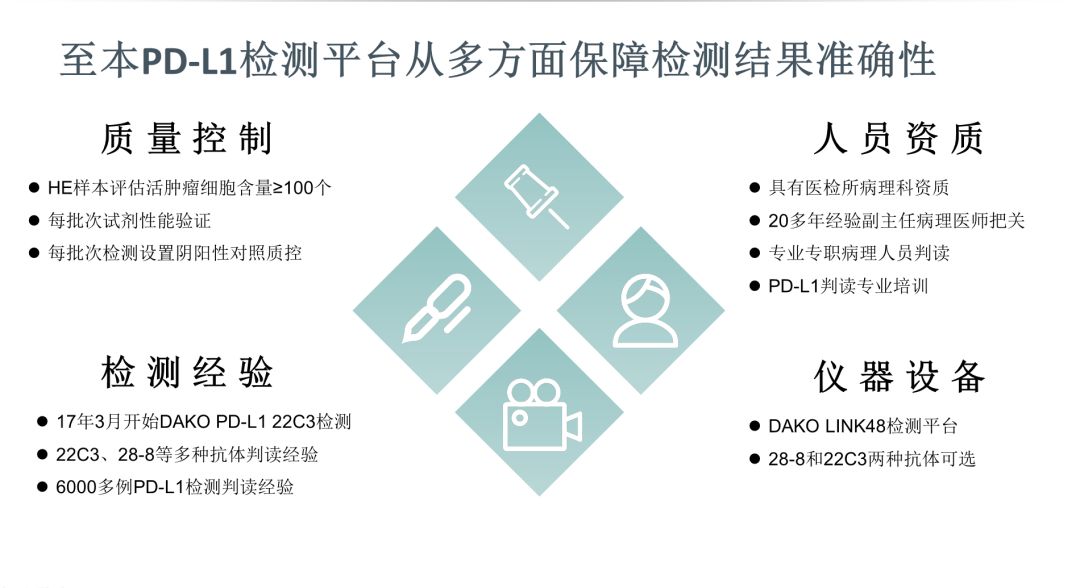
//至本 PD-L1判读标准 和 检测优势//针对不同瘤种,PD-L1判读标准并不相同。至本PD-L1判读标准已前瞻性的于FDA批准之前将食管肿瘤的判读标准更改为CPS的判读方式。这也体现出至本PD-L1判读标准紧跟NCCN指南及临床试验的最新进展,为临床医生及患者提供最准确的检测结果。
PD-L1表达水平是评估患者是否适合使用Keytruda的重要指标。PD-L1免疫组化检测判断PD-L1表达水平的一种最简单有效的方法,至本医疗科技的PD-L1免疫组化检测产品除了紧跟最新进展,还——
检测技术成熟,从17年3月份开始PD-L1 DAKO 22C3检测。
专业人员专职进行检测及判读,根据不同瘤种使用TPS/CPS判读方法。
具有丰富的PD-L1检测数据。两种抗体,6000+例样本量。

参考资料:
[1] FDA Approves New Monotherapy Indication for Merck’s KEYTRUDA®(pembrolizumab). Retrieved 2019-07-31, from https://investors.merck.com/news/press-release-details/2019/FDA-Approves-New-Monotherapy-Indication-for-Mercks-KEYTRUDA-pembrolizumab/default.aspx
推荐阅读 聚焦 | 说说PD-L1免疫组化检测
聚焦 | 说说PD-L1免疫组化检测

溯癌症之源 至诊疗之本
至本医疗科技(上海)有限公司专注于国际高新技术研发及在肿瘤领域的临床应用转化,公司总部位于上海浦江高科技园区,在上海、深圳、济南、福州等地设立有分公司和医学检验所,总面积12000平米。至本医疗科技拥有经过严格验证“溯”“源”“至”“本”四大系列产品,独家开发了精准治疗数据共享和随访APP-土拨鼠博士,服务网络覆盖全国五大区域400多家核心医院。
至本使命:致力于推进数百个癌症基因的临床检测,为每一个患者提供准确的分子水平信息,辅助医生的精准治疗,推动中国癌症患者临床治疗方式的革新。

知识产权:在生信算法、知识库建设、流程一体化等方面拥有28项软件著作权,12项专利。
学术成果:2017年至今,至本与国内外专家合作发表SCI论文/国际会议报道100+篇。
至本黑科技:至本OriFusion算法 (融合) /至本OriLongIndel算法(大片段插入/缺失) /至本免疫双向多模块分析体系(OriTMB/OriMSI/OriRNA),三大核心算法均已获得国内首个专利。
至本资质:美国“登月计划”癌症基因蛋白组学中国研究中心生信分析团队(国内唯一)、美国病理学家协会(CAP)官方认证、美国联邦医疗保险和医疗救助服务中心颁发的美国临床实验室改进法案修正案(CLIA)认证、国家高新技术企业、CSCO团体会员、满分通过国内外多项肿瘤高通量测序室间质评。








 FDA批准Keytruda作为首个治疗复发性局部晚期或转移性食管鳞状细胞癌的PD-1疗法,适用条件为CPS≥10。Keytruda在多种癌症适应症上取得进展,CPS是评估免疫治疗响应的重要指标,不同于只考虑肿瘤细胞的TPS,CPS还包括与肿瘤细胞关联的免疫细胞。
FDA批准Keytruda作为首个治疗复发性局部晚期或转移性食管鳞状细胞癌的PD-1疗法,适用条件为CPS≥10。Keytruda在多种癌症适应症上取得进展,CPS是评估免疫治疗响应的重要指标,不同于只考虑肿瘤细胞的TPS,CPS还包括与肿瘤细胞关联的免疫细胞。

















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








