脉冲检测基因电路——一种新的设计方法
摘要
一种鲁棒的细胞计数器可以使合成生物学家设计出具有多样化行为的复杂电路。现有的合成生物计数器对脉冲的起始有响应,但对脉冲持续时间较为敏感。本文提出了一种仅在脉冲下降沿响应的脉冲检测电路——类似于负边沿触发的电路。由于生物事件并不遵循精确的时间规律,使用此类脉冲检测器可实现鲁棒异步计数器的设计,从而计数事件的完成次数。该基于转录的脉冲检测电路依赖于两种共表达的λ样噬菌体衍生蛋白之间的相互作用:第一种蛋白不稳定,可抑制第二种稳定蛋白的调控活性。在脉冲结束时,不稳定的抑制蛋白从细胞中消失,第二类蛋白随即触发事件完成的记录。通过随机模拟,我们证明了所提 出的设计能够不受脉冲持续时间影响地检测脉冲的结束。在仿真中,我们还表明,将该脉冲检测器与λ噬菌体记忆元件融合,即可构建一个可扩展以计数更大数值的计数器。该设计原理为合成生物学提供了一种新的控制机制,可集成于不同电路中用于识别事件的完成。
引言
合成生物学借鉴了工程学和分子生物学的基本原理,并将这些原理应用于基因元件的 设计、测试、验证以及组装成更大的系统[1]。在过去的15年中,合成生物学研究人员 设计了大量合成基因电路,且电路复杂性不断增加的趋势似乎将持续下去[2]。电路的 设计原理已被应用于许多合成基因电路的构建之中,并为其提供了灵感[3,4, 5, 6]。与 电路类似,存储器是生物系统中的一个基本功能单元,用于记录接收到的刺激,并根 据已记录的经历引导细胞命运向不同方向发展。因此,人们已采用多种设计方法来实 现对细胞内生物事件的记录,并在之后对记录进行检测[4, 7, 8]。
计数器是另一种用于跟踪事件的基本器件,广泛应用于构建各种复杂的电路。野 生生物中存在计数机制已有文献记载[9, 10]。借助可靠的细胞计数器,合成生物学家 可以根据事件的发生设计新颖的控制机制和应用。目前已成功构建了一些电路[11, 12]。
计数器的设计依赖于存储器,单个存储单元即可作为能够计数单个事件的计数器。这 种单计数器可通过级联方式实现大于一的计数,但要计较高的数值将具有挑战性,因 为所需的正交系统数量会随着我们想要计数的最大数值线性增加。解决这一难题的一 种方法是使用置位‐复位存储器件,正如苏孙通和恩迪所展示的那样[12]。
设计鲁棒性生物计数器的另一个潜在挑战是能够在事件结束时进行计数。现有的 计数器设计对脉冲持续时间敏感——短暂的脉冲将被忽略,而长时间的脉冲可能导致 计数器提前计数[11]。如果我们能够设计一种在脉冲结束时才增加计数的计数器,就可 以避免这一问题,这类似于电子计数器设计中的常见做法[13]。此类设计的关键组件 是一种仅在脉冲刺激的下降沿响应的脉冲检测电路。使用这样的脉冲检测器将使计数 器对脉冲持续时间具有鲁棒性。
在这项工作中,我们提出了一种基于λ CI阻遏蛋白的鲁棒性遗传脉冲检测器设计 [14]。通过在触发脉冲完成之前阻止CI蛋白的二聚化,我们可识别事件的结束,随后 形成的二聚体CI蛋白将激活报告电路。在仿真中,我们对该脉冲检测装置进行了测试 和表征,以确定其工作极限。我们通过将该脉冲检测电路与基于λ开关的存储器相结 合,设计了一个可扩展的单计数器[7]。通过详细的化学建模和随机模拟,我们证明了 所提出的鲁棒性脉冲检测器在实际的生物学参数下可以正常工作,并可用于设计基于 下降沿触发的遗传计数器。
一种用于脉冲检测的新设计控制方法
原则上,可以使用负边沿触发(NET)和正边沿触发(PET)来设计异步计数器。然 而,在电子学中,大多数异步计数器采用NET设计,因为它使得触发器之间的连接更 加容易,特别是在前一级信号从高电平变为低电平时,对应的触发器需要改变状态。
使用NET设计计数器的另一个优点是,它能够对事件进行计数,而与事件的持续时间 及频率无关。弗里德兰等人[11]提出的计数器设计类似于数字系统中的同步计数器, 仅对具有特定持续时间的脉冲作出正确响应。相比之下,[12]中描述的计数器设计对 应于异步计数器。一种仅在脉冲的下降沿触发的脉冲检测电路将有助于异步计数器的 设计,并可用于设计许多其他基因电路。
我们设计了一种脉冲检测电路,利用λ CI阻遏蛋白的独特特性,来探讨基于转录 的生物负边沿检测器的设计考虑。λ噬菌体具有一套复杂的相互关联的调控机制,用 于维持溶源状态并转换到裂解状态[14, 15]。在溶源状态下,λ基因组整合在宿主细胞 的染色体中,并随着细胞分裂而复制。当接收到DNA损伤信号时,λ噬菌体退出稳定 的溶源状态,进入裂解状态,在此状态下噬菌体裂解细胞,产生大量新的噬菌体颗粒 [14]。λ基因组中的一个调控模块,通常称为λ开关,介导这一决策过程,其组成包括: cI和cro基因,以及两个启动子(P RM 以及分别转录 和 的启动子)和三个操纵子(OR1、OR2和OR3)位于OR区[15]; OR区的三个操纵子增强了系统对 的协同性,并使得系统能够从CI富集状态迅速 切换至cro富集状态[16]。
CI和Cro蛋白以不同的亲和力结合到三个操作子上,并调控cI和cro基因的转录。 当OR1和OR2均未被占据时,RNA聚合酶可以转录cro 基因;类似地,当OR3未被占据 时,cI基因即可被转录。CI蛋白在结合OR2时可增强PRM启动子的转录。当CI水平超过 一定阈值时,PRM启动子被关闭,从而维持CI蛋白处于中等水平。这种双重负反馈机 制以及CI提供的正反馈共同控制两个基因(cI和cro)中仅有一个表达,同时抑制另一 个,从而使λ噬菌体维持其溶源状态并切换至裂解状态[17]。这些特性使得Kotula等人 [8]能够构建一种基于从CI状态切换到Cro状态的记忆元件。这些作者还注意到,在所 测试的条件下,Cro状态非常稳定。因此,从Cro状态切换到CI状态也可用于记录事 件;这正是本文所采用的方法。
CI和Cro蛋白的一个特征(对我们设计很重要)是,它们仅以二聚体和高阶多聚 体形式结合到OR操作子位点;单体没有活性。因此,可通过阻止CI和Cro蛋白的二聚 体形成来控制PR和PRM启动子的激活与抑制。这是我们在此提出的基因装置的一个关 键要素。在关于λ阻遏蛋白CI与操纵基因及非操纵基因DNA结合的研究中,Nelson和 Sauer分离出一种CI阻遏蛋白突变体,其DNA结合表面发生突变Asn55Lys(N55K), 该突变消除了CI‐突变体与操纵基因位点的结合亲和力,但增加了其与非特异性D NA结合位点的亲和力[18]。我们最近证明,CI(N55K)可作为CI蛋白自身的显性负 性抑制剂[19],,可能是通过形成杂合二聚体,类似于tet和lac阻遏蛋白中所观察到的 现象[20]。这种突变应不影响蛋白质的二聚化特性。我们将这种蛋白称为显性负性 CI(CIDN),用于阻断CI蛋白的二聚体形成。通过与显性负性伴侣复合来抑制转录因 子的活性,此前已被证明是有用的[21]。另一种可用于阻断λCI蛋白活性的蛋白是 P22抗阻遏蛋白,它似乎能够使多种λ样噬菌体阻遏蛋白失活[22]。

脉冲检测电路的结构如图1(A)所示,假设该电路位于大肠杆菌中。我们将野生型 cI和cIDN置于同一个诱导型启动子的控制之下。在cIDN上添加了一个降解标签,以确 保单体蛋白能够快速降解。一个明显的诱导型启动子候选是四环素抗性启动子P TetA[23]。cIDN需要比cI更强的核糖体结合位点(RBS1),而cI使用较弱的RBS( RBS2)。实验中可以使用诸如lacZ基因作为报告基因,并由PRM启动子控制。该系统 的工作原理如下:当PTetA 被诱导(即脉冲期间)时,CIDN 和CI转录本被产生。由于 与CI DN 相关的RBS更强,细胞中CI DN 分子的数量远多于CI分子。因此,几乎所有的 CI单体都将与CI DN 形成异源二聚体,导致没有足够的CI 2 来激活P RM 启动子。在诱导 期结束后,由于降解标签的存在,CI DN 分子迅速降解,从而使CI分子有机会形成二聚 体并激活P RM 启动子。图1(B)解释了脉冲检测电路的输入输出关系。
在我们的随机模拟中,我们分析了脉冲检测电路,以确定模型参数(例如RBS位 点的相对强度、降解标签效率)的取值范围,使得电路能够产生期望的行为。在成功 完成模型验证后,我们将脉冲计数器与λ噬菌体记忆元件结合,构建了一个单计数器。 电路。仿真结果表明,当核糖体结合位点强度等参数处于合适范围时,所设计的电 路能够计数事件完成,并且可以扩展以计数更大的数字。
结果与讨论
RBS位点的相对强度
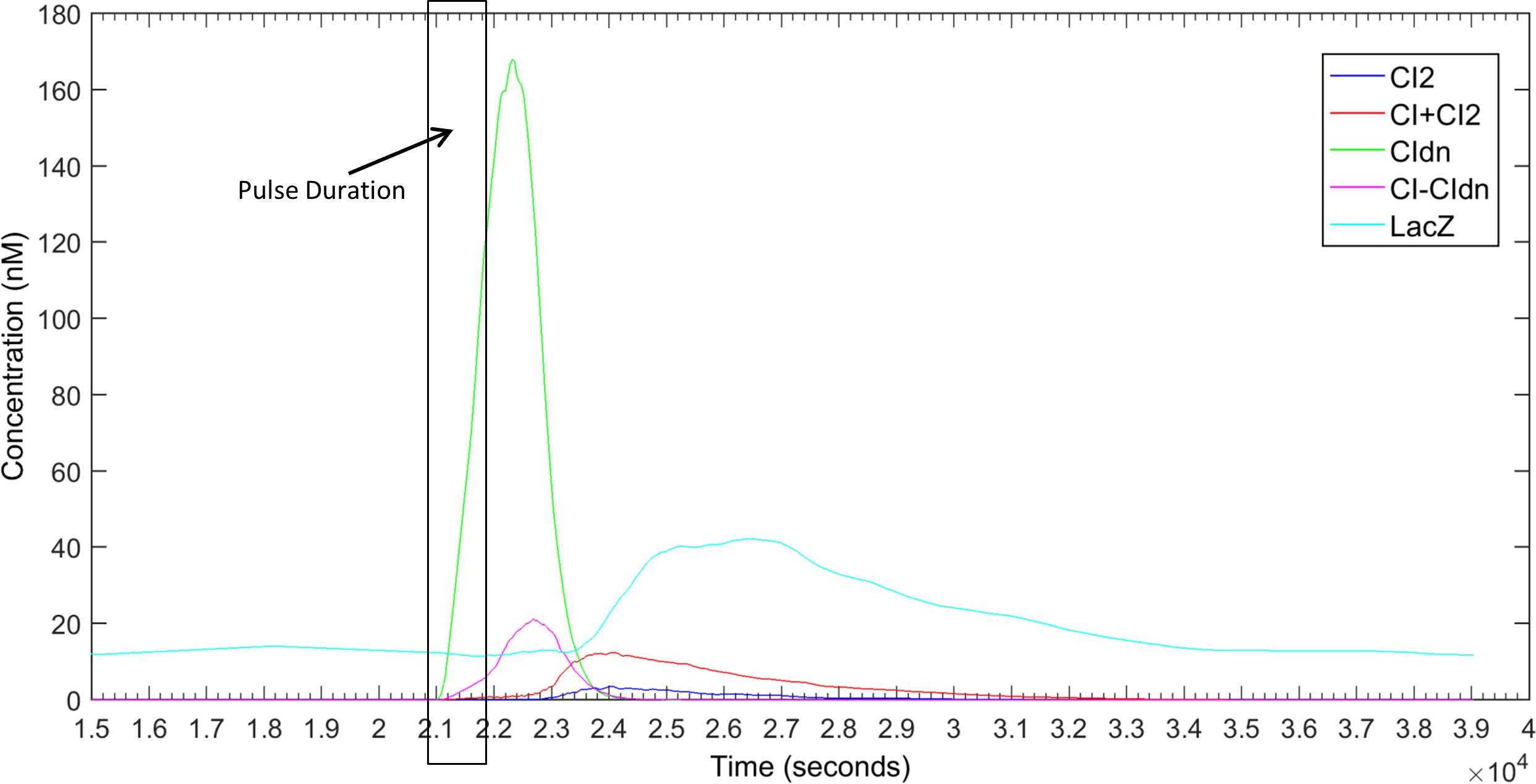
为了防止CI蛋白激活PRM启动子,我们需要阻断野生型CI蛋白的同源二聚化。在我们 的设计中,计划产生足够的CIDN蛋白,使得所有野生型CI蛋白都与CIDN形成异源二 聚体而非同源二聚体。由于野生型和显性类型的cI基因均从同一启动子PTetA转录,实 现这一目标的最佳方法是为cI和cIDN基因使用具有不同强度的RBS位点。根据我们的 理论计算,发现cIDN的RBS(RBS1)应至少比cI的RBS(RBS2)强10倍。为了验证 这一点,我们测试了多种RBS1:RBS2强度比下的模型。结果表明,当RBS1与RBS2的 强度比达到20:1或更高时,可以完全阻止CI蛋白的二聚体形成,从而确保报告基因 lacZ仅在脉冲结束后才被激活。图2展示了RBS1:RBS2= 20:1条件下脉冲检测电路的仿 真结果。如图所示,CIDN分子的丰度保证了不会形成能够激活PRM启动子的CI2二聚 体。脉冲结束后,连接在cIDN上的降解标签会迅速将CI DN 蛋白分子从细胞中清除,从 而使CI蛋白能够形成同源二聚体并触发报告电路。在模拟中,我们将RBS1:RBS2比率 从2变化到25,发现若该比率小于20,则脉冲检测可能无法精确工作。例如, RBS1:RBS2= 10的结果见S1图。我们可以看到,当RBS1:RBS2小于20时,在脉冲结 束前系统中已存在部分CI 2 ,因此报告电路可能会提前开始响应。这种效应在较长脉 冲持续时间下更为明显,这将在后文讨论。为了直接比较RBS强度比的影响,我们将 所有LacZ响应及相应的CI 2 浓度变化汇总于S2图中。从这些响应

曲线可以明显看出,如果RBS1:RBS2比例小于20,则cI2浓度在脉冲结束前就开始上 升,报告电路随之开始响应。
与cI蛋白相关的降解标签的影响
设计中的第二个重要挑战是在脉冲结束后快速将cIDN从细胞中清除,以便在细胞内 有足够的CI浓度来诱导报告电路。显然,在cIDN上添加降解标签是一种可行的解决方 案。然而,需要注意的是,连接降解标签也会影响脉冲期间CIDN的浓度。因此,我 们需要选择一个合适的降解标签,使得在脉冲期间有足够高的CIDN浓度以防止CI二 聚体形成,而在脉冲结束后CI2分子能迅速从系统中被清除。为此,我们尝试了不同 强度的多种降解标签。我们运行了具有半衰期为2、4、8和16分钟降解标签的模拟。 结果如图3所示。从图3可以看出,如果降解标签过强(例如半衰期2分钟),则CI分 子会在脉冲结束前就开始形成二聚体;而如果标签过弱(例如半衰期16分钟),则 CI DN 在脉冲结束后仍长期存在于细胞中,从而阻碍CI二聚体的形成,无法激活报告 电路。具有4分钟半衰期的降解标签与RBS1:RBS2= 20比例配合良好,可在脉冲期间 维持足够高的CI DN 浓度以防止CI二聚体形成,并在脉冲结束后迅速将CI 2 从细胞中清 除,从而激活报告电路。S3图 显示,4分钟降解标签与RBS1:RBS2比例为20或更高 的组合,对于构建有效的脉冲检测电路模型是可行的。


脉冲长度的影响
所提出的脉冲检测器的另一个重要特性是其对脉冲持续时间不敏感。由于该电路在脉冲的下降沿产生响应,因此不受脉冲长度的影响。为了验证所设计电路的这一能力,我们使用不同脉冲持续时间对该电路进行了仿真,具体采用了1.0 CC(细胞周期)和1.5 CC的脉冲。图4显示RBS1:RBS2比例为20且带有4分钟降解标签的脉冲检测电路的响应。尽管脉冲持续时间加倍(图4(A))和三倍(图4(B)),在整个脉冲期间细胞中均未出现显著水平的cI蛋白2来激活lacZ报告基因。因此,lacZ仅在脉冲结束后才产生响应,使得该电路对脉冲持续时间不敏感。我们还系统研究了不同RBS1:RBS2比率以及降解标签强度对这两种脉冲长度的影响,相关结果总结于S4和S5图中。观察结果与我们此前在脉冲持续时间为1⁄2 细胞周期时的结果类似——若电路设计采用RBS1:RBS2比例为20或更高,并使用半衰期为4分钟的降解标签,则无论脉冲持续时间如何,该电路都将表现为一个理想的脉冲检测电路。
嵌入脉冲检测器的计数电路设计
在确认脉冲检测电路的可靠性后,我们将一个λ存储器电路与其融合,以设计一种合成计数器。λ开关的双稳态特性使其成为一种可靠的存储装置,用于记录脉冲完成后的计数值。计数电路的整体设计如图5所示。初始状态下,λ存储器处于Cro富集状态,并保持该状态,直到脉冲完成后被切换至CI富集状态。当脉冲开始时(通过诱导PTetA启动子进行模拟),cIDN和cI的mRNA均被转录。由于RBS1较强,从cIDNmRNA翻译出足量的cI蛋白,这些蛋白与CI单体形成CI‐CI二聚体,阻止CI形成CI2并激活PRM启动子。当脉冲结束时,cIDN和cI的转录停止,且附着的降解标签导致CIDN迅速从细胞中被清除,从而使CI分子得以形成二聚体。CI二聚体与PRM启动子相互作用,将存储器从Cro富集状态切换至CI富集状态。一旦存储器转换为CI富集状态,λ开关的反馈回路便会维持该状态,从而记录下脉冲的完成。
然而,要从Cro富集状态切换到CI富集状态,细胞内需要存在足够数量的cI二聚体。根据一些模拟结果,从Cro富集状态切换到CI富集状态大约需要 70~ 100nM的cI。如前文所述,为了设计出有效的脉冲,RBS1与RBS2之间的强度比需要为20或更高。

检测电路。考虑到这一点,我们尝试了不同强度的RBS1和RBS2,使其比率达到25。我们在四种条件下运行模拟,即[RBS1, RBS2]=[25x, 1x],[50x, 2x],[100x, 4x]和[200x, 8x]其中25x表示该RBS的强度是野生型cIRBS强度的25倍。在每种情况下,我们都使用了半衰期为4分钟的降解标签。每次模拟运行20次,结果汇总如图6所示。根据此模拟结果,如果我们连接到cI的RBS强8倍,并且连接到cIDN的RBS比前者强25倍,则我们将能够利用脉冲检测电路和λ记忆电路设计出可靠的计数电路。
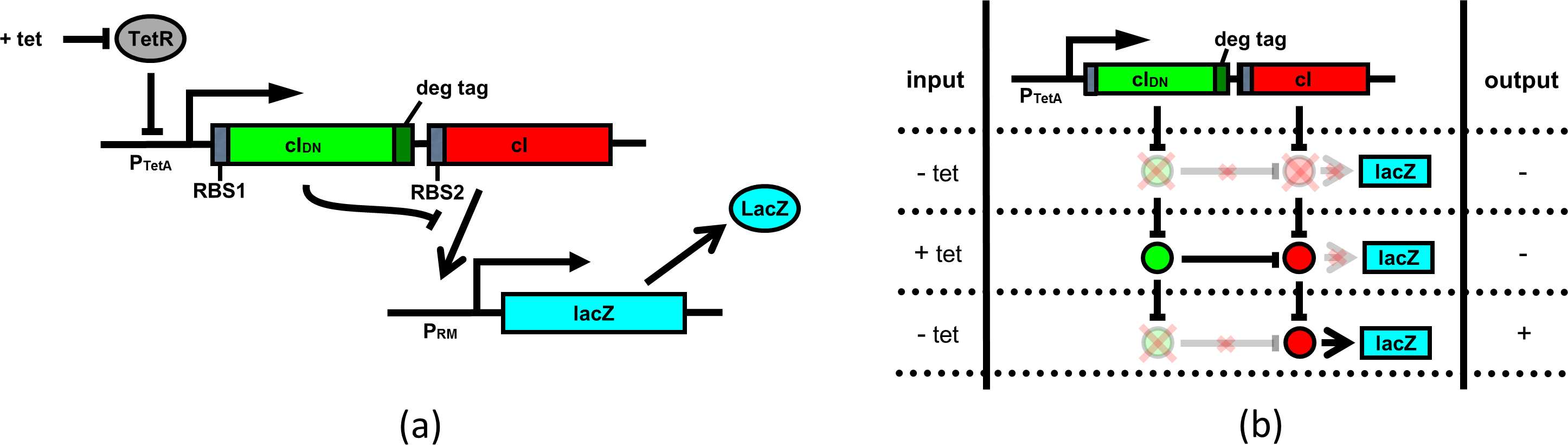
图7 显示了在以下设置下该电路的平均模拟。在此设置下,20次运行中有20次,电路成功地从Cro富集状态切换到CI富集状态。这也证明了计数电路的鲁棒性。
在仿真中,我们已经证明,使用设计的脉冲检测电路结合λ存储器开关可以构建一个计数电路。然而,使用λ开关会带来额外的要求,因为λ的Cro富集状态非常稳定,将其切换到CI富集状态需要系统中存在大量的cI蛋白。因此,我们需要为cI和cIDN基因使用非常强的核糖体结合位点,以便每条转录本能够产生足够的蛋白质。或者,我们可以使用具有更高异构化速率的启动子来替代PTetA。我们还可以考虑稳定cI和cIDN mRNA。此外,也可以改变λ开关中的OR区,使从Cro富集状态向CI富集状态的转换更容易。因此,可以通过采用这些策略之一或综合应用这些策略来构建计数电路。
此外,为了展示计数电路对脉冲持续时间的稳健行为,我们尝试了各种脉冲持续时间——特别是将脉冲从1个细胞周期、2.5个细胞周期、5个细胞周期和10个细胞周期进行变化,其中1个细胞周期表示34分钟的细菌细胞周期。我们对每种设置重复模拟20次。在每次实验中,该计数电路表现出非常稳健的行为,能够成功地对每个脉冲进行计数,而与脉冲持续时间无关。此1位脉冲计数器电路在不同脉冲持续时间下的平均模拟结果如S6图所示。
然而,当脉冲持续时间设置为0.5个细胞周期时,在20次运行中有7次电路未能切换到CI富集状态或切换回Cro富集状态。这些结果表明,如果脉冲持续时间非常短,则当前电路无法响应,但有可能基于相同原理通过改变系统参数来设计一种能够计数更短脉冲的计数电路。本节中的模拟表明,所设计的计数电路能够对任何大于最小限制的脉冲持续时间进行计数。
借助脉冲检测电路设计的计数电路可以级联,用于构建能够计数更大数值的计数器。图8展示了一个利用FLP‐FRT重组的双计数电路。当电路切换到CI富集状态(即计数一次后),翻转酶1从PRM启动子与黄色荧光蛋白和cI蛋白一同被转录。随后,翻转酶1可移除终止子,使PTetA启动子能够转录来自434的CI蛋白和抗CI蛋白。接着,抗434CI和434CI蛋白的行为类似于CI和CIDN,通过与相应启动子相互作用,将434Cro状态切换为434CI状态。如图8所示,还可以添加另一个FLP‐FRT对(翻转酶2)以实现后续计数。此外,脉冲检测电路响应脉冲下降沿的能力将使我们能够设计异步计数器以及许多其他有用的合成电路。
结论
本研究提出了一种基于两种蛋白质相互作用的合成电路,用于检测脉冲的下降沿。该设计的基本原理是通过一个诱导型启动子共同表达两种蛋白质,其中一种蛋白质会干扰另一种蛋白质的活性,从而阻止第二种蛋白质发挥其正常功能。第一种蛋白质还带有降解标签,因此当诱导减弱时,它将迅速从细胞中被降解,从而使第二种蛋白质恢复其原有活性。在我们的设计中,使用了λCI蛋白及其一种突变体(称为CIDN)来进行脉冲设计。

检测电路。CI与CI之间的相互作用已在实验室实验中得到表征,并发现CI对CI的抑制以剂量依赖性方式发生DN DN。[19]通过随机模拟,我们表明,通过选择与cI和cIDN相关的RBS位点以及连接到cIDN的降解标签,我们可以构建一种对脉冲持续时间具有稳健性的脉冲检测电路。由于生物事件的时间并不精确,能够不受脉冲持续时间影响而工作的脉冲检测电路将对合成生物学家极具吸引力。将脉冲检测器与λ记忆电路融合后,我们构建了一个可计数事件完成次数的计数器。在我们的仿真中,该计数器表现出稳健行为。该设计具有足够的通用性,可扩展用于构建能够计数更高数值的计数器。此外,脉冲检测电路还可用于设计异步生物计数器。
所提出的設計是一種用於合成生物學的新型控制機制。該設計原則可用於許多其 他檢測事件完成的電路。大部分設計驗證工作已在仿真中完成,但基於模型的設計此 前已應用於設計過的合成電路(例如翻轉開關、抑制子振蕩器)。然而,模型產生的 結果只有在調整電路後才能在實驗中成功重現。儘管隨機模型相比確定性模型(例如 基於微分方程的模型)更能準確表示生物系統,但預計在實驗實現時仍需對模型進行 一些調整[2]。因此,
设计的脉冲检测电路可以在体内构建,也许需要一些必要的调整,并可作为合成生物学中有价值的组成部分。
方法
我们使用基于反应的模型来仿真电路的不同组件。每个模型都包含一组化学反应,我们采用吉莱斯皮算法[24]对每个模型进行随机模拟。不同模型的基本组件包括:cI和Cro蛋白的同源二聚化以及CI‐CIDN蛋白的异源二聚化,cI2和Cro2二聚体与OR操作子位点(OR1、OR2和OR3)的结合,RNA聚合酶与PRM、PR和PTetA启动子的结合,不同启动子的异构化,从相应启动子转录cI和cIDN、cro以及lacZ,并根据相应的RBS位点进行这些转录本的翻译,以及mRNA分子和蛋白质单体及二聚体根据其半衰期或所连接的降解标签半衰期进行的降解。
所有模型参数均使用生物化学数据设定。大多数参数来自莫雷利等人对λ开关的模型。[25]tet启动子的参数来自[26]。包含化学反应和参数的模型细节已添加至文件S1。




















 507
507

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








