日本患者中直接口服抗凝药的有效性与安全性评估—— 药品和医疗器械管理局数据分析
引言
近年来,直接口服抗凝药(DOACs)的问世为心房颤动(AF)患者卒中预防提供了华法林之外的新治疗选择。在过去5年中,日本已批准两种不同类型的DOACs用于非瓣膜性房颤(NVAF)患者预防栓塞性卒中:口服直接凝血酶抑制剂(DTI;例如达比加群)和口服Xa因子抑制剂(FXa;例如利伐沙班、阿哌沙班和依度沙班)。
尽管大规模临床研究已显示,在出血性方面,直接口服抗凝药相较于华法林具有优势并发症,1-4随着这些药物的日益广泛使用,已有关于与直接口服抗凝药相关的出血性和缺血性并发症的若干病例报道。5,6根据麦克唐纳等人的报告,与直接口服抗凝药相关的自发报告不良事件中有30%‐35%与出血有关。7,8然而,关于直接口服抗凝药在患者中的真实世界比较有效性和安全性,目前了解甚少。关于日本患者直接口服抗凝药的安全性数据,例如出血性并发症,也较为缺乏。9
关于DTI和FXa在安全性和有效性方面的差异经常被讨论,且该问题仍存在争议。10
在日本,药品的上市后监测(PMS)依赖于向药品和医疗器械管理局(PMDA)自发报告药品不良事件,PMDA是日本于2004年4月1日成立的监管机构,与厚生劳动省合作开展工作。11 PMDA在上市后阶段检测到药品不良反应病例时,会从上市许可持有人和医疗机构收集有关药品质量、有效性和安全性的信息。自2004年4月1日起,他们还通过PMDA网站提供制药企业或医疗专业人员报告的所有药品不良反应病例的信息。
制药企业有义务报告不良事件,而医疗专业人员和消费者则被建议但非强制性地报告不良事件。
本研究旨在利用日本PMDA自发报告的药品不良事件电子数据库,确定两种形式的直接口服抗凝药(DOACs)—— DTI和口服Xa因子抑制剂——在真实世界中与脑血管事件相关的风险。
材料与方法
数据来源
本研究基于日本药品和医疗器械管理局(PMDA)收到的药品不良事件自发报告。我们检索了2014年1月1日至2014年12月31日期间,PMDA发布的关于接受直接口服抗凝药(DOACs)(包括达比加群、利伐沙班和阿哌沙班)治疗的患者出现药品不良反应的报告。
由于在日本针对非瓣膜性房颤患者以及由于非瓣膜性房颤导致的栓塞性中风患者的额外适应症获批仅过去数月,我们尚未收集有关依度沙班导致的脑血管不良事件的数据。
PMDA报告中包含了2014年与直接口服抗凝药相关的2127例不良事件。已确定将直接口服抗凝药视为潜在原因的每例cerebrovascular不良事件的PMDA报告。收集了有关年龄、性别、剂量、合并药物以及每位患者的脑血管不良事件类型(包括出血性和缺血性中风)被提取。
不良事件是指与人类使用药物相关的任何不良医学事件,无论是否被认为与药物有关(美国食品药品监督管理局(FDA)21 312.32 a 联邦法规)。FDA还建议,不良事件可源于药物的任何使用情况(例如超说明书使用、与其他药物联用),以及任何给药途径、剂型或剂量,包括过量用药。因此,本研究重点关注缺血性事件以及出血事件。
出血事件包括硬膜下(硬膜外)出血、脑内出血和蛛网膜下腔出血(SAH)。缺血事件包括栓塞性梗死、动脉粥样硬化性血栓性梗死(包括病因不明的缺血性卒中)、腔隙性卒中、短暂性脑缺血发作以及卒中类型不确定。不确定类型包括病因未知的卒中。
2014年,在已开具处方的直接凝血酶抑制剂(DTI)和Xa因子抑制剂(FXa)患者中,脑血管事件的粗年发病率(每10,000患者年中的事件数)计算如下:
=单个直接口服抗凝药报告的事件数量估计值已开具单个直接口服抗凝药处方的患者数量× 10 000,
我们将2014年报告的脑血管事件患者人数定义为2014年期间发生并报告给药品和医疗器械管理局的事件数量。
已开具处方的患者中,每种直接口服抗凝药的患者数量计算如下:
2014年各直接口服抗凝药的年销售额= 2014年各直接口服抗凝药的年成本iividual DOACs in2014
从2015年发布的各直接口服抗凝药(DOAC)国内销售收入年度报告中获取了2014年各直接口服抗凝药的年销售额和成本。12
岩手医科大学人类研究伦理委员会认为该研究无需伦理批准。
设计
这是一项回顾性观察研究。
统计分析
采用卡方检验进行比较。当P<.05时,认为结果具有统计学意义。所有分析均使用SPSS Statistics 20软件(SPSS Inc.,伊利诺伊州芝加哥)完成。
结果
在2014年向药品和医疗器械管理局报告的2127例不良事件中,提取出639例脑血管事件。由于违反用药剂量规定,排除了184例事件。全剂量定义为达比加群300 毫克/天、利伐沙班15 毫克/天、阿哌沙班10 毫克/天,低剂量则分别为220 毫克/天、10 毫克/天和5 毫克/天。接受其他剂量治疗的患者被排除在此研究之外。1-4最终,如图1所示,共提取了455例事件,这意味着2014年接受直接凝血酶抑制剂或Xa因子抑制剂全剂量或减量治疗的患者中,脑血管事件总数为:直接凝血酶抑制剂36例,Xa因子抑制剂419例(其中利伐沙班290例,129例为阿哌沙班)。表1 显示了使用直接口服抗凝药后发生脑血管事件的患者群体的信息。
直接凝血酶抑制剂与Xa因子抑制剂在脑血管事件方面的比较
直接凝血酶抑制剂与Xa因子抑制剂在出血性及缺血性事件发生频率上的比较
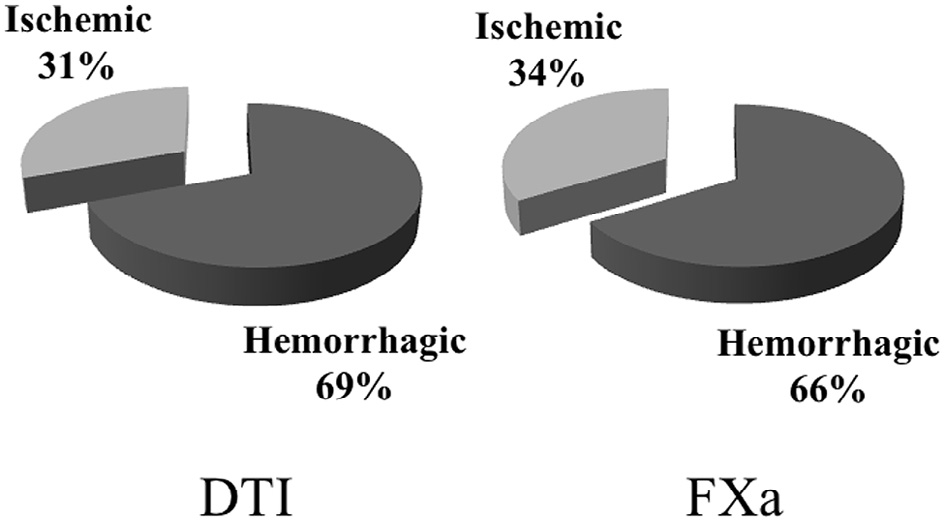
已开具处方的患者中,直接凝血酶抑制剂组和Xa因子抑制剂组的出血事件与缺血事件之比相似,且出血事件多于缺血事件(直接凝血酶抑制剂组为= 2.2,Xa因子抑制剂组为1.9)(图2)。图3显示了直接凝血酶抑制剂患者与Xa因子抑制剂患者之间出血事件与所有卒中事件之比。
直接凝血酶抑制剂组和Xa因子抑制剂组的各类出血事件发生频率不同。图4 显示了缺血事件与所有卒中事件之比在直接凝血酶抑制剂患者和Xa因子抑制剂患者。
缺血性事件的发生频率在直接凝血酶抑制剂和Xa因子抑制剂之间有所不同。
直接凝血酶抑制剂患者与Xa因子抑制剂患者出血事件类型的比较
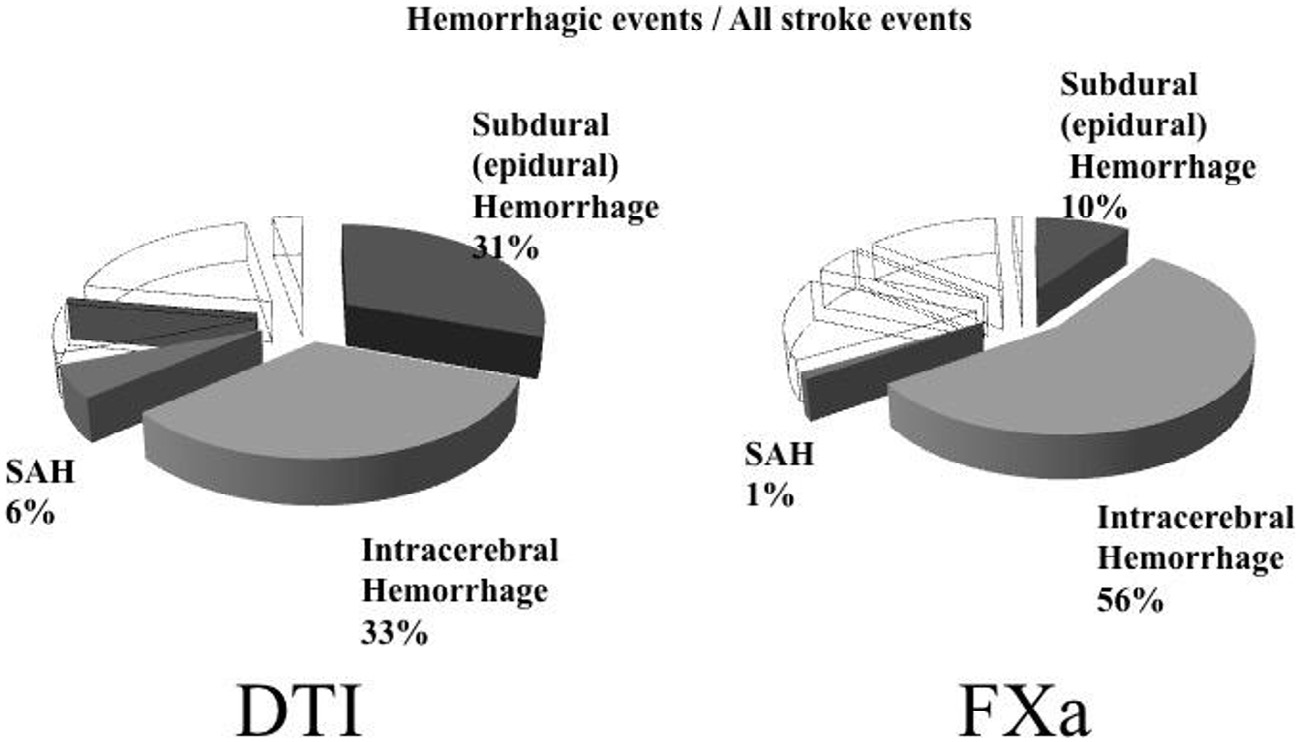
表2显示了包括硬膜下(硬膜外)出血、脑内出血在内的各种出血性事件的比例出血以及蛛网膜下腔出血在直接凝血酶抑制剂与Xa因子抑制剂组之间的总出血事件中的比例。报告的硬膜下(硬膜外)出血病例数在直接凝血酶抑制剂组(11例)和Xa因子抑制剂组(40例;P<.01)之间存在显著差异。
直接凝血酶抑制剂(DTI)导致的硬膜下(硬膜外)出血占总出血事件的比例(0.44)显著高于Xa因子抑制剂(FXa)(0.14,P<.01),而Xa因子抑制剂(FXa)导致的脑内出血占总出血事件的比例(0.84)显著高于直接凝血酶抑制剂(DTI)(0.48,P<.01)。
直接凝血酶抑制剂患者与Xa因子抑制剂患者缺血事件类型的比较
表3显示了直接凝血酶抑制剂组与Xa因子抑制剂组之间,包括栓塞性卒中、缺血性卒中、短暂性脑缺血发作和卒中类型不确定在内的各类缺血性事件占总缺血性事件的比例。
除DTI组未报告动脉粥样硬化性血栓事件外,各组中每种缺血性事件占总缺血性事件的比例在统计学上相似(图4)。


根据处方剂量(全剂量或低剂量)的直接凝血酶抑制剂和Xa因子抑制剂对患者脑血管事件的比较
尽管大多数患者可根据给药方案以固定标准剂量给予直接口服抗凝药,但在某些情况下,需根据各直接口服抗凝药的用药方案并结合肾功能进行剂量调整。1-4
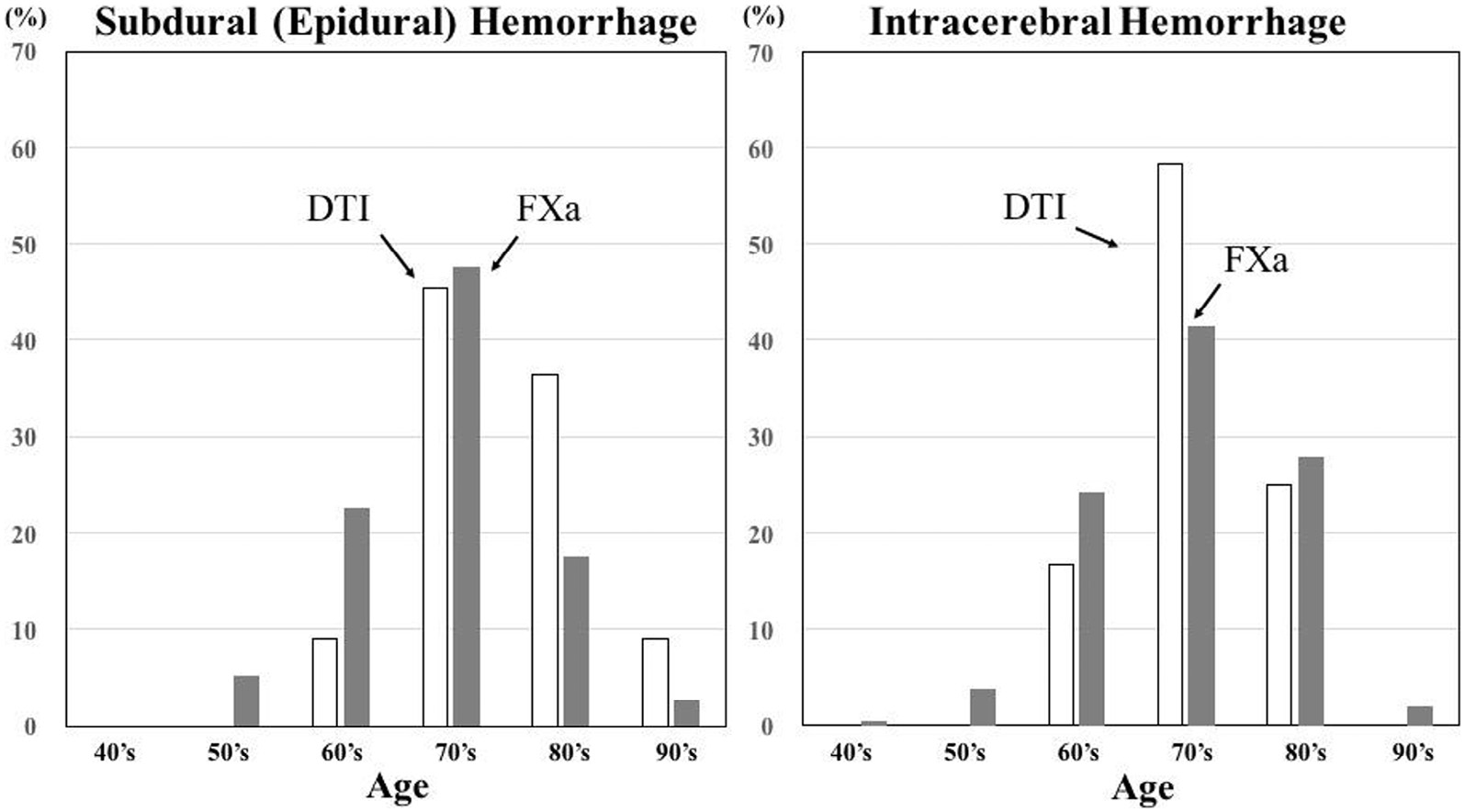
根据日本的上市后监测数据,2014年1月1日至12月31日间,共有488,544名初次使用直接口服抗凝药的非瓣膜性房颤患者和/或由于非瓣膜性房颤导致的栓塞性中风患者接受了DOAC治疗。其中,172,447名患者接受了达比加群(直接凝血酶抑制剂)治疗,316,097名患者接受了口服Xa因子抑制剂治疗(利伐沙班,226,106名;阿哌沙班,89,991名)。图5显示了接受直接凝血酶抑制剂和Xa因子抑制剂治疗的患者中发生硬膜下(硬膜外)出血和脑内出血的年龄分布。
图6显示了发生出血性和缺血性事件的患者中合并用药的情况。
从上市后监测数据中提取的接受全剂量或低剂量直接口服抗凝药治疗的患者数量如图7所示。
接受全剂量直接凝血酶抑制剂和Xa因子抑制剂治疗的患者中脑血管事件的比较(表2)
比较了接受全剂量直接凝血酶抑制剂或Xa因子抑制剂治疗的各组之间,包括硬膜下(硬膜外)出血、脑内出血和蛛网膜下腔出血在内的各种出血事件占出血事件总数的比例。
直接凝血酶抑制剂组的硬膜下(硬膜外)出血占总出血事件的比例(0.50)明显高于Xa因子抑制剂组(0.08;P<.01)。
在足剂量DTI组和FXa组之间,缺血事件占总缺血事件的比例没有差异,但动脉粥样硬化性血栓事件除外,该事件在DTI组中未观察到。
这些结果与接受总剂量(全剂量和低剂量)的患者中的结果相似。
低剂量直接凝血酶抑制剂与Xa因子抑制剂治疗患者脑血管事件的比较(表2和表3)
与接受全剂量的患者中的结果相似,直接凝血酶抑制剂(DTI)组硬膜下(硬膜外)出血占总出血事件的比例(.43)显著高于Xa因子抑制剂(FXa)组(.18;P<.01)。发生动脉粥样硬化性血栓事件的患者中,无人接受直接凝血酶抑制剂(DTI)治疗或曾接受低剂量直接凝血酶抑制剂(DTI)治疗。
基于上市后监测和药品和医疗器械管理局报告的脑血管事件发病率
根据上市后监测数据,2014年已开具处方的直接凝血酶抑制剂和Xa因子抑制剂的患者人数估计分别为172,447和316,097。脑血管事件的数量同期向药品和医疗器械管理局报告的已开具处方DTI和FXa的患者中,脑血管事件数量分别为36例和419例(图1)。2014年已开具处方DTI和FXa的患者中脑血管事件的粗年发生率(每10,000患者年事件数)见表4。如表5所示,FXa组硬膜下(硬膜外)出血和脑内出血的粗年发病率显著高于DTI组(分别为1.3和7.4例/10,000患者年,全剂量),而DTI组为0.6和0.7例/10,000患者年,全剂量,P<均小于0.01)。
FXa(全剂量,每10,000患者年分别为1.9例和0.7例)导致的栓塞性和动脉粥样硬化性血栓形成事件的发病率也显著高于DTI(全剂量,每10,000患者年分别为0.2例和0例,P<.01)。
讨论
多项研究已评估了直接口服抗凝药在“真实世界”人群中有效性和安全性。13-16本研究的优势在于,它是首份基于药品和医疗器械管理局数据,报告从2014年1月至2014年12月期间日本与直接口服抗凝药相关的脑血管事件的研究。
本研究的目的不仅是比较4种不同直接口服抗凝药(1种直接凝血酶抑制剂和3种Xa因子抑制剂)的效力,而且是检验这两种具有不同作用机制的直接口服抗凝药在真实世界中针对脑血管事件的有效性和安全性。
在现有的直接口服抗凝药中,达比加群是唯一一种作为直接凝血酶抑制剂和前体药物的口服抗凝剂,而其他药物(利伐沙班、阿哌沙班、依度沙班)则以活性形式作为Xa因子抑制剂发挥作用。
根据目前的结果,直接凝血酶抑制剂(DTI)和Xa因子抑制剂(FXa)在已开具处方的患者中出血性和缺血性事件的发生模式相似,两组患者中出血事件均多于缺血事件(DTI组:出血/缺血= 2.2;FXa组:出血/缺血= 1.9)。
大型临床试验与本研究之间出血事件与缺血事件比率差异的原因之一,可能源于医生们认为缺血事件并非单一类型重要不良反应之一。然而,迄今为止尚无研究报道在直接口服抗凝药之间进行直接比较时,大型临床试验与真实世界数据之间的差异。本研究首次描述了这种差异,尽管仍需进一步研究来深入解释这一现象。
关于本研究中DTI和Xa因子抑制剂低剂量组出血事件较高的原因,如图6所示,可能导致出血事件的合并用药(例如用于预防动脉粥样硬化性血栓事件的抗血小板药物)在低剂量组中使用较为频繁,同时用于预防脑血管事件的合并用药(包括降压药、他汀类药物和降糖药物)在使用低剂量直接口服抗凝药的患者中也较为常用。这可能表明,对于出血性和缺血性卒中高风险的患者,使用低剂量直接口服抗凝药可能导致出血性或缺血性事件较全剂量患者更多。此外,日本针对DTI(达比加群)发布的安全性警示(“蓝色通知”)可能促使医生在使用全剂量和低剂量DTI的患者中采取措施以减少脑血管事件。17
本研究另一个有趣的发现是出血性事件和缺血性事件类型的差异在已开具处方的直接凝血酶抑制剂(DTI)和Xa因子抑制剂(FXa)患者中观察到上述情况。我们的结果显示,使用DTI的患者和使用FXa的患者中,硬膜下(硬膜外)出血与脑内出血的比例分别为0.9和0.2,表明FXa的主要出血事件predominantly为脑内出血。
根据达比加群的RE-LY试验,硬膜下(硬膜外)出血与脑内出血的比例为1.0,表明硬膜下(硬膜外)出血和脑内出血的发生率几乎相同。1另一方面,利伐沙班的ROCKET-AF试验发现该比例为0.5。2本研究结果支持了这些试验的发现。
人们非常关注DOAC之间是否存在治疗差异,以及不良事件发生率的差异。本研究表明DTI和FXa之间可能存在差异。例如,据报道,与华法林相比,达比加群发生颅内出血(包括硬膜下、硬膜外和脑内出血)的风险显著更低(风险比为.34;95%置信区间为.26-0.46),而FXa(利伐沙班)的风险与华法林大致相当(风险比为1.17;95%置信区间为.66-2.05)。5
如图5所示,根据年龄分布,FXa组发生硬膜下(硬膜外)出血的患者较DTI组更年轻,表明FXa组中硬膜下(硬膜外)出血占主导地位与高龄无关。
尽管直接口服抗凝药在减少颅内出血发病率方面具有一致性,无论出血部位是在脑实质内还是外,6佐治等人发现直接凝血酶抑制剂组和Xa因子抑制剂(利伐沙班)组在脑内出血和硬膜下血肿发生率方面存在显著差异,9提示两种类型的直接口服抗凝药(即直接凝血酶抑制剂和Xa因子抑制剂)之间可能存在作用机制上的差异。6,18
本研究另一个显著发现是,服用直接凝血酶抑制剂的患者均未发生动脉粥样硬化性血栓性梗死,而服用Xa因子抑制剂的患者中有15%发生了动脉粥样硬化性血栓性梗死。
凝血酶会影响血管内皮的形态和通透性,并且是血小板活化和聚集的最强激动剂。19,20通过抑制凝血酶,血小板信号通路也被阻断,因此血小板功能可能受到影响。21
关于达比加群对血小板功能影响的数据仍局限于体外研究。另一方面,达比加群的抗血小板作用仍存在争议。22-25
Xa因子抑制剂的直接细胞效应也被认为在促进炎症、白细胞跨内皮迁移、血管生成和血管狭窄的过程中,对动脉粥样硬化斑块的发展起到一定作用。26
Xa因子抑制剂和凝血酶介导的细胞效应可能不同,尽管这两种蛋白酶均可与蛋白酶激活受体-1结合,并可能参与动脉粥样硬化等多种疾病的病理生理学过程。27-29关于达比加群的观察结果所涉及的机制仍不明确。
本研究中,DTI组和FXa组的出血性和缺血性事件的粗年发生率均低于以往任何报道,这可能是因为报告至药品和医疗器械管理局(PMDA)的病例数量低于实际数值所致。
然而,如果我们认为对两种直接口服抗凝药的数据收集是无偏见地同等进行的,表5显示Xa因子抑制剂的出血性和缺血性事件发病率高于直接凝血酶抑制剂。
研究局限性
本研究由于采用回顾性观察设计,无法对影响结果的变量进行调整。合并用药记录不充分,且存在大量数据缺失。
本研究结果源于对药品和医疗器械管理局报告中所谓真实世界数据的分析,这些数据可能存在许多与设计良好的随机对照试验或随机对照试验的荟萃分析不同的偏倚。
真实世界数据源自真实临床实践环境中异质性患者诊疗结局的相关数据。真实世界数据包括多种类型和形式,如理赔数据、临床试验数据、临床环境数据、药房数据和患者驱动数据。
本研究属于临床环境数据。真实世界数据提供的证据被视为一种更紧密地根据个体患者特征定制医疗决策的途径,从而在真实世界数据的收集标准和方法达到一定权威水平的情况下,推动医疗保健更加个性化和有效。
另一个在大多数自发性不良事件报告分析中常见的局限性是,我们没有获得研究期间直接口服抗凝药使用者确切数量的信息。因此,发病率可能被低估了。
PMDA的报告目前仍然是自愿的,患者和医疗专业人员无需强制报告。因此,由于事件收集不完整,报告事件可能少于实际数量。基于此,我们使用PMDA数据作为分子、PMS数据作为分母来计算粗年发病率。本研究中使用DOAC的患者出血性和缺血性事件的粗年发病率低于此前发表的任何“真实世界”报告中的数据。13-16
除这一问题外,DTI组的出血性和缺血性事件年发病率均显著低于FXa组。研究结果还提示,接受DTI和FXa治疗的组别之间在药物活性方面存在差异。
关于随着时间推移患者不良事件报告登记数量下降的风险始终存在,这可能会影响信息质量。药品和医疗器械管理局报告也不例外。然而,药品和医疗器械管理局是一个独特的国家机构,旨在彻底收集药品安全信息,以克服未来此类风险。我希望本研究能够鼓励药品和医疗器械管理局保持其积极性。
如果这些问题能够得到改进,药品和医疗器械管理局的报告可能会为患者和医疗专业人员提供一个极为重要的真实世界数据库。
结论
基于日本药品和医疗器械管理局(PMDA)的报告,对DOAC的安全性和有效性进行了测试。在发生颅内出血的患者中,服用Xa因子抑制剂的患者脑内出血的风险显著更高与使用直接凝血酶抑制剂(DTI)的患者相比,出血事件较少。在发生脑梗塞的患者中,使用DTI的患者均未发生动脉粥样硬化性血栓性梗死。目前的研究结果表明,DTI与Xa因子抑制剂在药物效应上可能存在差异,尤其是在出血性和缺血性脑血管事件方面。




















 1617
1617

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








