1974年,Albert Claude因其在细胞结构和亚细胞结构上的发现和研究获得诺贝尔奖。亚细胞结构是比细胞结构更细化的结构,一般在电子显微镜(EMs)下才能看见。它们的特点是在细胞内,功能和空间相互隔离,又共同协调维持完整的细胞功能。在一定范围内,亚细胞结构等同于细胞器,不过像细胞膜虽然可以叫亚细胞结构,但不是细胞器。每种亚细胞结构中都存在一组特定的蛋白质,亚细胞结构为这些蛋白质行使功能提供了相对独立的生命活动场所。想要了解更多亚细胞定位的知识,可详细阅读“亚细胞定位技术要不要来了解一下?”一文。
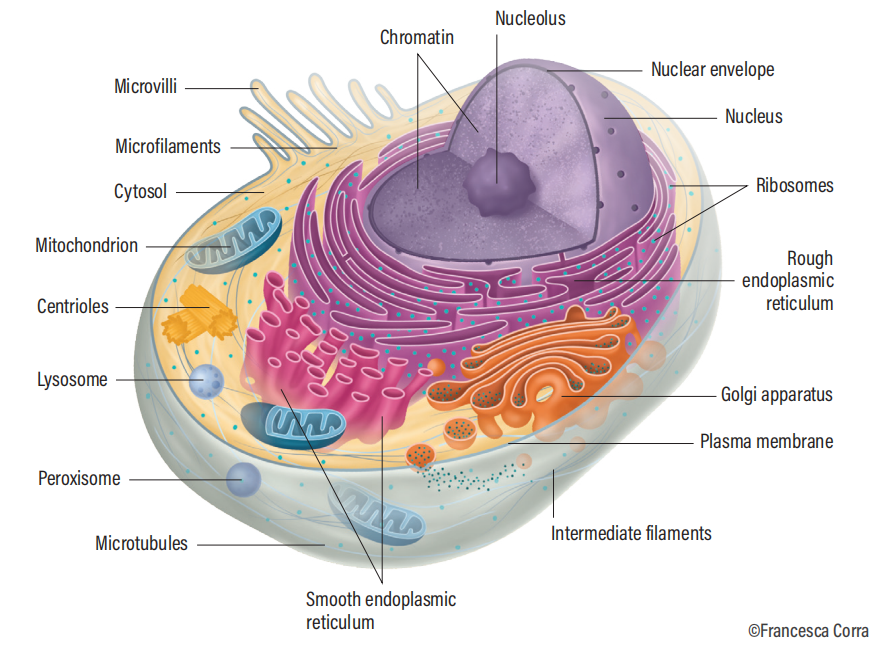
▲ 哺乳动物细胞的各细胞器(Davies K., 2020)。
那么,提起亚细胞结构,大家能想到的结构是不是就是上图这些被纳入教科书中的线粒体、内质网、高尔基体、溶酶体以及植物细胞的叶绿体、液泡呢?那么,你是否听说过迁移体(Migrasome)呢?接下来,伯小医将重点介绍迁移体的研究进展。
迁移体(Migrasomes)的发现
第一台电子显微镜原型——透射电子显微镜(TEM),由德国物理学家恩斯特·鲁斯卡(Ernst Ruska)和马克斯·诺尔(Max Knoll)于1931年发明。从那时起,科学家们开始更详细地观察细胞结构。1945年,Porter等人观察到可能与细胞回缩边缘有关的细丝以及从迁移细胞膜向外延伸的长管状结构——回缩纤维(RF),但后续却很少有人研究这种结构,直到2015年,清华大学俞立教授及其团队通过TEM发现了类石榴结构(PLSs),如图1所示。团队通过使用TEM观察到正常大鼠肾细胞(NRK)周围细胞外空间中存在椭圆形的膜结合囊泡结构,其中含有不同数量的囊泡,这些结构与细胞外围的距离变化很大,倾向于聚集在细胞的一侧(图1A)。并且这些结构与回缩纤维相连或紧密相关(图1B)。这些膜结构的直径为0.5μm至3μm,结构类似于“开口的石榴”,并且含有许多较小的囊泡,较小囊泡的数量差异很大,一些结构包含多达300个囊泡,而大多数结构包含少于10个囊泡(图1C、1D)。为了研究这些PLS与细胞的关系,团队进行了扫描电子显微镜(SEM)研究,观察到所有这些结构都附着在RF上(图1E)。PLS的发现,引起了俞立教授团队的研究热情,关于这一新细胞器的研究就此拉开了序幕。
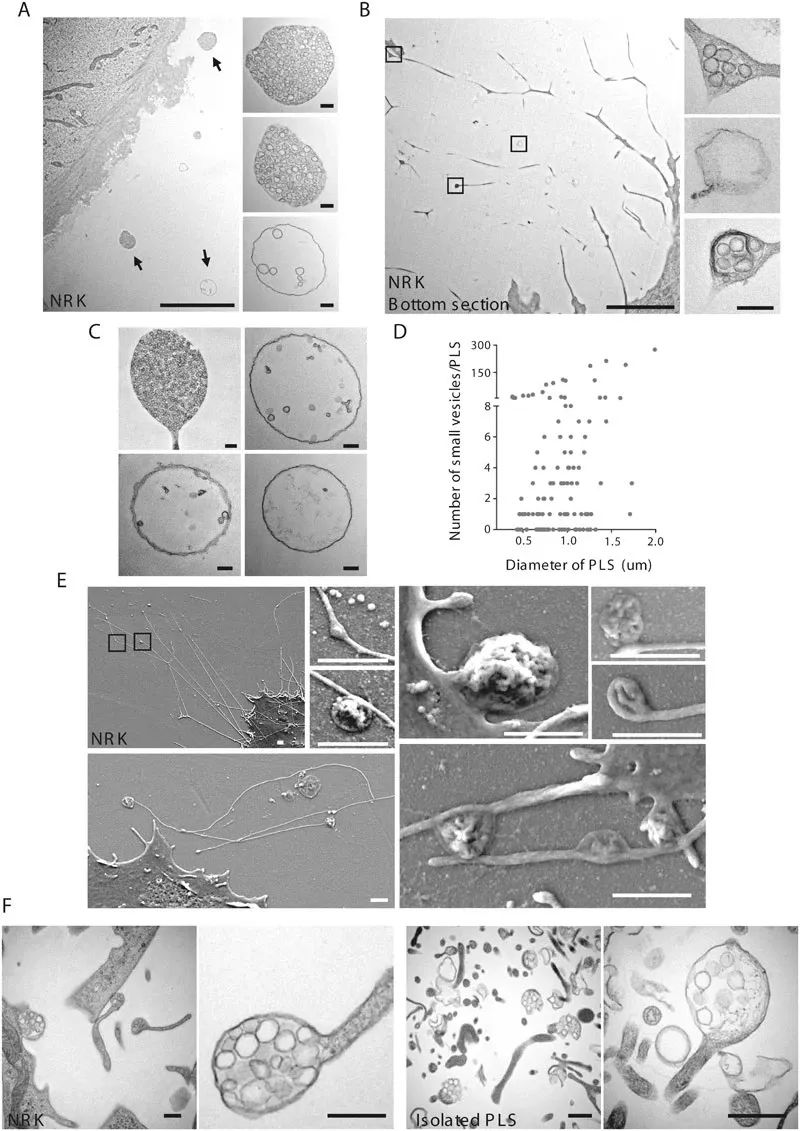
图1 通过TEM和SEM显示PLS的结构(Ma et al., 2015)。
迁移体的发现纯属偶然,为了识别PLS结构的标记,团队通过定量质谱分析,鉴定了其上富集的蛋白质,发现蛋白质的功能分布在细胞迁移、细胞基质粘附、脂质分解代谢过程、蛋白质糖基化和糖蛋白代谢过程等领域。在检测到的蛋白质中,发现四跨膜蛋白(TSPAN)家族成员高度富集。接下来,团队将TSPAN4确定为通过共聚焦显微镜可视化活细胞中PLS结构的标记物。结果发现,当细胞迁移时,它会在其尾部留下RF,在RF的尖端或分支点上形成直径约2µm的大囊泡(图2A)。并且确认了观察到的囊泡确实是TEM下观察到的PLS结构(图2B)。
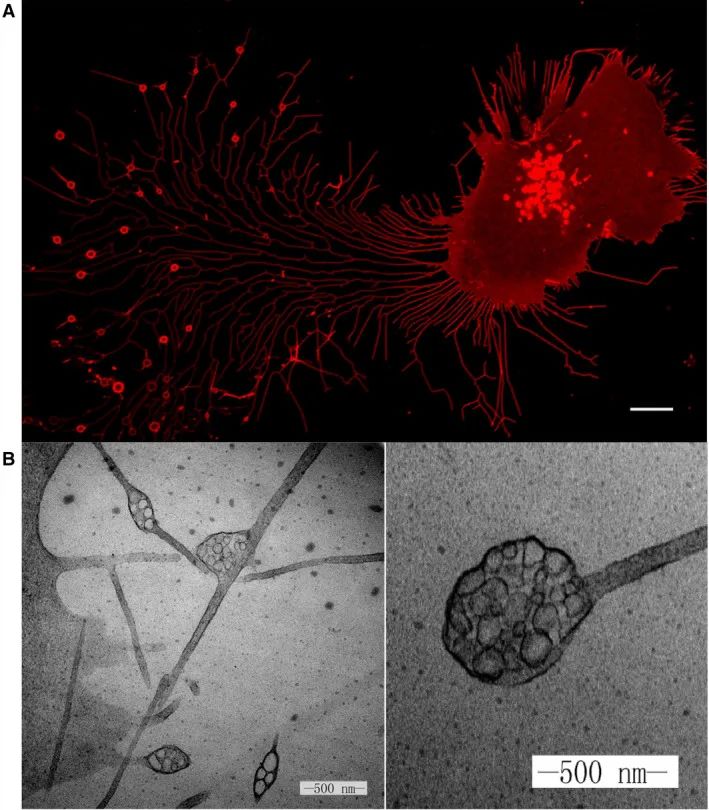
图2 共聚焦显微镜与TEM下的PLS结构(Yu S and Yu L., 2022)。
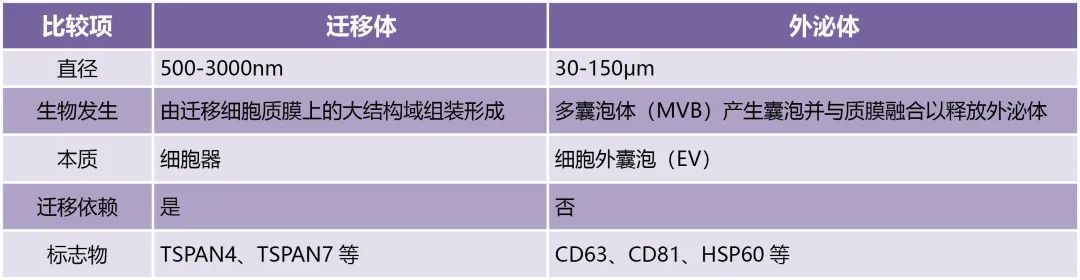
由于PLS的形成依赖于细胞迁移,因此PLS被正式命名为迁移体(Migrasome),在随机迁移过程中,细胞不仅沿直线移动,而且常常不同程度地改变方向。当细胞迁移更持久、更快时,就会形成更多的迁移体。细胞通过迁移体将其内容物(包括胞质蛋白和囊泡)释放到细胞外空间的过程称为“迁移细胞作用”,它们的大小、生物发生过程和功能与外泌体显著不同,具体比较详见下表(Zhang et al., 2022)。据报道,迁移体广泛存在于各类迁移细胞中,在人、小鼠、大鼠、斑马鱼、鸡的各类可以迁移的细胞中均有发现。RF的数量、大小和长度因细胞而异,在多种组织和体液中也发现了迁移体,包括缺血脑组织、血小板、血液、尿液、肠、眼、胎盘、小胶质细胞、中性粒细胞、巨噬细胞、肺、肾、内胚层、斑马鱼胚胎的卵黄合胞体层和中间层以及鸡胚绒毛尿囊膜层。
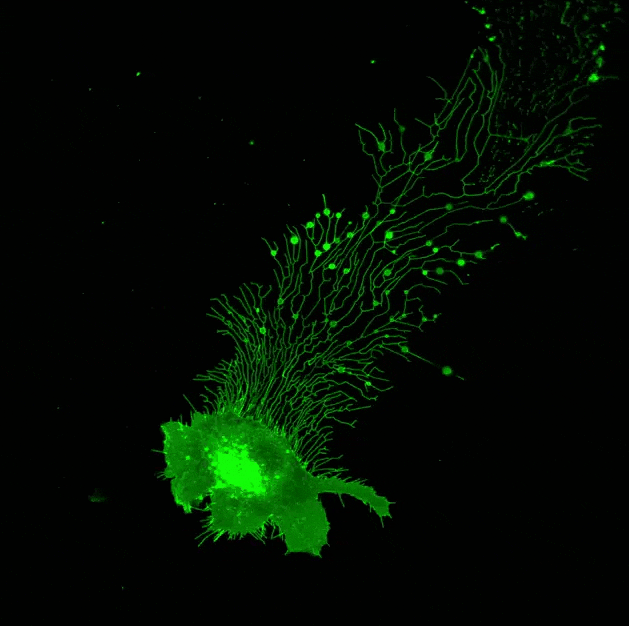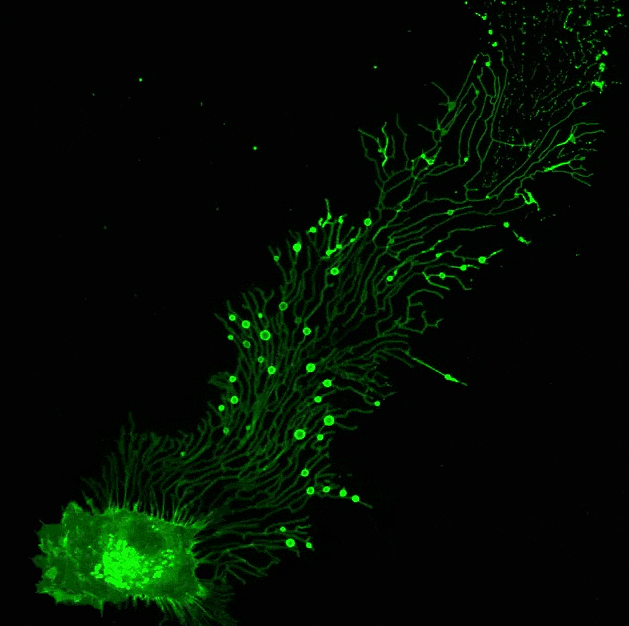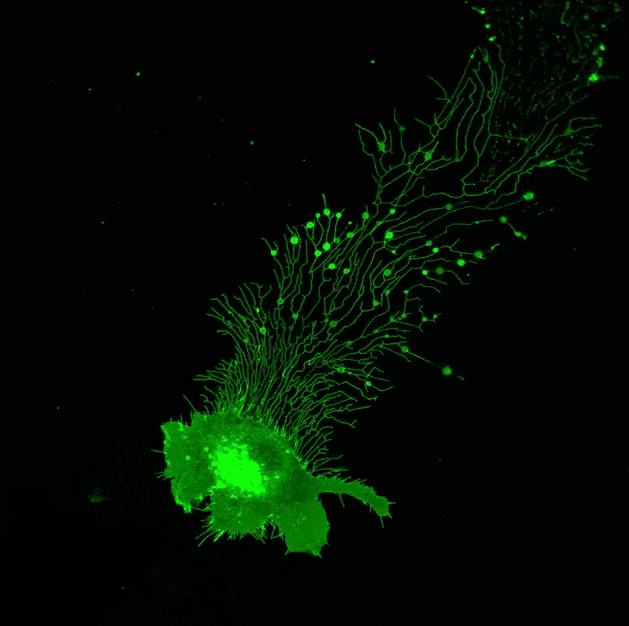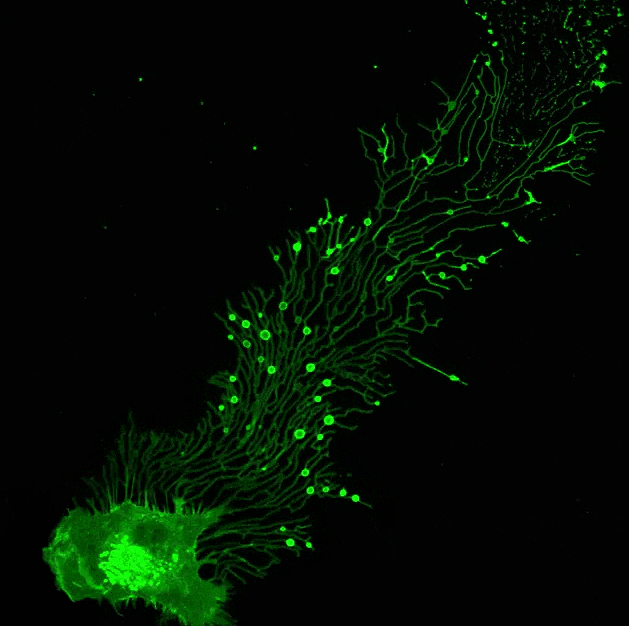
▲ 迁移体在行动!由俞立博士实验室提供。
表 迁移体与外泌体的比较
迁移体的形成机制
关于迁移体“从哪里来”的思索,目前科学家们对以下四种假设进行了验证。
01 细胞迁移模式调节迁移体的形成
细胞迁移是一个多步骤过程,其中细胞不断改变形状和极性,为了启动迁移,细胞必须获得空间不对称性,形态极化表现为细胞前极和后极之间的明显区别,是这种不对称性的重要结果。活性膜的延伸主要发生在细胞的前极,导致在运动方向上形成延伸的突起,启动细胞迁移并通过与周围环境的相互作用稳定该过程。迁移体的形成与细胞迁移密切相关,因为它发生在迁移过程中留下的残留体上。
最近,有研究表明,与以直线轨迹持续迁移的细胞相比,细胞迁移方向的改变可导致迁移体形成减少,这是由于细胞体在迁移过程中伸长,导致尾部变窄和迁移方向不稳定,最终导致残留体和迁移体的形成减少。随着细胞迁移速度的增加,残留体的长度增加,从而促进迁移体的形成。总之,上述结果表明细胞迁移模式,特别是迁移方向和速度,通过调节残留体的状态来控制迁移体的形成(Tan et al., 2023)。
02 整合素和ECM的配对决定了迁移体的形成
介于迁移体的形成取决于细胞迁移,而细胞迁移又依赖于细胞外基质(ECM)粘附,整合素是广泛参与大多数细胞的粘附分子,可介导与ECM的附着并形成粘附复合物,以具有大细胞外结构域的αβ异二聚体形式存在。在哺乳动物中,19个α和8个β整联蛋白亚基基因编码多肽,这些多肽结合形成25种不同的受体。整合素的胞外结构域决定了结合特异性并识别多种基质配体,不同的整合素结合并粘附到不同的ECM蛋白上,即迁移体的形成需要整合素及ECM伴侣蛋白的特定配对。也就是说,将整合素与特定ECM伴侣蛋白配对以获得正确的粘附是迁移体形成的决定因素。
03 磷酸肌醇激酶触发迁移体形成
研究发现,磷脂酰肌醇4,5-二磷酸盐(PIP2,磷脂酰肌醇的磷酸化衍生物,本质为脂质)在迁移体上的出现稍早于α5-整合素。迁移体上的PIP2由PIP5K1A产生,并且PIP5K1A定位于迁移体,敲除或药物诱导PIP5K1A抑制可阻止迁移体的生物发生以及Rab35(小型GTPase,可控制整合素运输)在迁移体上的定位,且Rab35的敲除强烈抑制迁移体形成,即Rab35被PIP2招募到迁移体形成位点。与其他磷酸肌醇一样,PIP2在膜中的寿命相对较短,可被PLC酶水解,转化为二酰甘油和肌醇1,4,5-三磷酸。而PLC酶PLCD3位于迁移体上,敲除PLCD3可导致迁移体形成增强。至此,研究者证明了磷酸肌醇激酶如何协调迁移体的形成(图3)。
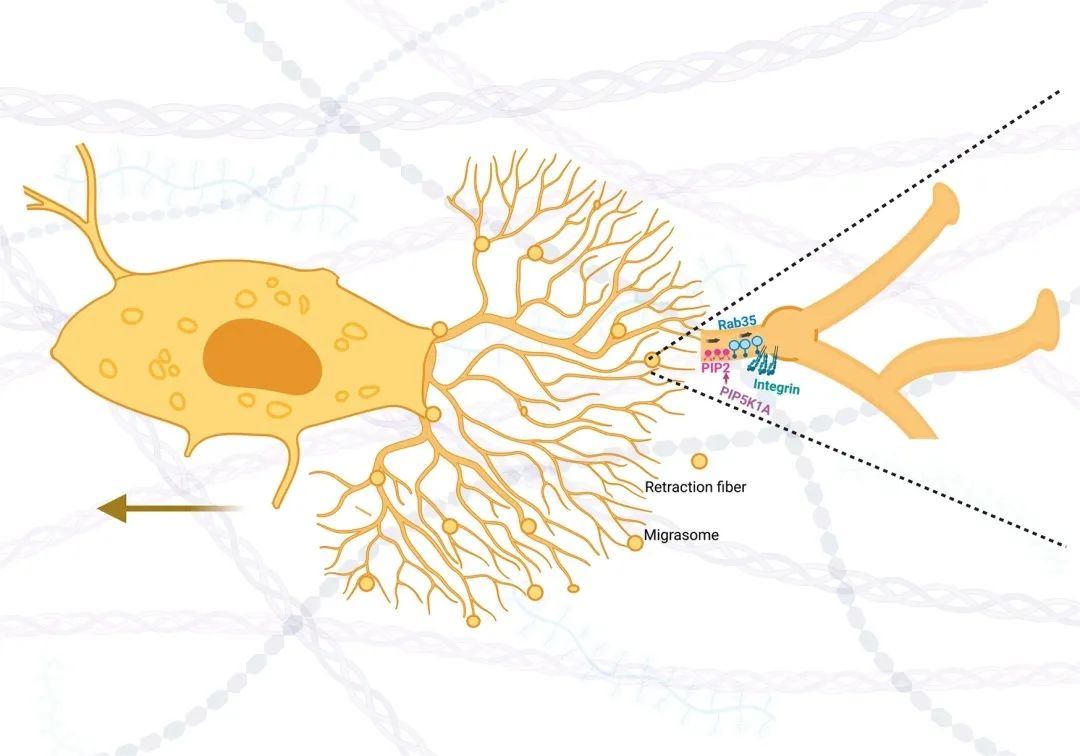
图3 PIP5K1A在沿着迁移细胞的回缩纤维特定位点产生PIP2(Zhen Y and Stenmark H. 2023)。
04 TSPAN4和胆固醇在膜断裂迁移体形成中的关键作用
研究显示,四跨膜蛋白(TSPAN)过度表达可增强迁移体的形成,其含有四个跨膜结构域,几乎存在于所有细胞类型中,其中,TSPAN4是诱导细胞迁移最有效的TSPAN之一,可驱动迁移体形成。因此,TSPAN4被用作迁移体的标记,因为它在迁移体中富集,并且在用GFP标记时最清晰(Jiang et al., 2023)。图4为共聚焦显微镜下过表达TSPAN4-GFP的正常大鼠肾细胞迁移体的形成,并用FM4-64膜染料染色。
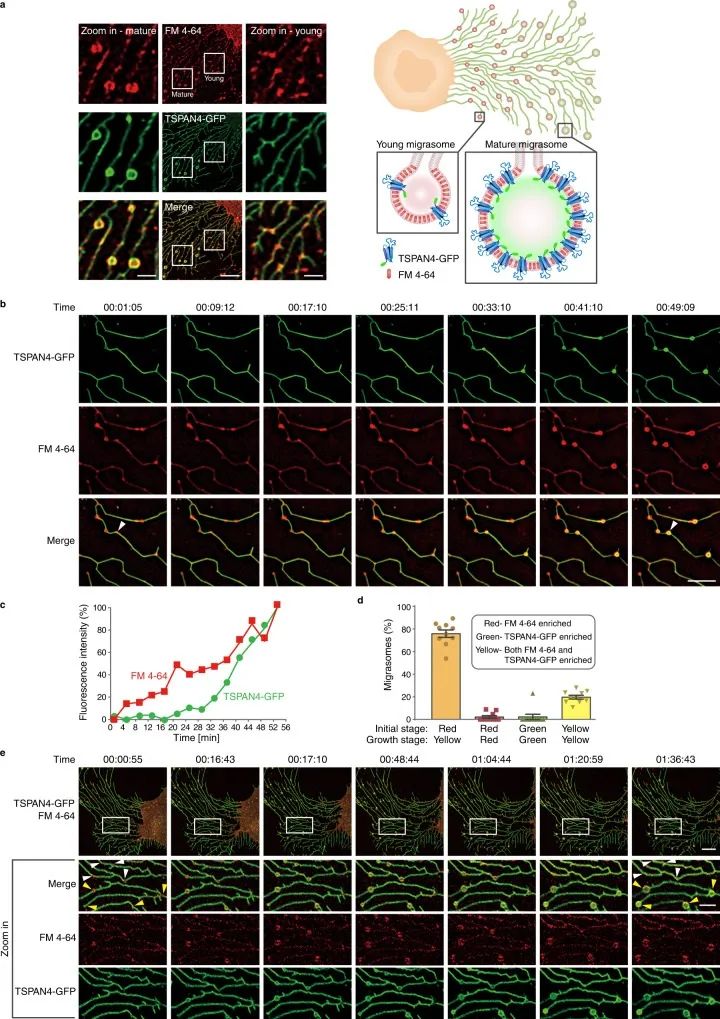
图4 迁移体的形成机制(Dharan et al., 2023)。
此外,迁移体还表现出了高水平的胆固醇富集,有研究指出,当胆固醇或TSPAN4缺失时,没有观察到迁移体样结构,并且这两种分子随机分布在RF上,证实胆固醇和TSPAN4组装成富含四跨膜蛋白的宏结构域(TEMA)是迁移体形成的必要条件。
迁移体的细胞学功能
迁移体富含细胞因子、趋化因子和生长因子等信号分子,可以被周围细胞捕获并影响和改变受体细胞的行为和状态。迁移体还可保留在迁移细胞的迁移路径上,在细胞离开后充当位置信号(Jiang et al., 2023)。因此,迁移体可以整合生物和空间信号,传递组合信号并介导细胞间通讯(图5)。具体而言,①富含趋化因子的迁移体不仅协调胚胎起源,还指导免疫细胞迁移以发挥作用;②迁移体可用作受损细胞器的处理机制,以维持细胞稳态和质量控制;③迁移体可转移细胞内容并改变受体细胞的活性和功能,是细胞间通讯的新工具。
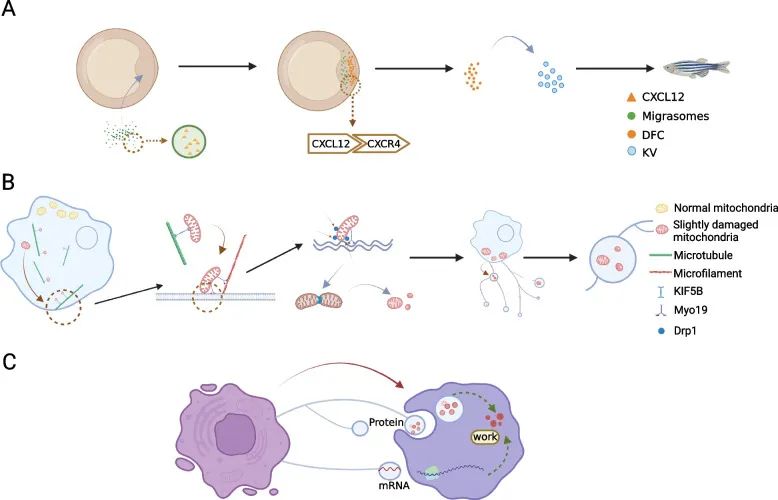
图5 迁移体介导细胞间通讯示意图(Jiang et al., 2023)。
迁移体与疾病进展
目前,大多数研究集中在迁移体的基础生物学,特别是其发现、产生、特征和功能的研究上,迁移体在病理生理过程中的作用仍有待确定,但越来越多的证据表明其在细胞间信号传导、蛋白质和mRNA的细胞间转移以及受损线粒体的脱落中发挥着重要的生理作用,从而对发育和疾病产生影响(图6)。
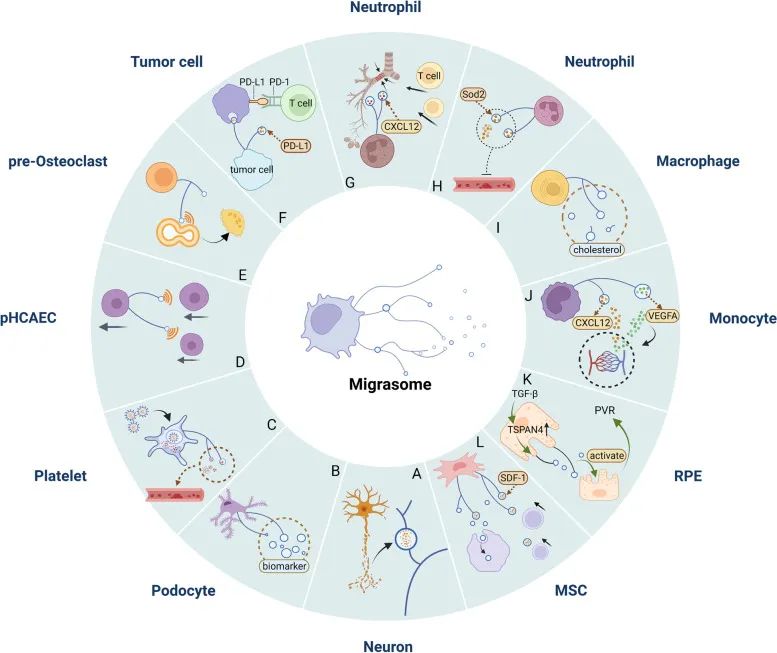
图6 迁移体介导的疾病病理过程(Jiang et al., 2023)。
参考文献
Davies K. Biological basis of child health 1: understanding the cell and genetics. Nurs Child Young People. 2020;32(3):33-43.
Dharan R, Huang Y, Cheppali SK, et al. Tetraspanin 4 stabilizes membrane swellings and facilitates their maturation into migrasomes. Nat Commun. 2023;14(1):1037.
Jiang Y, Liu X, Ye J, et al. Migrasomes, a new mode of intercellular communication. Cell Commun Signal. 2023;21(1):105.
Ma L, Li Y, Peng J, et al. Discovery of the migrasome, an organelle mediating release of cytoplasmic contents during cell migration. Cell Res. 2015;25(1):24-38.
Tan X, He S, Wang F, Li L, Wang W. Migrasome, a novel organelle, differs from exosomes. Biochem Biophys Rep. 2023;35:101500.
Yu S, Yu L. Migrasome biogenesis and functions. FEBS J. 2022;289(22):7246-7254.
Zhang Y, Zhang M, Xie Z, et al. Research Progress and Direction of Novel Organelle-Migrasomes. Cancers (Basel). 2022;15(1):134.
Zhen Y, Stenmark H. A phosphoinositide kinase triggers migrasome formation. Cell Res. 2023;33(8):577-578.




















 515
515

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








