喜马拉雅横断山脉高山垫状植物根际细菌群落的季节比较
摘要
高山垫状植物与其他物种之间的正向关联已被广泛研究。然而,几乎所有研究都集中在与大型动物的关联上。关于高山垫状植物与根际微生物之间正向关联的研究仅限于植被生长季。本研究探讨了高山垫状植物对根际微生物群落的正效应是否随季节变化。我们采用针对细菌16S rRNA基因V3区的高通量测序方法,评估了两种高山垫状植物及其周围裸地根际中细菌多样性与组成的季节性变化,并分析了根际和裸地的土壤性质。结果表明,垫状植物根际的碳、氮、硫、氨氮和土壤水分含量显著高于裸地;除土壤pH外,不同垫状植物种类的根际土壤性质无明显差异。同一微生境中的细菌多样性在不同季节间未表现出显著变化。我们得出结论:高山垫状植物对根际细菌群落具有正效应,尽管该效应的强度因垫状植物种类而异。垫状植物种类和土壤硫含量可能是驱动以垫状植物为主的高山群落中土壤细菌群落空间分布和结构的主要因素。
1. 引言
植物群落中的正向关联受到越来越多的关注(Bertness 和 Callaway,1994;Callaway,1995),特别是在环境恶劣的非生物条件下,植物常常以团聚形态分布在裸地基质中,这种正向关联的重要性在这些群落中尤为突出(Callaway 等,2002;Tirado 和 Pugnaire,2005)。高山垫状植物通常具有低矮紧凑的结构,形成矮小且多分枝的垫状体,最初是在高海拔地区的寒冷生态系统中被发现的(Raunkiaer,1934)。与其他高山物种类似,高山垫状植物在其显著生境中面临低温、短生长季、过量辐射、持续风和不稳定基质等限制因素(比林斯和穆尼,1968;K€尔纳,2003)。高山垫状植物是先锋植物,能与同一群落中的其他生物形成正向关联。
高山垫状植物通过多种方式影响植物群落。首先,高山垫状植物有助于提高植物群落的物种丰富度。例如,在高安第斯山脉,高山垫状植物作为生态系统工程师,将新物种引入群落,并在群落水平上增加物种丰富度(巴达诺等,2006;卡维雷斯和巴达诺,2009)。其次,高山垫状植物改变植物群落的多样性。关于不同垫状植物种类促进作用类型的研究表明,高山垫状植物的存在导致更高的群落多样性(Badano and Cavieres, 2006)。垫状植物还在全球尺度上防止了系统发育多样性的下降(Butterfield et al., 2013)。第三,高山垫状植物改变了植物群落的组成。本地垫状植物在严酷的高山生境中对入侵植物具有促进效应(Cavieres 等,2008)。此外,与邻近的开阔区域相比,有高山垫状植物的区域与更高的节肢动物物种丰度相关(Molenda 等,2012;Molina‐Montenegro 等,2006)。通过改变微生境,高山垫状植物充当微气候庇护所,提供防风保护、更稳定的土壤温度以及更高的土壤水分;在严酷的高山环境中,这些因素可能在群落内其他物种的定居和更新中发挥作用(Arroyo 等,2003;Cavieres 等,2005)。在中喜马拉雅地区,垫状植物的正关联随海拔升高而增强;此外,较老且较大的垫状植物增强的正效应可能与垫状植物相关的养分可利用性改善有关(Yang 等,2010, 2017)。此外,垫状植物关联的正效应强度随基础土壤养分水平而变化(Chen 等,2014, 2015)。
尽管有大量证据表明高山垫状植物对大型动物的分布和生存表现具有积极影响,但很少有研究报道高山垫状植物是否以及如何影响根际微生物。研究表明,高山垫状植物能够改善丛枝菌根的状况。例如,在安第斯山脉,生长在优势垫状植物内部的本土植物物种比生长在裸地上的同种植物具有更高的菌根共生率(Casanova‐Katny 等,2011)。高山垫状植物也被认为是塑造细菌和真菌群落过程中的潜在选择力量(Roy 等,2013)。
在高山环境中,土壤微生物群落的差异似乎因高山垫状植物生境的改变和环境胁迫而被放大。高山垫状植物对微生物的正效应在胁迫性强、酸性且养分受限的环境中会增强(Roy 等,2013)。然而,在干旱的跨喜马拉雅生境中,高山垫状植物会降低根际土壤中的细菌多样性(Rehakova 等,2015)。除植物种类外,微生物群落结构和组成还可能受到土壤pH和季节的影响(Geremia 等,2016;Siles 和 Margesin,2016;Zhang 等,2015;Lazzaro 等,2015)。然而,很少有研究探讨季节如何影响高山垫状植物根际的微生物群落;据我们所知,目前所有关于高山垫状植物对微生物影响的研究均是在植被生长季进行的。
综上所述,这些研究促使我们推测高山垫状植物对根际细菌群落的正效应具有季节性。因此,本研究的目标有两个:首先,检验高山垫状植物是否影响其周围土壤环境;具体而言,我们考察了两种高山垫状植物(拟漆姑、雪地报春)根际土壤的理化性质(土壤pH、碳氮比等)与裸地土壤是否存在差异;其次,探究高山垫状植物是否对土壤细菌多样性产生季节性影响;具体而言,我们利用细菌16S核糖体RNA基因高通量测序技术,评估在植被生长季和植被非生长季,高山垫状植物根际土壤与裸地土壤中细菌多样性和组成的差异。
2. 材料与方法
2.1. 研究地点
研究地点位于中国西南部云南省德钦县白马雪山拉卡卡山口的一个向东的斜坡上,中国西南部(28 22′15″ N, 98 59′16″ E)。湿润夏季季风主导了研究区的气候。植被生长季通常在五月融雪时开始,到九月夏季季风停止时结束(杨和孙,2009)。2010年至2013年在最近的气象站(28 23′ N, 99 01′ E,距研究区10公里,海拔4290米)记录的年降水量为600.0毫米,其中五月到九月降雨量为536.2毫米。2010年至2013年记录的年平均气温为 -0.1 ℃。最冷月与最热月之间的平均气温差约为15.5 ℃。平均风速为2.9米–3.1米每秒(王,2006)。
我们研究了两种高山垫状植物:A. polytrichoides(石竹科)和 C. hookeri (紫草科)。这两种物种均为多年生长寿草本植物,形成矮小且多分枝的垫状结构,主要生存于中国‐喜马拉雅地区的高海拔地区(图S1)。A. polytrichoides 和 C. hookeri的存在通常会增加高山植物群落的物种丰富度。它们在喜马拉雅横断山脉植物群落的严酷生境中增强了对非垫状高山植物的促进效应(Chen 等,2015)。研究地点位于海拔4780米的山顶附近,此处A. polytrichoides 和 C. hookeri同时分布。
2.2. 土壤采样
研究地点的土壤采样分别于2011年9月初(植被生长季)和2011年10月底(植被非生长季)进行。每个季节选取十二个样地,包括四个 A. polytrichoides植被样地、四个C. hookeri植被样地和四个裸地样地。在每个植被样地中,采集五个直径为15厘米的垫状体。采集并混合附着在垫状根主根上的土壤,以代表根际微生境。在每个裸地样地中,从地表下2至15厘米处采集五个直径为10厘米的土壤柱,并混合在一起以代表原位土壤微生境。总共采集了24份土壤样品,并在-80 °C条件下保存。
2.3. 土壤理化性质
测定了土壤样品的11项特征参数,包括碳、氮、总磷、土壤钾、总硫、氨氮 [NH₄⁺-N]、硝态氮 [NO₃⁻-N]、有效磷 [PO₄³⁻-P]、土壤pH、土壤含水量和碳氮比。土壤含水量在采样后立即采用重量法(布莱克等,1965)测定。铵态氮和硝态氮从新鲜土壤样品中通过布雷纳法(布雷纳,1965)提取,随后根据制造商说明使用流动注射分析(拉查特仪器公司,美国)测定其浓度。为表征其他理化参数,土壤首先在-46 °C条件下冷冻干燥。然后将土壤样品手工充分研磨,并通过150微米筛网过筛。土壤 pH使用pH计(费舍尔科技公司,美国)测定。土壤的总碳、氮、总硫数据由火焰光度检测器(艾力曼分析系统有限公司,德国)获得,而总磷和土壤钾则采用强酸土壤消解法(李等,2006)并通过电感耦合等离子体发射光谱仪(ICP‐OES, 珀金埃尔默 Optima 7000DV,美国)测定。土壤中的有效磷采用布拉耶1号法(布拉耶和柯尔茨,1945)提取,然后根据制造商说明使用流动注射分析进行测定。碳氮比在确定碳和氮含量后计算得出。
2.4. DNA提取和16S rRNA基因扩增
每个样品的土壤DNA总量从500 mg冷冻干燥的土壤中提取,使用FastDNA土壤试剂盒(MP Bio‐medicals,法国)。总土壤DNA溶液使用MinElute PCR纯化试剂盒(Qiagen,德国)进行纯化。总土壤DNA浓度使用SpectraMax M5(Molecular Devices,美国)结合 Quant‐iT™ PicoGreen® dsDNA Assay Kit(Invitrogen,美国)进行定量。提取的DNA储存在-20 °C。所有实验步骤均按照制造商的说明进行。
使用通用引物338F和533R扩增一个~150 bp的片段,该片段覆盖细菌16S rRNA基因的高变V3区(Huse等人,2008年)。在用于扩增特定土壤DNA的一对引物上添加了一个独特的八碱基纠错条形码(表 S1)(Hamady等人,2008年)。所有扩增反应均进行三重复,每反应体系为25 μl,另设一反应作为阴性对照。每个反应体系包含12.5 μl 2× DreamTaq Green PCR预混液(Thermo Scientific,美国)、10.25 μl去离子无核酸酶水、0.5 μl各自对应的引物(终浓度为0.4 μM)、0.25 μl牛血清白蛋白(BSA,终浓度为6 μM)(Takara,日本)以及20 ng DNA模板。在对照反应中,用1 μl无核酸酶水替代土壤 DNA。PCR扩增采用以下热循环程序:95 °C初始变性3分钟,随后进行35个循环,分别为95 °C 30秒、55 °C 30秒和72 °C 30秒,最后在72 °C进行最终延伸5分钟。将三次重复反应的土壤DNA扩增产物混合,通过1.5%琼脂糖凝胶电泳检测,并使用MinElute PCR纯化试剂盒(Qiagen,德国)进行纯化。纯化后的扩增产物浓度使用SpectraMax M5(Molecular Devices,美国)结合Quant‐iT™ PicoGreen® dsDNA检测试剂盒(Invitrogen,美国)进行定量。
2.5. 测序与处理
纯化后的扩增产物被按相等的DNA质量混合成一个文库用于测序。双端测序于2013年7月20日在Illumina HiSeq2000上进行(BGI tech,中国)(Degnan和Ochman,2012年)。测序数据使用定量微生物生态学分析流程(QIIME,版本1.7.0)(Caporaso等人,2010年)进行处理。测序数据的处理包含以下步骤:首先对双端读段进行碱基识别和质量过滤,并去除条形码和引物序列;删除含有未确定碱基的序列。在获得干净数据后,使用97%相似性阈值将序列聚类为可操作分类单元(OTUs),该阈值对应于物种水平的分类等级(Turnbaugh等人,2010年)。在此阶段,从OTU表中去除了潜在嵌合体和单例序列。分类学指派依据http://greengenes.lbl.gov/网站提供的Greengenes OTU数据库进行。
总共将1,111,342条有效序列在97%相似性阈值下聚类为24,588个细菌操作分类单元(OTUs)。对于后续分析,例如计算α和β多样性,采用数据集中所有样本的最小有效序列数作为均一测序深度,以便公平比较土壤中细菌群落的特征。因此,该数据集后续分析所用的均一测序深度为31,290条序列(表S1)。α多样性的稀疏化分析也在该均一测序深度下进行。基于OTU表的加权UniFrac距离进行主坐标分析(PCoA),以评估微生境间β多样性的差异(Lozupone等,2007)。该分析流程遵循该流程网站上的教程(http://qiime.org)。在QIIME中用于处理流程的主要脚本如表S2所示。
2.6. 统计分析
并非所有土壤理化性质的数据都符合正态分布和方差齐性,且每组样本量较小(n = 4)。因此,我们使用预测分析套件工作站统计软件(PASW Statistics,版本19.0.0)进行Kruskal‐Wallis非参数检验,以检验微生境之间土壤特征的差异。为了考虑所观察到的每个细菌物种的均匀性,我们采用Shannon‐Wiener指数评估细菌群落的α多样性。不同微生境间Shannon‐Wiener指数的差异通过单因素方差分析(One‐Way ANOVA)结合Student‐Newman‐Keuls多重比较检验进行评估。鉴于细菌物种数量庞大及其相对丰度的差异,采用加权 UniFrac结合主坐标分析(PCoA)来确定细菌群落的β多样性(Lozupone等,2011)。在PASW中进行独立样本t检验,以检测微生境间细菌门相对丰度的差异性。在PASW中进行Spearman相关性分析,分别检验细菌门的相对丰度与季节或微生境之间的关系。为了识别可能对构建细菌群落重要的非生物因子,并揭示细菌群落组成与土壤性质之间的潜在关系,在R(版本3.0.1)中使用群落生态学包‘Vegan(2.0‐8)’进行典范对应分析(CCA‘Vegan (2.0‐8)’(Oksanen等,2013)。除非另有说明,所有显著性差异均在p < 0.05水平。
这些簇的代表性序列已存入NCBI公共数据库(https://www.ncbi.nlm.nih.gov/nuccore/?term=MG781119:MG781151),登录号为MG781119 – MG781151。
3. 结果
3.1. 土壤性质
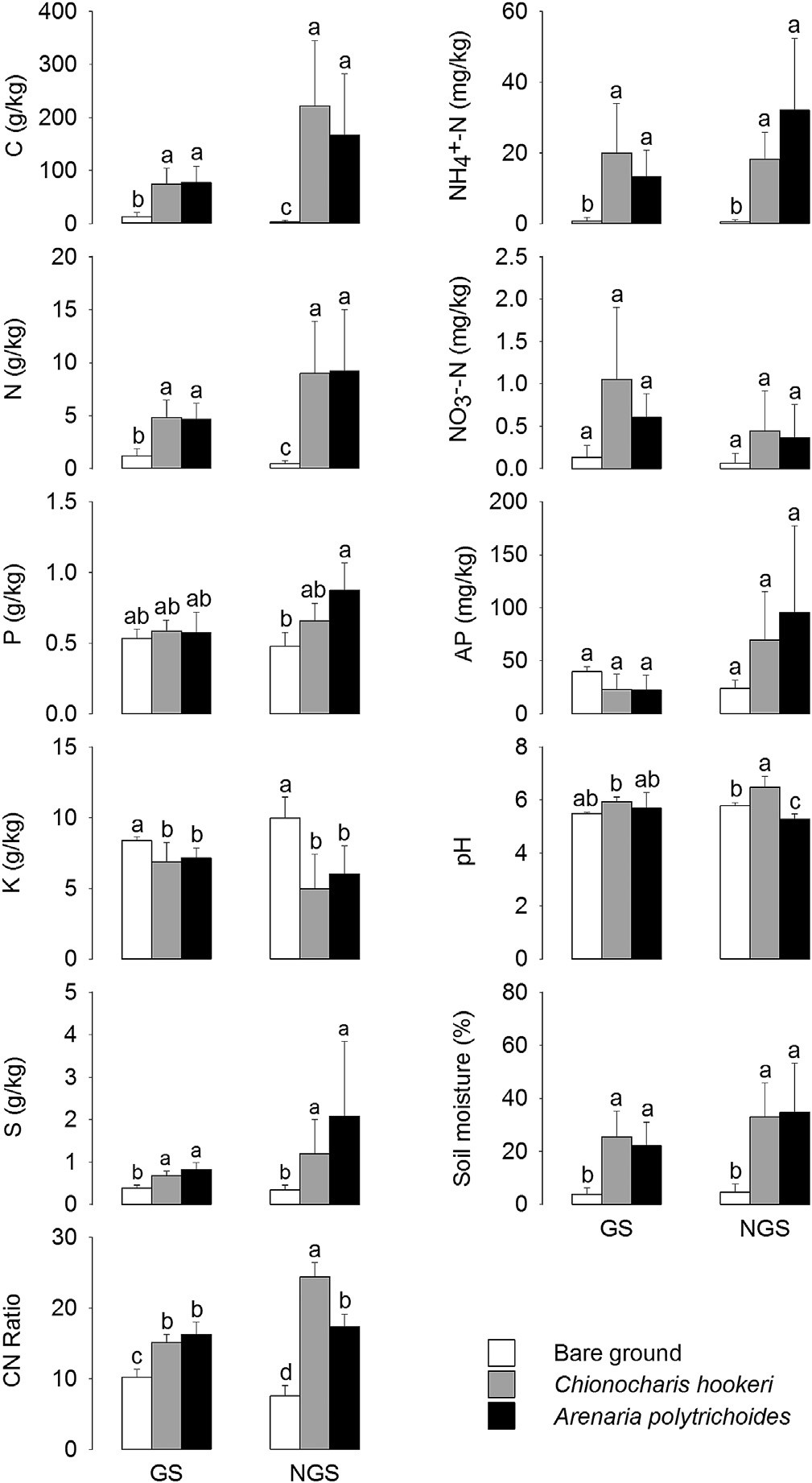
所有采集的土壤均为酸性。在植被非生长季,根际与裸地之间的土壤pH存在显著差异。两种垫状植物A. polytrichoides和C. hookeri的根际在两个季节中总碳、氮、硫和氨氮含量、土壤水分以及碳氮比均显著高于裸地(图1)。在两个季节中,裸地的钾含量明显高于两种垫状植物的根际。总磷含量、有效磷和硝态氮在不同微生境之间在各季节均无显著差异。

3.2. 细菌多样性
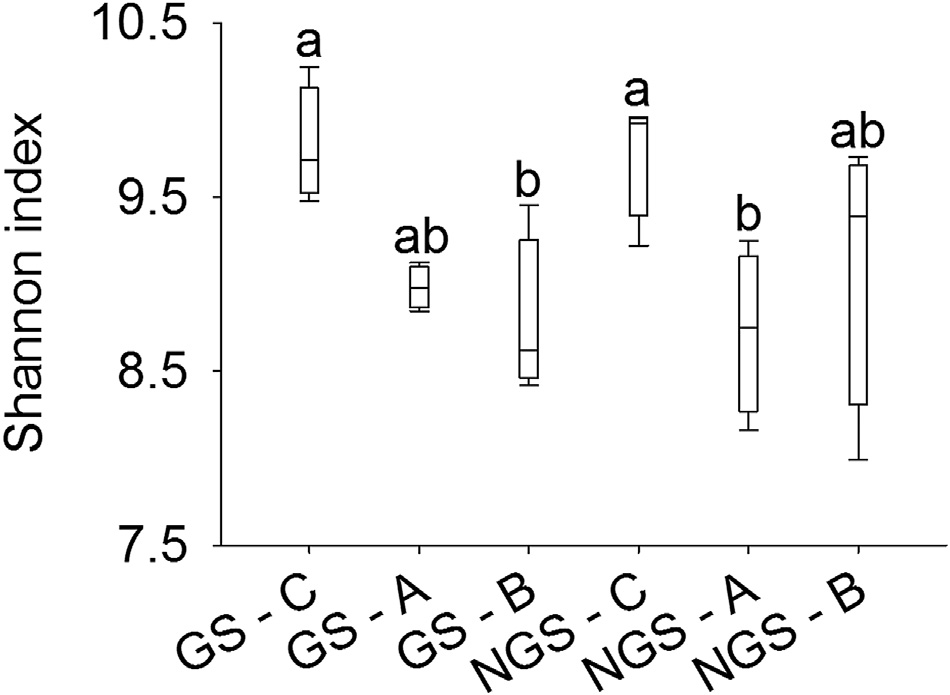
香农指数表明,垫状植物的根际和裸地在植被生长季与非生长季之间的细菌α多样性均无显著差异。在植被生长季,C. hookeri 的根际所含的细菌α多样性显著高于裸地;在植被非生长季,其根际的细菌α多样性也显著高于A.polytrichoides 的根际(图2)。在两个季节中,A.polytrichoides垫状植物的根际细菌α多样性与裸地几乎相同。
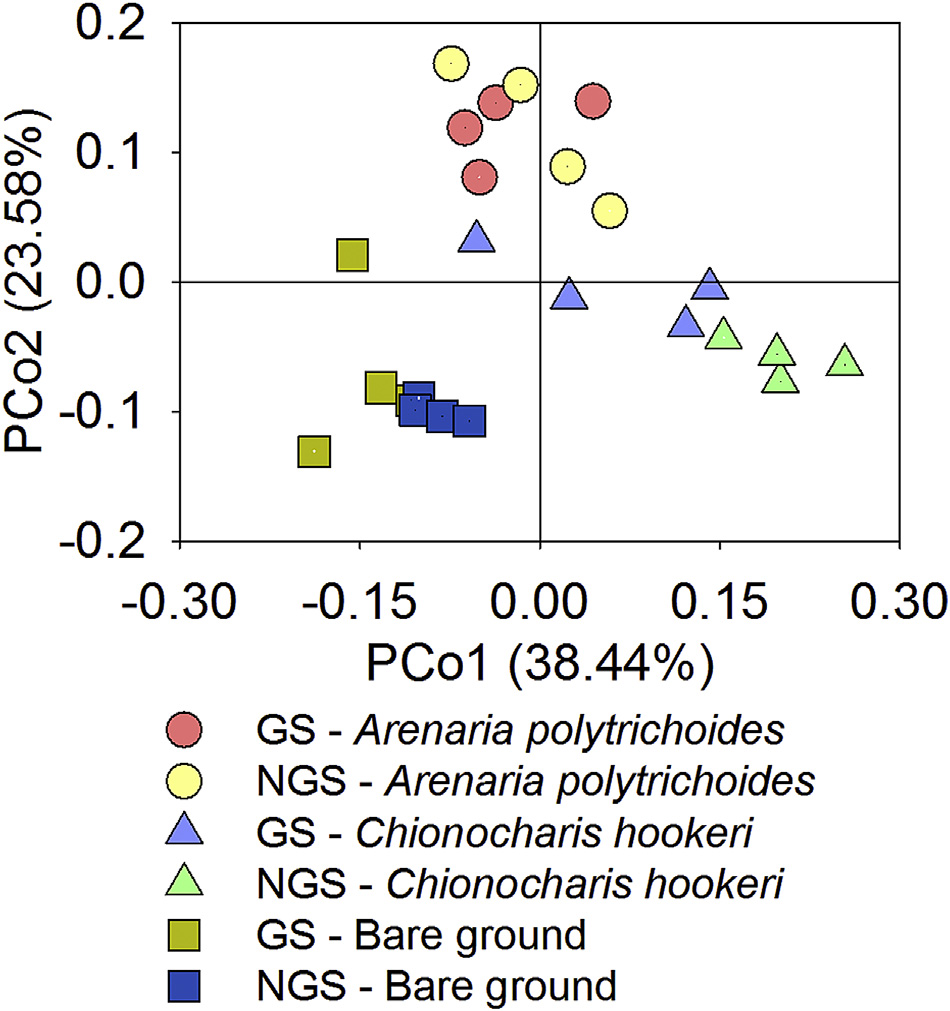
稀疏曲线显示了香农指数、chao1、观测物种和PD全树随测序深度变化的动态(图S2)。主坐标分析模式显示,在植被生长季内外,裸地下的细菌群落主要聚集在第三象限,而垫状植物根际的细菌群落则分布在其其他象限。第一轴解释了所观察到的总体变异的38.44%,前两个轴总共解释了62.02%的总体变异(图3)。
3.3. 细菌群落组成
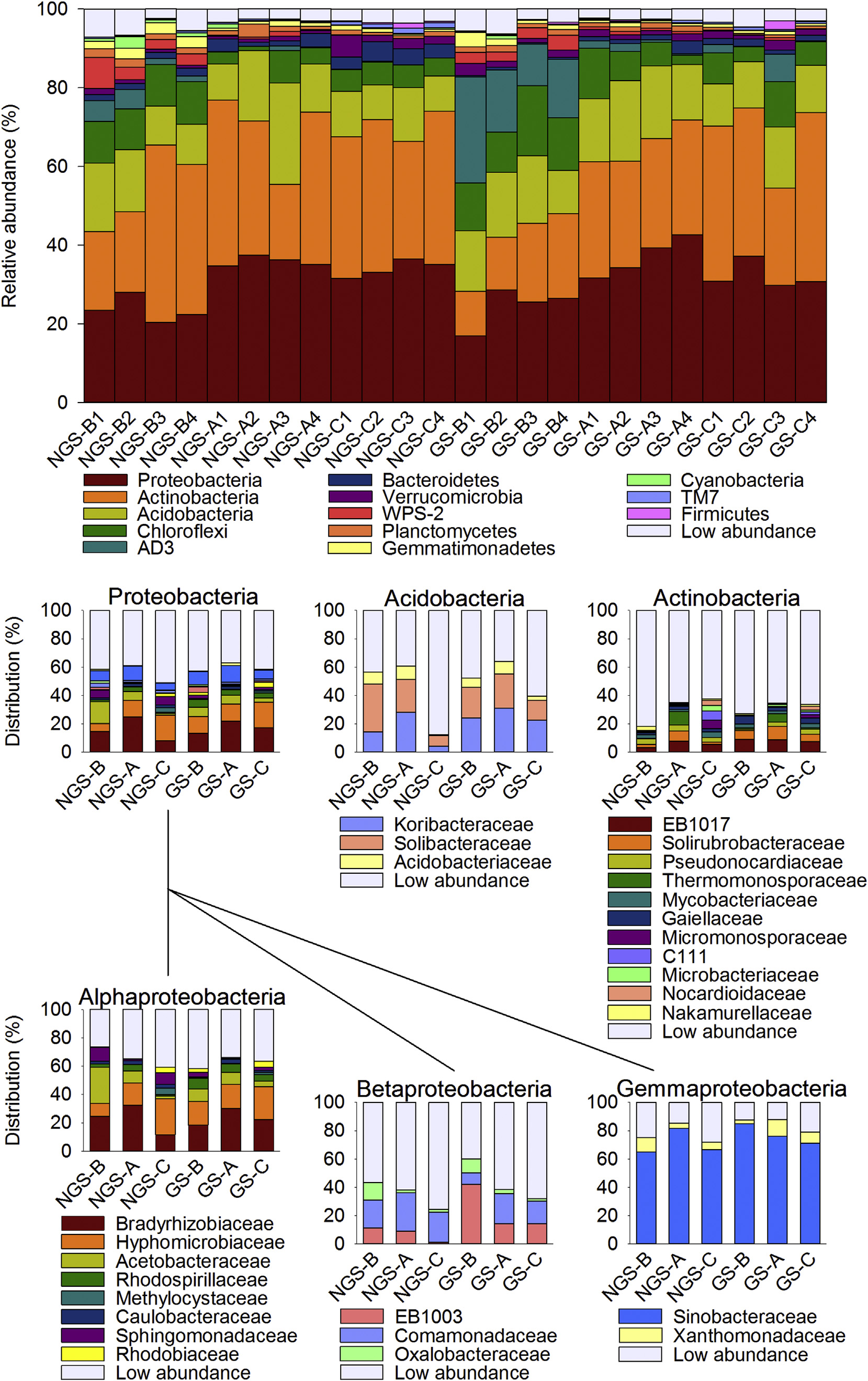
在所有土壤中,变形菌门、放线菌门、酸杆菌门、Chloroflexi和 AD3菌门是五种最丰富的细菌门,合计占总细菌丰度的76.80%至92.17%,如图4所示。在植被生长季期间,A. polytrichoides 和 C. hookeri 的根际共同拥有显著更多的变形菌门、放线菌门、拟杆菌门和TM7菌门,而裸地则显著拥有更多的绿弯菌门、AD3菌门、WPS‐2门和芽单胞菌门。在生长季之外,垫状植物的根际显著拥有更多的变形菌门,而裸地则显著拥有更多的绿弯菌门和芽单胞菌门。在A. polytrichoides的根际中,细菌门的相对丰度随季节无明显变化。在C. hookeri的根际中,拟杆菌门、蓝细菌门和TM7菌门主要出现在植被生长季之外。裸地在植被生长季的AD3菌门相对丰度远高于植被生长季之外。相反,这些菌门拟杆菌门和TM7菌门主要出现在植被生长季之外的裸地下方。
3.4. 细菌群落与非生物因子的相关性
方差膨胀因子(VIF)小于10的九个环境属性被纳入典范对应分析双序图(图5)。结果表明,总硫是唯一对细菌群落分布具有显著影响的参数(p = 0.005,p < 0.01)。第一轴解释了12.01%的变异,而第二轴解释了整体观察变异的6.11%。
斯皮尔曼相关性检验表明,几乎所有细菌门均与微生境(即垫状植物根际和裸地)显著相关。有四个门与季节(即植被生长季和非生长季)显著相关,包括拟杆菌门、蓝细菌门、AD3菌门和TM7菌门。其中,拟杆菌门、AD3菌门和TM7菌门同时与微生境和季节显著相关(表S3)。
4. 讨论
4.1. 垫状植物含有更高的土壤养分
诸如土壤pH和土壤养分有效性等非生物因素已被确定为微生物群落丰富度和组成的关键决定因素(Fierer and Jackson, 2006;Lauber et al., 2008)。因此,土壤性质是研究植物根际微生物时需要考察的主要非生物因素。然而,仅有少数研究探讨了高山垫状植物根际的土壤性质。此外,据我们所知,尚无研究报道植被非生长季之外高山垫状植物根际的土壤性质。
本研究测定了两种高山垫状植物根际及裸地在植被生长季内外的11种土壤理化性质。结果表明,无论是在植被生长季内还是外,垫状植物根际的土壤总碳、氮、硫、氨氮、含水量和碳氮比均显著高于裸地。我们发现高山垫状植物根际的土壤碳、氮和土壤水分含量高于裸地,这与以往研究结果一致(Casanova‐Katny 等,2011;Rehakova 等,2015;Roy 等,2013);同样,植被生长季期间的土壤水分变化模式也与先前的研究相符(Roy 等,2013;Yang 等,2010)。垫状植物低矮形态、浓密冠层及其所产生的微气候条件可能解释了这些理化性质的差异。
土壤pH是影响土壤细菌群落的关键因素(Shahnavaz 等,2012)。尽管先前的研究报道,在植被生长季期间,垫状植物根际的土壤pH低于裸地原位土壤(Roy 等,2013),但我们发现,在植被生长季之外,C. hookeri 垫状植物内的土壤pH显著更高,而 A. polytrichoides 垫状植物内的土壤pH则较低。不同垫状植物之间土壤pH的差异可能源于植物根系分泌物,其可显著降低根际土壤pH(达科拉和菲利普斯,2002)。有趣的是,以往研究高山垫状植物与根际微生物关系的研究均位于具有干燥夏季和多雨冬季或全年各季节降水稀少的干旱山区。相比之下,我们的研究区具有湿润夏季和干燥冬季。本研究区的水热条件可能更有利于高山植物和根际微生物繁殖。
根据我们检测的土壤性质,高山垫状植物的根际通常比裸地含有更多的主要矿物养分和土壤水分。这两种垫状植物产生的正效应程度不同,被认为是导致植被非生长季期间微生境之间理化性质差异大于植被生长季期间的原因。
4.2. 垫状植物在植被非生长季 harbors different 细菌多样性
很少有研究关注高山垫状植物根际中的微生物(Casanova‐Katny 等,2011;Rehakova 等,2015;Roy 等,2013)。此外,已报道高山垫状植物根际微生物的研究均是在植被生长季进行的。与这些研究不同,我们比较了两种高山垫状植物根际细菌群落多样性的季节性差异。尽管在生长季和非生长季期间,垫状植物根际和裸地土壤中的细菌多样性没有显著差异,但在植被生长季,C. hookeri根际所鉴定的细菌群落丰富度和多样性显著高于裸地下方土壤。此外,在植被非生长季,C. hookeri根际的细菌多样性显著高于A.polytrichoides根际。
细菌群落的结构和组成与先前的研究部分一致,即在某些样地中优势门为放线菌门(Rehakova 等,2015),例如在两个季节中C. hookeri的根际以及植被生长季外的裸地。然而,在两个季节中A. polytrichoides 的根际以及植被生长季期间裸地下的优势门为变形菌门生长季(表S4)。我们还发现,在A. polytrichoides下方以及裸地,两个季节中最丰富的两个属是候选属Solibacter和Rhodoplanes 。在植被生长季期间C. hookeri垫状植物下的最丰富属与A. polytrichoides相同,而在植被生长季之外则以分枝杆菌和Rhodoplanes为主。在之前一项使用培养方法的研究中,在高山垫状植物种 Thylacospermum caespitosum下发现的最丰富细菌属完全不同(包括链霉菌、节杆菌和类芽孢杆菌)(Rehakova 等,2015)。细菌属丰度的差异是源于宿主植物的不同还是技术方法的不同,目前尚不清楚。
在相似的土壤养分条件下,细菌多样性与两种高山垫状植物之间的关联在植被非生长季尤为不同。高山植物对微生物的影响可能具有物种依赖性,而除硫含量外,土壤理化性质对细菌群落没有显著影响。这表明,所有细菌门的相对丰度与微生境之间的相关性说明,高山垫状植物下方的细菌群落是被精确组装并受到高山垫状植物影响的。细菌与高山垫状植物共享根际中的相同养分库。已有研究发现微生物会竞争土壤氨基酸,而氨基酸可能是高山苔原中重要的氮源(Lipson 和 Monson,1998)。其他资源,如土壤水分和大多数养分,在裸地土壤中保持较低水平,无法对细菌或植物群落产生正效应(达科拉和菲利普斯,2002)。相比之下,先锋垫状植物被认为对地表分化和表土发育具有正效应。
5. 结论
总之,高山垫状植物对根际细菌群落具有正效应,尽管不同垫状植物种类的效应强度有所不同。垫状植物种类和土壤硫含量可能是驱动以垫状植物为主的高山群落中土壤细菌群落空间分布和结构的主要因素。





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








