DMFET生物传感器及其基于互补金属氧化物半导体前置电荷放大器的读出电路一体化设计
摘要
介电调制场效应晶体管(DMFET)相较于许多其他知名的生物传感器具有优势,使其在医学和诊断领域中极为重要。本文旨在使用SPICE三级模型对DMFET进行建模。该适配模型的DMFET传感器可用于检测刻蚀在栅极介质中的纳米间隙腔内带电及不带电生物分子的存在。带负电荷和不带电的脱氧核糖核酸分子存在于纳米间隙腔中时,会改变阈值电压,从而改变导通电流。最后,本研究将基于90纳米CMOS技术设计的低噪声、低功耗前置电荷放大器与适配DMFET模型的小信号输出集成。在未使用任何大阻值无源反馈电阻的情况下,实现了984.2毫伏每皮库仑的电荷灵敏度。
关键词
DMFET,SPICE三级模型,纳米间隙,前置电荷放大器
一、引言
随着硅基器件制造技术的进步,尤其是器件尺寸的缩小,使我们实现了高电路速度[1]。近几十年来,纳米级器件也越来越多地被开发用于生物传感应用。根据国际纯粹与应用化学联合会(IUPAC)的定义,生物传感器是一种利用分离的酶、免疫系统、组织、细胞器或完整细胞介导的特异性生化反应,通过电信号、热信号或光信号来检测化学物质的装置。场效应晶体管(FETs)是用于此目的最常用的器件之一。
使用场效应晶体管(FET)进行电学检测基于两种方法:(i)介电常数调制效应和(ii)电荷相互作用效应。其中,基于前一种方法的生物传感器是DMFET。与基于电荷相互作用效应的传感器相比,DMFET生物传感器具有一些优势,例如能够检测带电和不带电的生物分子、更高的检测灵敏度、纳米间隙中均匀的电场,并且所需的测量样品体积较小[2,3]。
脱氧核糖核酸杂交的研究是基因组学和基因表达领域中的重要事件。聚合酶链式反应(PCR)是目前最常用的DNA检测技术,已用于脱氧核糖核酸扩增多年[4]。此外,还开发了基于荧光、电化学、纳米颗粒和酶的其他方法。但这些技术均需要标记步骤,存在诸如多步分析复杂、标记效率有限等缺点[4]。为克服这些缺点,提出了离子敏感型场效应晶体管(ISFETs),其可在无需标记的情况下实现DNA检测。最近,一种更为灵敏的纳米器件——硅纳米线场效应晶体管被引入,其工作原理与ISFET相同。
当带电生物分子固定在纳米线栅极上时,阈值电压(VT)、漏极电流(ID)和跨导(gm)等电学特性会相应变化[4]。这些器件基于电荷相互作用效应工作,因此只能检测带电生物分子。然而,为克服这一限制,提出了DMFET,因其也可用于不带电生物分子的检测。本研究采用带负电荷和不带电的脱氧核糖核酸分子,验证n沟道和p沟道DMFET的SPICE模型。图1显示了DMFET的示意图。
基于DMFET的电路实现需要具备兼容器件模型的计算机辅助设计(CAD)工具,这些模型需具备高速、可靠和高精度的特点[5]。但由于大多数电路实现均基于Cadence Spectre或LTSpice等开源软件,因此有必要建立SPICE模型,以进一步精确实现读出电路。本文提出了DMFET在SPICE三级模型中的实现方法。由该SPICE模型获得的数据与C‐H. Kim等的研究结果一致[1]。此外,本研究还开发了一种作为传感器信号电流‐电压转换器的低噪声、低功耗预充电放大器。该模型还与其他已有的设计方案进行了比较。
II. DMFET的设计与SPICE建模
A. 器件描述
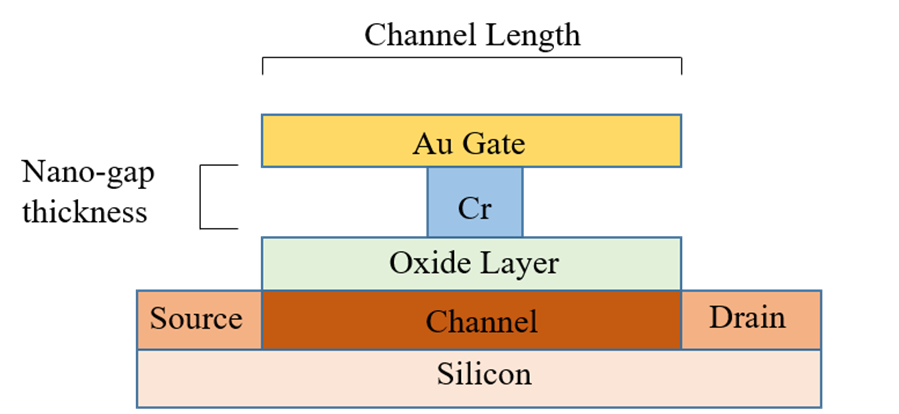
图1显示了DMFET的模型,该模型已被考虑用于SPICE中的适配。在图1中,金(Au)被用作栅极材料[1]。开发了一个15纳米的纳米间隙,通过沉积一层薄铬并随后进行湿法刻蚀实现。在漏极、源极和沟道注入[2]形成之后,SiO2层在有源硅片上形成。DMFET具有与任何标准场效应晶体管相似的电学特性。所提出的器件适用于基于因介电介质变化引起的阈值电压偏移来检测特定生物分子。
本研究聚焦于脱氧核糖核酸(DNA),它是一种体积最大的带负电荷的生物分子。将这种分子引入纳米间隙会引起介电调制效应以及电荷效应。因此,在构建SPICE模型时,必须同时考虑这两种效应。
通过检测生物分子引入纳米间隙后引起的阈值电压变化量,可确定溶液中生物分子的性质/类型。
n型沟道DMFET的阈值电压控制方程由公式(1)给出:
$$
V_t = V_{FB} + 2\phi_b + \frac{Q_{dep}}{C_{DMFET}} - \frac{Q_{fix}}{C_{DMFET}}
$$
其中$V_t$为阈值电压,$V_{FB}$为平带电压,$\phi_b$为表面能带弯曲,$Q_{dep}$为硅衬底中的耗尽区电荷密度,$Q_{fix}$为介电层中的固定电荷密度,$C_{DMFET}$为等效栅极电容。
纳米间隙处有效介电常数的变化会引起$C_{DMFET}$的改变,进而导致$V_t$发生偏移。$C_{DMFET}$由公式(2)给出。
$$
\frac{1}{C_{DMFET}} = \frac{1}{C_{biomol}} + \frac{1}{C_{air}} + \frac{1}{C_{ox}} = \frac{T_{biomol}}{k_{biomol} \varepsilon_0} + \frac{T_{air}}{\varepsilon_0} + \frac{T_{ox}}{k_{ox} \varepsilon_0}
$$
其中,$C_{biomol}$、$T_{biomol}$和$k_{biomol}$分别为生物分子的电容、厚度和介电常数。$C_{air}$和$T_{air}$为空气的电容及其厚度。$C_{ox}$、$T_{ox}$和$k_{ox}$分别表示栅极介质的电容、厚度和介电常数。
由于SiO2 中的$V_t$ 始终低于空气中的$V_t$ ,因此$V_t$ 对纳米间隙区域[1]内的任何变化更加敏感。假设生物分子的厚度层厚度固定为6 nm,即DNA分子的厚度。随着纳米间隙中DNA分子浓度的增加,该层的介电常数发生变化,进而引起器件阈值电压[1]的变化。阈值电压变化按以下公式计算(使用公式1和2):
$$
\Delta V_t \propto \frac{1}{C_{DMFET}} \propto \frac{1}{k_{biomole}}
$$
由(3)式可知,随着纳米间隙内生物分子层浓度的增加,传感器的阈值电压降低。
如果假设介电常数的变化为零,则生物分子引起的电荷密度是影响$V_t$值的唯一因素,该关系由以下方程描述:
$$
\Delta V_t \propto -Q_{fix}
$$
公式4表明,随着生物分子电荷的增加,$V_t$呈线性增长。
现在通过使用(3)中的叠加方法,我们得到:(4)
$$
\Delta V_t \propto \frac{(Q_{dep} - Q_{fix})}{k_{biomole}}
$$
B. DMFET的SPICE三级模型适配
为硅基场效应晶体管定义的SPICE三级模型既具有经验性又具有物理性。DMFET是一种四端器件,类似于场效应晶体管,其第四个端子(体极)连接到源极。
仿真中考虑的数值已在表I中提及。
| 参数 | 值 |
|---|---|
| SiO2初始厚度(Tox) | 73.5纳米 |
| DNA厚度 | 6 nm |
| SiO2中的初始电荷密度 | -5 x 10^10/cm² |
| 气隙中的电荷密度 | 0-10^11/cm² |
| DNA介电常数 | 1-16 |
| 衬底掺杂(n型) | 1 x 10^15/cm³ |
| 沟道长度 | 5 µm |
| 沟道宽度 | 50 μm |
在仿真和制造工艺[1]中,考虑了15纳米的纳米间隙和15纳米的SiO2厚度。然而,SPICE不允许创建纳米间隙,限制了模型只能使用标准MOSFET结构。因此,采用具有等效电容的SiO2层来替代空气和SiO2的总电容。
DMFET,使得DMFET(空气和SiO2的串联组合)的净电容与MOSFET的净电容相等。
$$
\frac{1}{C_{DMFET}} = \frac{1}{C_{ox}} + \frac{1}{C_{air}} \quad \text{and}, \quad \frac{1}{C_{MOSFET}} = \frac{1}{C_{ox}}
$$
代入$k_{ox}= 3.9$及其他相应值后,得到SPICE模型的等效初始氧化层厚度Tox等于73.5纳米。
DMFET的栅极是金(Au)电极(功函数= 5.1 eV)[1];然而,SPICE三级模型仅允许使用铝或n型/p型多晶硅作为栅极。因此,在适配模型中选择了功函数为4.2电子伏特的铝栅极。为了补偿金和铝之间功函数不等(ϕ)的影响,假设在SiO2层内存在固定电荷的初始浓度($Q_{fix}$)。该值由公式(7)计算得出:
$$
Q_{fix}(initial) = (\Phi_{Au} - \Phi_{Al}) C_{MOSFET}
$$
这给出 $Q_{fix}(初始) ≈ -5 x 10^{10}/cm^2$。
SPICE三级模型带来的另一个限制是其不允许修改介质材料的介电常数。因此,为了反映介电常数的变化,根据纳米间隙中DNA层浓度调整SiO2层的厚度。以下公式8是根据公式(1)和公式(2)推导得出的。
$$
\Delta T_{ox}(MOSFET) = T_{biomol} k_{ox} \left(\frac{1}{k_{biomol}} - 1\right)
$$
$$
\Delta T_{ox}(MOSFET) = T_{ox}(new) - T_{ox}(old)
$$
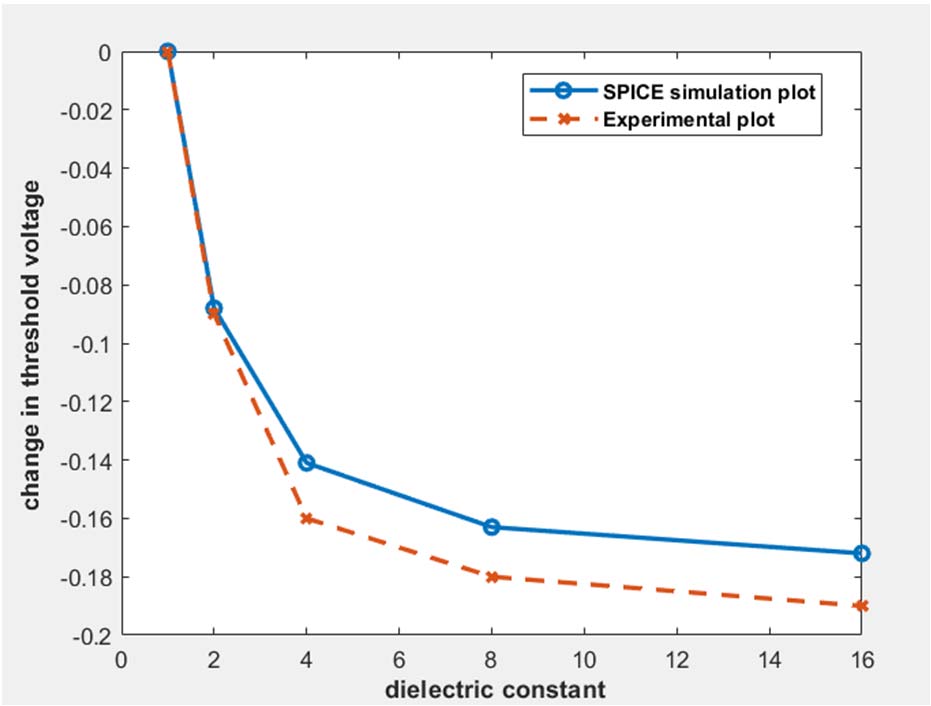
由(8)式可以看出,随着中性DNA浓度($k_{biomol}$)的增加,Tox减小,因此$V_t$也随之减小。这一趋势在图2中进行了绘制,SPICE仿真结果与(3)式给出的趋势一致。实验曲线与仿真曲线之间的最大偏差出现在$k_{biomol}$等于16时,该点的绝对误差值为9.47%。
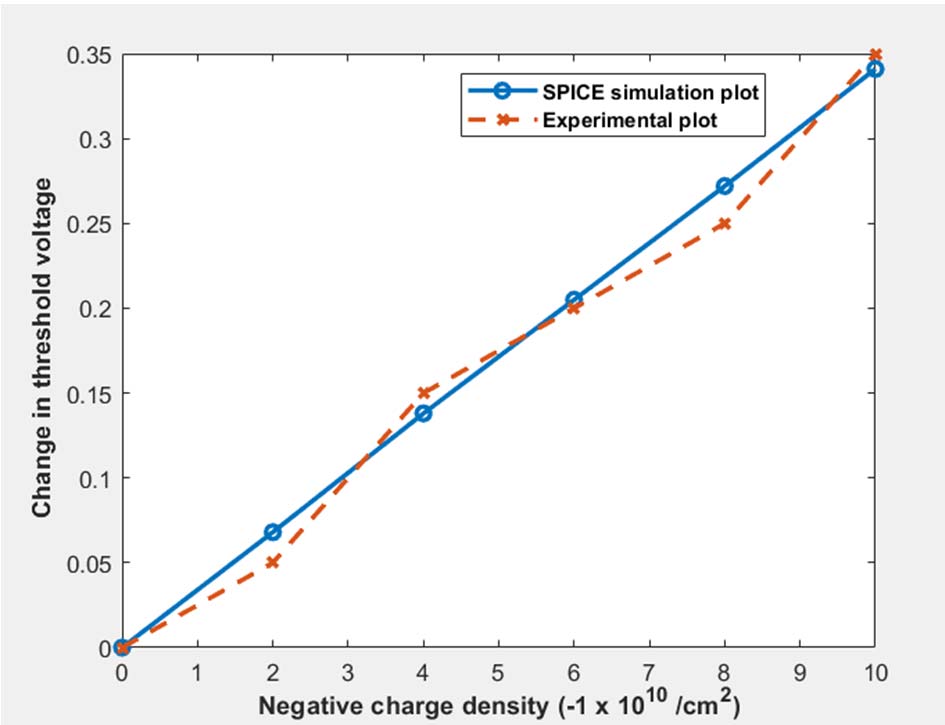
为了捕捉带电生物分子的影响,采用了SPICE三级模型中的可变参数NSS(表面态密度)。由于所考虑的生物分子(即脱氧核糖核酸)带负电荷,相应地调整了参数NSS,并记录了阈值电压的变化。图3显示了DMFET的阈值电压变化随电荷密度变化的关系曲线。可以看出,其趋势与公式(4)推导的结果一致。实验结果与仿真曲线之间的最大偏差出现在由生物分子引起的电荷密度$Q_{biomol}$等于-8 x 10^10/cm²时,该点的绝对误差为8.8%。
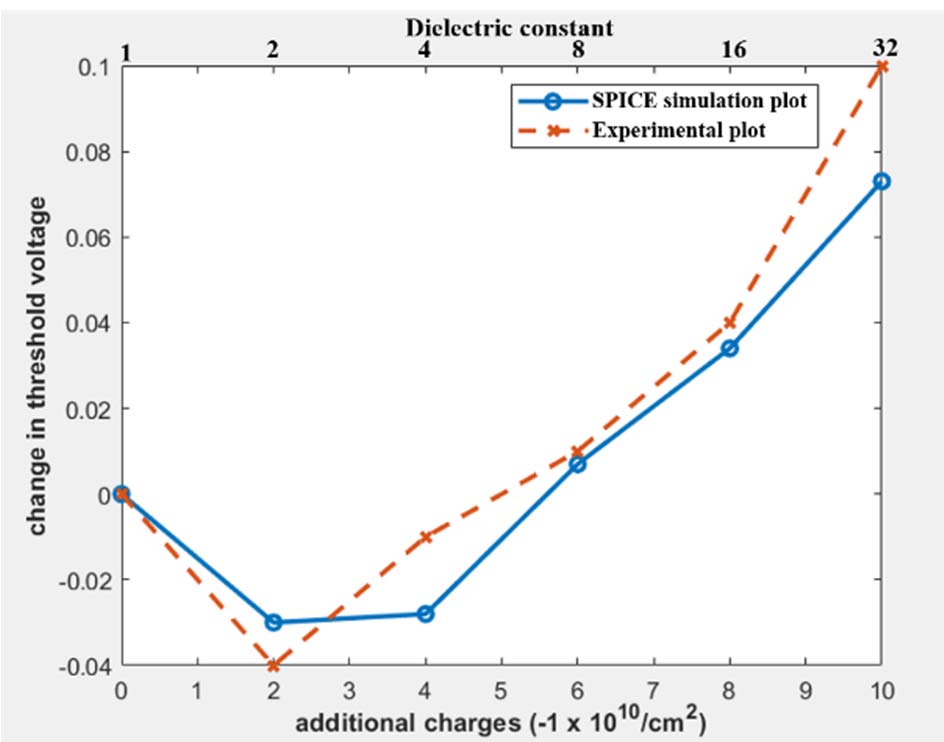
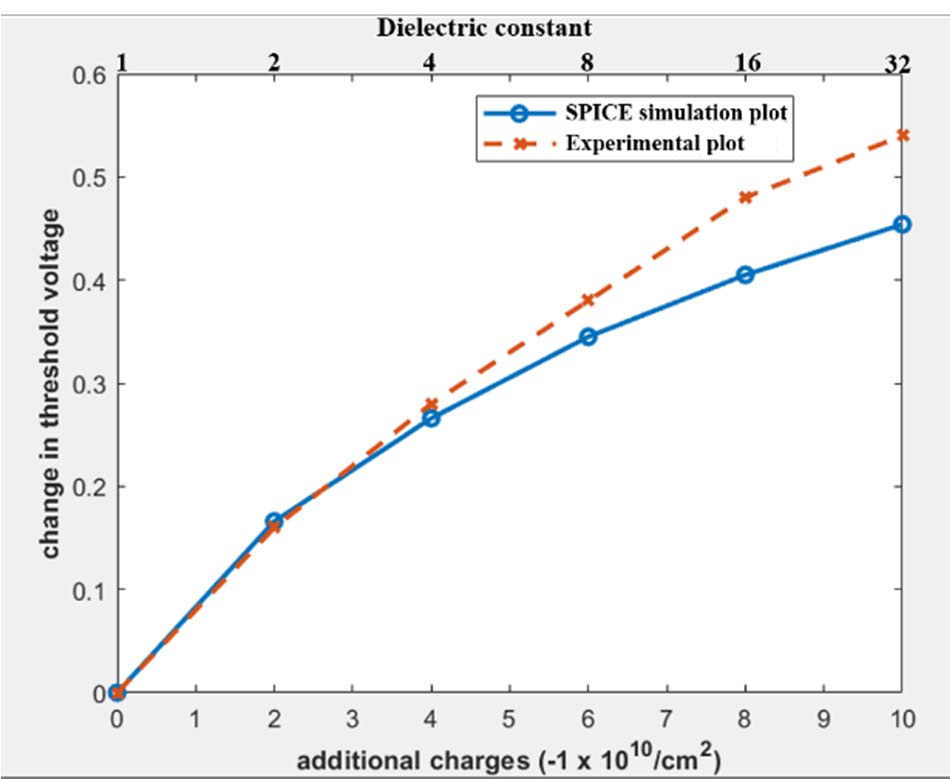
通过叠加上述两个结果,我们得到公式(5),其特性已绘制在图4中。图中显示,当$k_{biomol}$小于4时,$V_t$减小,之后则增大。实验曲线与仿真曲线(图4)之间的最大偏差出现在$Q_{biomol}$等于-10 x 10^10/cm²且$k_{biomol}$等于32时,该点的绝对误差为27%。表II列出了用于建模DMFET的所有SPICE三级模型参数。
同样,我们可以提取p沟道MOSFET的曲线图。图5是针对p沟道DMFET,同时考虑电荷变化和介电常数所绘制的。实验曲线与仿真曲线(图5)之间的最大偏差出现在$Q_{biomol}$等于-10 x 10^10/cm²且$k_{biomol}$等于32时,该点的绝对误差为18.1%。
从图4可以明显看出,对于n沟道DMFET,阈值电压变化范围为-0.04 V至0.1 V,而p沟道DMFET的阈值电压变化范围为0至0.6 V,如图5所示。这意味着在相同的宽长比和生物分子浓度下,p沟道DMFET比n沟道DMFET更灵敏。p沟道DMFET中更高的灵敏度是由于电荷变化和介电常数效应的叠加效应所致。
| 参数 | 描述和备注 |
|---|---|
| T ox (m) | 氧化层厚度。 |
| NSS (/cm²) | 表面态密度。用于定义氧化层中的固定电荷密度层。 |
| NSUB (/cm³) | 衬底掺杂密度 |
| U0 (cm² V⁻¹ s⁻¹) | 低场体迁移率。默认值对于n沟道为670 cm² V⁻¹ s⁻¹ MOSFET |
| Tpg | 用于定义栅极材料。Tpg=0 选择栅极材料作为铝 |
III. 前置电荷放大器的设计
电荷放大器用于将传感器产生的电荷转换为电压信号。它采用基本积分器拓扑,从而以电压输出的形式产生传感器注入的总电荷的积分值。它们能够轻松地将极少量的电荷转换为可被方便处理和分析的电压电平。它们通常使用运算放大器或其他高增益半导体电路,并结合负反馈电容构成。
为了测量溶液中脱氧核糖核酸或其他生物分子的浓度,需要使用读出电路。随着对便携式和植入式医疗设备的重视不断增加,具有最小面积、低噪声和低功耗的器件正被越来越多地开发出来。因此,有必要在设计读出电路时综合考虑所有这些因素。
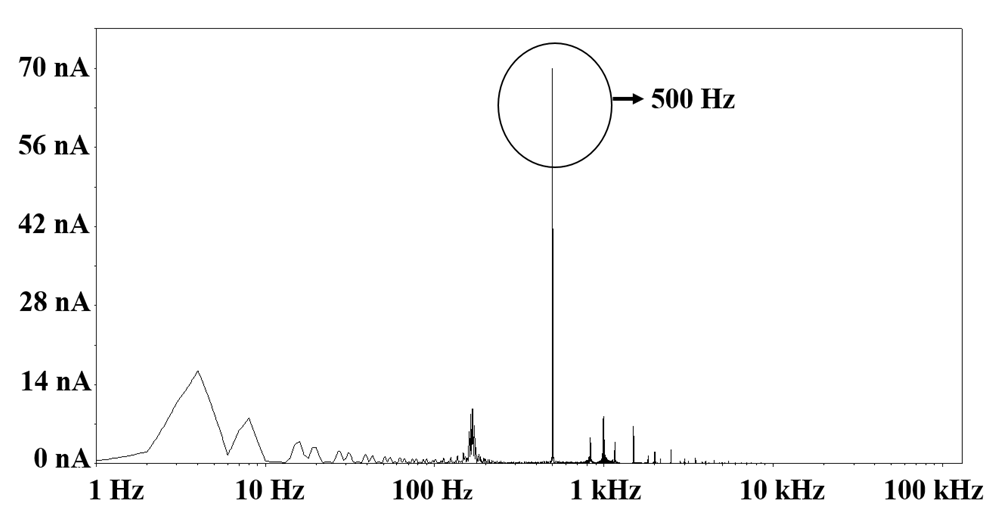
需要考虑的是,任何读出电路的主要组成部分都包括一个前端传感器(此处为电荷放大器),该传感器需将低电平电流信号转换为可用于进一步处理的电压输出[6]。本文提出的电荷放大器基于90纳米CMOS技术设计,具有极低噪声和较低的功耗。由于大多数生物传感器信号的带宽仅为几kHz,因此希望前置电荷放大器能够在较低频率范围内工作[7]。这是因为生物分子引起的栅极电压变化对传感器输出漏极电流的影响是相同的,如图6所示。观察发现,当使用500赫兹的正弦信号改变栅极电压时,传感器的输出漏极电流的基频也集中在相同频率。因此,无论栅极处信号类型如何,生物传感信号的频率与前置电荷放大器输入信号频率之间均可建立一一对标关系。
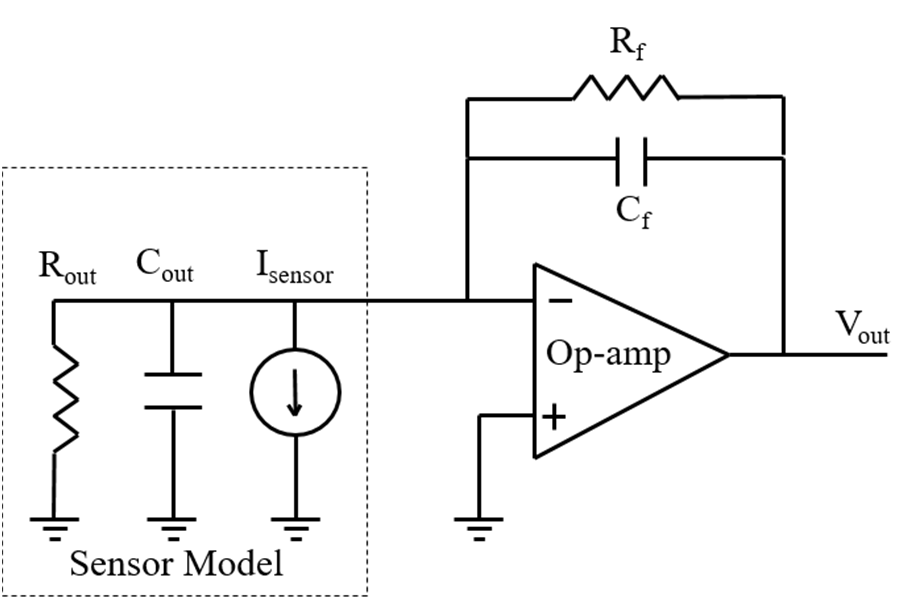
典型的电荷放大器电路图如图7[6]所示。该电路包括由反馈电阻(Rf)和电容(Cf)馈入的增益级。其中,Rout和Cout表示传感器(此处为n沟道DMFET)的输出电阻和电容。DMFET的Rout和Cout分别假设约为100千欧姆和100飞法(这些值取决于制造过程中采用的各种工艺参数)。利用关系式频率= 1/(Rout Cout),可计算出输入到传感器的最大频率约为0.1‐1吉赫兹。使用一个与电阻和电容并联的电流源来建模传感器,因为它代表了DMFET的小信号输出特性。该模型用于研究前置电荷放大器在不同输入电流信号下的输出特性。
如果忽略寄生电容和电阻,并假设放大器表现为理想状态,则传输函数可表示为:
$$
\frac{V_{out}(s)}{I_{in}(s)} = -\frac{R_f}{1+s R_f C_f}
$$
If,
$$
|s| \gg \frac{1}{R_f C_f}
$$
Then, (9) can be simplified as
$$
\frac{V_{out}(s)}{I_{in}(s)} = -\frac{1}{s C_f}
$$
此外,(11) 可以在时域中重写为:
$$
V_{out}(t) = -\frac{1}{C_f} \int i_{in}(t) dt + V_{out,0} = -\frac{\Delta Q}{C_f} + V_{out,0}
$$
其中,$V_{out,0}$ 表示输出端的初始电压。
然而,“s”的范围受到传感器的$1/(R_{out} C_{out})$的限制。
$$
|s| < \frac{1}{R_{out} C_{out}}
$$
这是一个非常大的值(大约为0.1‐1吉赫兹),因此电荷灵敏度可以在s域中由(11)给出。
A. 提出的设计
在90‐nm CMOS技术中实现的提出的预充电放大器的示意图如图9所示。该前置电荷放大器的设计考虑了传感器输出的各个方面以及前置电荷放大器对高电荷灵敏度的要求。
运放设计采用了一种简单的折叠式共源共栅结构。所选运放必须具备高增益、低噪声和低功耗的特性。因此,套筒式运放在上述各方面均优于折叠式共源共栅运放,成为优先选择。然而,套筒式运放的输出电压摆幅受限于其输入共模范围(ICMR),而折叠式共源共栅结构在大多数上述指标中提供了更大的灵活性。因此,采用了单端折叠式共源共栅结构。该结构被广泛应用于电荷放大,具有高直流增益和大频率带宽的优势[8]。该设计在输入级使用NMOS(M1和M2)而非PMOS,以提高运放的开环增益(56分贝),但代价是增加了电路的闪烁噪声。
运算放大器的输出为单端输出,M3和M5的漏极连接到M7和M8的栅极,以增大输出电压摆幅。
在设计放大器时,还考虑了各个MOSFET的噪声贡献。热噪声和闪烁噪声是MOSFET中两种主要的噪声来源。闪烁噪声对MOSFET器件总噪声的贡献与沟道面积成反比,且与漏极电流无关。相比之下,热噪声的贡献与沟道面积成反比,但随着漏极电流的增加而减小[9]。然而,本研究的目标工作频率相当低,因此MOSFET的闪烁噪声变得最为重要。因此,需要仔细设计MOSFET(M1、M2、M4、M5、M10 和 M11)的宽和长。本设计获得了995.25 μV/(Hz)^1/2 的输出参考噪声。
折叠式共源共栅结构本质上具有高输出阻抗。因此,通过调节增益级的输出阻抗(作为反馈电阻作用),该设计无需使用任何大阻值的反馈电阻即可实现所需的984.2毫伏每皮库仑的电荷灵敏度。这同时也消除了由于无源反馈电阻引入的不必要热噪声。
采用1皮法的反馈电容,以在10‐20赫兹范围内(此处为14.5赫兹)实现所需的3 dB频率。通常避免使用小于几皮法的反馈电容值,以防止由于电路输入级存在的其他寄生电容引起的电荷共享。
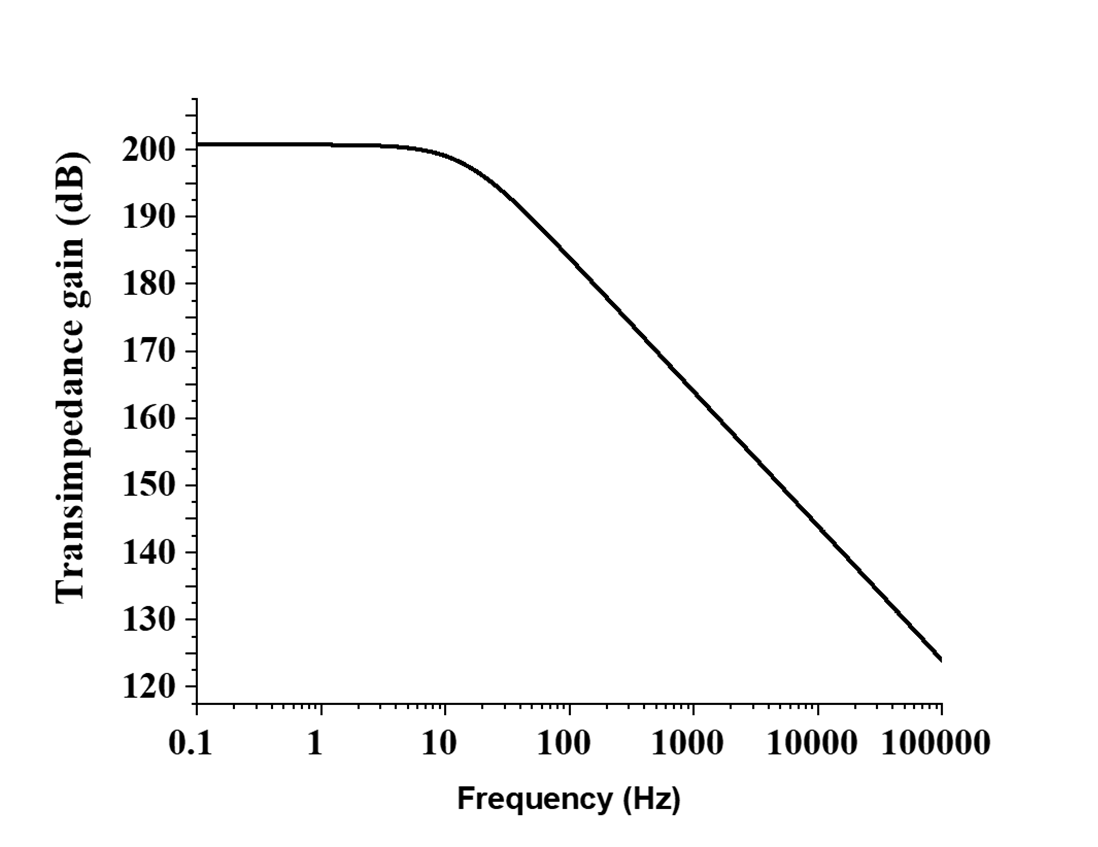
设计中采用了1.2伏特的单电源供电(总功耗为90.46微瓦)。其他所需的偏置电压通过0.5微安的电流源采用电流镜偏置在内部生成。图8显示了提出的预充电放大器的波特图,其3 dB频率为14.5赫兹,直流跨阻增益约为201分贝。
| 工艺 | 应用 | 电源电压 | 目标频率 | 反馈电容 | 电荷灵敏度 | 功率消耗 | 输出噪声 | |
|---|---|---|---|---|---|---|---|---|
| This work | 90纳米CMOS | DNA检测 | 1.2伏特 | 14.5赫兹 | 1 pF | 984.2毫伏每皮库仑 | 90.46微瓦 | 995.25微伏每赫兹^1/2 |
| 参考文献[6] | 180纳米CMOS | 生物流体温度测量 | 1.8伏特 | 30赫兹 | 100皮法 | 0.8毫伏/皮库仑 | 2.1 μW | 2.4 mV/(Hz)^1/2 |
| Ref.[10] | 离散组件 | 触觉传感器 | 3.3伏特 | 200赫兹 | 100皮法 | 10毫伏/皮库仑 | 12.5 μW | 3 mV/(Hz)^1/2 |
| 参考文献[11] | 0.7‐μm CMOS | 红外传感器 | ±2 V | 100赫兹 | 1 pF | 2200伏特/瓦特 (电压灵敏度) | 210.8 μW | – |
| Ref.[12] | – | 压力传感器 | – | 15赫兹 | 10皮法 | 8.55毫伏/皮库仑 | – | – |
B. 比较
表III显示了本研究与先前所述工作的对比分析。结果表明,该预充电放大器具有相对较低的噪声并消耗更低功耗。
C. 提出的放大器的PVT分析
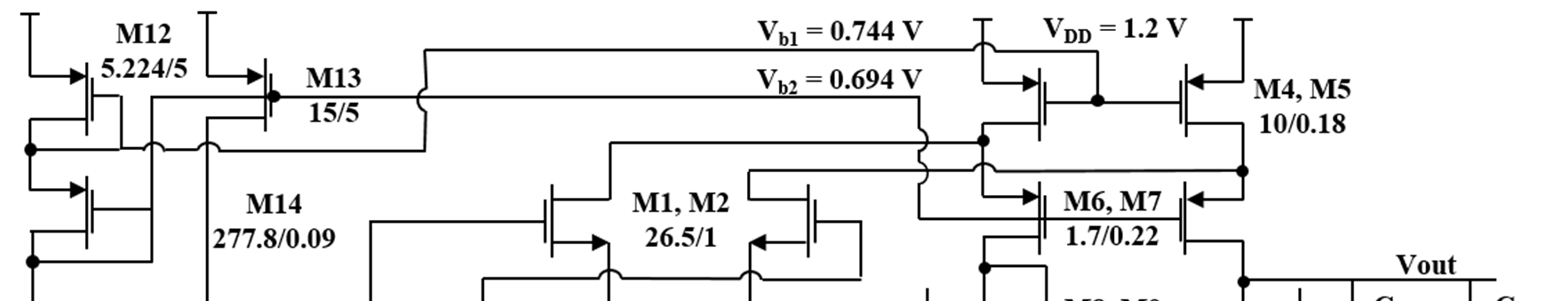
图10 (a)、(b) 和 (c) 显示了提出的前置电荷放大器的PVT分析。从PVT分析可知,该电路能够在所有工艺角下正常工作。
IV. 结论
本文提出的方法可用于在SPICE三级模型上对DMFET进行建模,并进一步用于确定任意类型的带电/不带电生物分子浓度与DMFET阈值电压变化之间的关系。研究还表明,与n型通道对应器件相比,p沟道DMFET对带负电荷的生物分子更为敏感。DMFET的输出为小信号电流,因此设计了一种前置电荷放大器,将传感器输出的电流信号转换为电压输出,该放大器功耗低(90.46微瓦),所需电源电压极小(1.2伏特)。其输出参考噪声水平相较于其他已发表的工作也较小。前置电荷放大器的PVT分析表明,其能够承受电源、随机失配和温度变化带来的影响,并能按预期正常工作。





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








