一种新型基于薄膜镍钛合金的神经血管血流导向装置的体外研究
梭形和宽颈脑动脉瘤(CAs)使用传统的血管内或外科方法治疗具有挑战性。近年来,血流导向装置被开发用于通过将血流从动脉瘤内分流而非直接闭塞来治疗这些病例。其中,Pipeline栓塞装置(PED)是目前最知名的血流导向装置,采用单层编织设计。尽管该装置在近期试验中已显示出成功效果,但PED治疗后出现迟发性动脉瘤破裂仍令人担忧。最近,新一代双层结构装置出现,其中包括一种新型高弹性薄膜镍钛合金(HE-TFN)覆盖的设计。本研究中,我们采用粒子图像测速法(PIV)比较PED与HE-TFN装置的流体动力学性能。
PED的孔隙密度为12.5–20 pores/mm²,孔隙率为65–70%。两种HE-TFN血流导向装置的孔密度分别为14.75 pores/mm²和40 pores/mm²,对应的孔隙率分别为82%和77%。传统观点认为,较低孔隙率的PED对瘤内血流的降低作用最大。然而,在生理真实脉动流条件下,在理想化物理流动模型中,动脉瘤内的均方根速度(V RMS )平均下降幅度,PED组为42.8–73.7%,而孔密度最高的HE-TFN装置组则达到68.9–82.7%。有趣的是,在同一模型中对侧支血管血流的分析还显示,HE-TFN设计比PED保留了更好的侧支灌注。在理想化模型的稳态流动条件下也观察到了类似趋势。在更具临床真实性的解剖结构动脉瘤模型中,PED在稳态和脉动流动条件下分别使瘤内V RMS 降低了64.3%和56.3%;相比之下,高孔密度HE-TFN装置在稳态和脉动流动条件下分别使瘤内V RMS 降低了88%和71.3%。我们认为HE-TFN装置更优的性能归因于更高的孔密度,这可能在改变动脉瘤流体动力学方面起到比传统血流导向装置最受关注的设计参数——绝对孔隙率更重要的作用。最后,PED在植入后导致更高的瘤内压力,这为该装置治疗后晚期破裂的潜在机制提供了见解。
引言
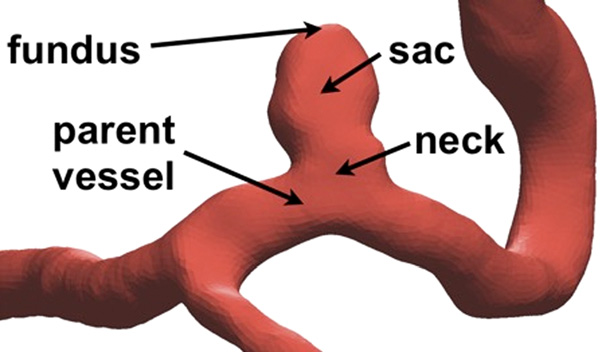
浆果状或囊状脑动脉瘤是脑血管的病理性局部扩张。图1展示了从医学影像数据重建的脑动脉瘤几何结构示例。当脑动脉瘤破裂时,血液会从脑血管系统中出血并进入脑周围空间。此类损伤在50%的情况下是致命的。每年在美国约有10,000人因脑动脉瘤破裂而死亡,全球范围内则有约50万人。因此,有效治疗以防止脑动脉瘤破裂造成的巨大公共健康危害至关重要。
幸运的是,新一代血管内装置——血流导向装置,可能为脑动脉瘤治疗问题提供更优的解决方案。例如PED(Covidien,尔湾,加利福尼亚州)和SILK血流导向装置(Balt Extrusion,蒙莫朗西,法国)均采用编织技术而非激光切割技术(传统支架通常使用激光切割)制造。编织技术可使最终产品实现更低的孔隙率。例如,PED由单层编织丝构成,其孔隙率为65–70%,而大多数激光切割支架的孔隙率为 ~90%。此处定义的孔隙率是指支架上所有孔的总面积与支架覆盖的总面积之比,孔密度则定义为支架单位面积上的孔数。先前的研究已证实了不同孔隙率的金属支架具有不同的血流导向效果。
最近,更新一代的双层血流导向装置已经出现。这些装置包括血流重定向腔内装置(Microvention,塔斯汀,加利福尼亚州)以及在加利福尼亚大学洛杉矶分校开发的HE-TFN血流导向装置。这些血流导向装置的双层结构使得设计具有更大的灵活性,因为可以将具有不同特性的层组合在一起,以实现广泛的累积性血流导向性能。例如,如图2所示,HE-TFN血流导向装置通过将可变孔径的薄膜镍钛合金网与传统的激光切割支架骨架结合而成。有趣的是,HE-TFN血流导向装置的最终孔隙率(77–82%)高于PED(65–70%),但构成该装置的材料分布在更多的孔隙上,这意味着HE-TFN血流导向装置比PED具有更高的孔隙密度。
本研究的目标是研究一种新型基于薄膜镍钛合金的血流导向装置,并将其性能与其他支架和血流导向装置类治疗方法进行比较,以确定血液动力学上有利的几何设计特征。具体而言,包括激光切割Neuroform支架(NF,Stryker Neurovascular,加利福尼亚州弗里蒙特)、PED、500微米孔径HE-TFN血流导向装置(HE-TFN-500)以及300微米孔径HE-TFN血流导向装置(HE-TFN-300)置于理想化和解剖学意义上的颈动脉模型中。随后使用粒子图像测速法(PIV)评估了有无装置时的性能表现。总体而言,HE-TFN血流导向装置的设计在本研究中表现出最优的性能。
方法
动脉瘤建模
本研究使用了两个侧壁动脉瘤的透明聚氨酯模型。图3(a)所示的理想化模型在SolidWorks(Dassault Systems,马萨诸塞州沃尔瑟姆)中设计,并按照参考文献[26]中的描述进行制造。图3(b)所示的解剖模型由患者特异性计算机断层扫描图像重建,并按照参考文献[27–30]中的描述进行制造。


装置部署
在理想化模型中测试了四种装置:NF支架、PED、HE-TFN-500和HE-TFN-300。PED和HE-TFN-300还在解剖模型中进行了测试。装置的定量特性见表1。
| 装置 | 孔密度(孔/mm²) | 孔隙率 (%) |
|---|---|---|
| NF支架 | 不适用(开孔结构设计) | 90 |
| HE-TFN血流导向装置,500微米孔径(HE-TFN-500) | 14.75 | 82 |
| HE-TFN血流导向装置, 300微米孔径(HE-TFN-300) | 40 | 77 |
| PED | 12.5–20 | 65–70 |
流动循环系统
使用Compuflow活塞泵(Shelley Medical,Toronto,ON,加拿大)在3(雷诺数411.2)、4(雷诺数548.3)和5(雷诺数685.4)毫升/秒的稳定流速下,将血液模拟液循环通过模型。血液模拟液详见参考文献[26]和[31],所选流量范围覆盖了文献中报道的正常、病变情况下的数值。以及体内的运动条件。还研究了平均脉动母管血流速率为3、4和5毫升/秒的脉动流条件。规定了针对基底动脉、周期为900毫秒的流动波形。
数据采集与处理
使用 LAVISION FLOWMASTER立体粒子图像测速法系统(Lavision, Ypsilanti, MI)测量物理动脉瘤模型内的三组分流速,如参考文献[26]和[31]所述。对于理想化模型,在每个流速下检查了流体域内的三个平面:中心平面以及从中心平面正交偏移0.5 mm的两个平面。此处定义的中心平面为包含母血管和动脉瘤主轴的平面,该平面相对于图3的方向与页面方向平行。为了测量解剖模型流体域的范围,共获取了五个平面。每个模型在每个平面上采集了一组200对图像。调整图像对之间的图像间时间间隔,以将动脉瘤囊内的粒子位移限制在3到10像素之间。对于脉动情况,在早收缩期(108ms)、中期舒张期(450毫秒)和舒张期(810毫秒)采集PIV数据。
每对图像的速度矢量在 DAVIS软件(Lavision,密歇根州伊普西兰蒂)中使用多遍递归互相关算法进行计算,最终查询窗口大小为 16×16像素,50%重叠。随后,针对每个模型的动脉瘤囊(取其中速度大小的均方根),以及理想化模型的穿支,计算了均方根速度大小(V RMS )。在动脉瘤囊(一个流动再循环的闭合血管)中,V RMS 是评估支架类治疗血流动力学成功的一个公认指标。当血液在动脉瘤内流动更慢时,发生凝血的可能性更大,从而启动一系列事件,使机体能够自然修复动脉瘤。而在穿支血管(一个开放的血液流经的血管),V RMS 与体积流量成正比,因此V RMS 的减小是不利的,因为血管内流动减少会降低远端组织灌注。
压力测量
在解剖模型中使用液体填充的压力换能器系统(哈佛仪器公司,马萨诸塞州霍利斯顿)测量瘤内压力。如图3(b)顶部所示,在动脉瘤底部微钻一个0.4毫米直径孔,并在动脉瘤底部放置一根液体填充导管。每个稳定流速下的测量持续12秒周期。对于脉动情况,至少捕获十个周期,然后对相位锁定测量值进行平均。
结果
动脉瘤内血流速度
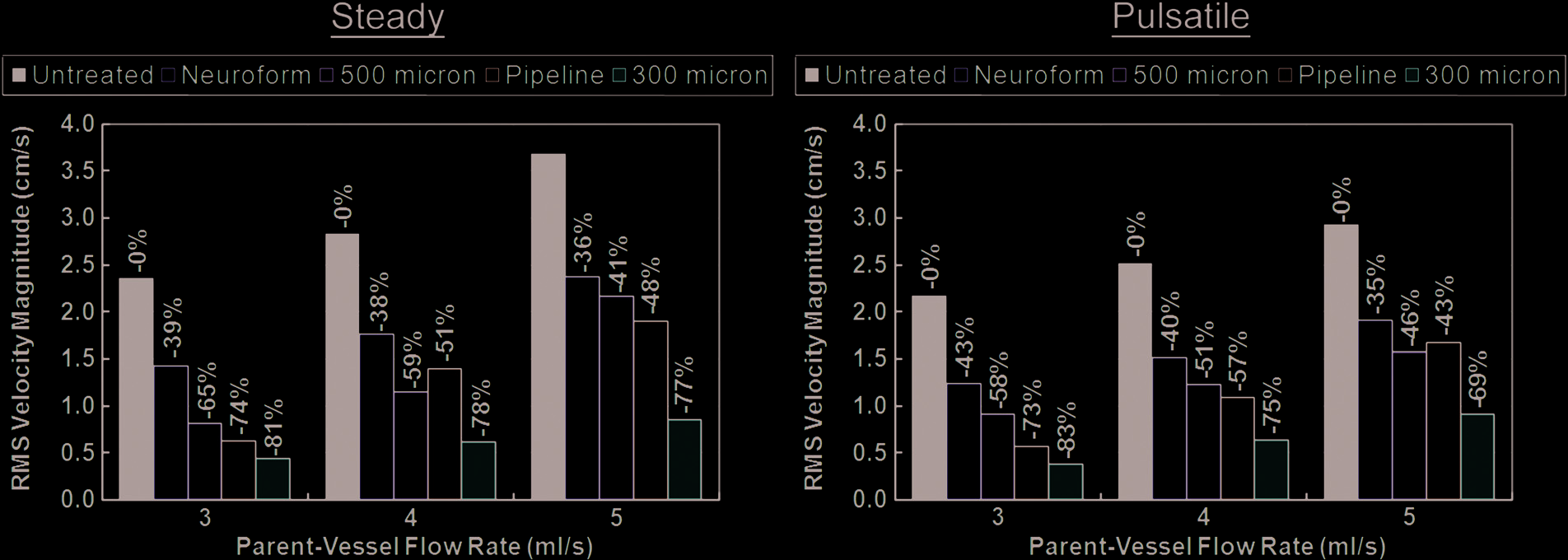
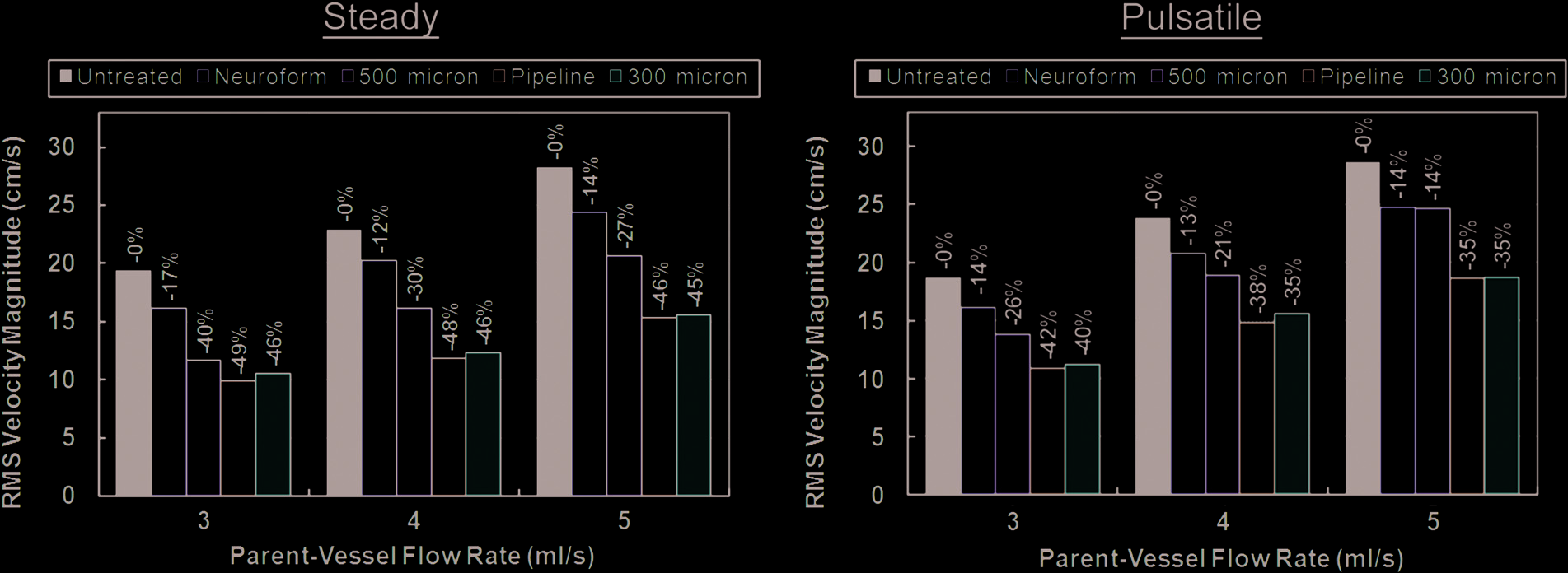
在理想化模型中,装置部署导致动脉瘤体积内的V RMS 显著降低,如图4所示。与无装置情况相比,平均降低百分比从NF支架的38.5%到HE-TFN-300的77.2%(涵盖所有测试的流量和类型)。PED导致V RMS 平均降低57.7%,HE-TFN-500导致平均降低53.4%。
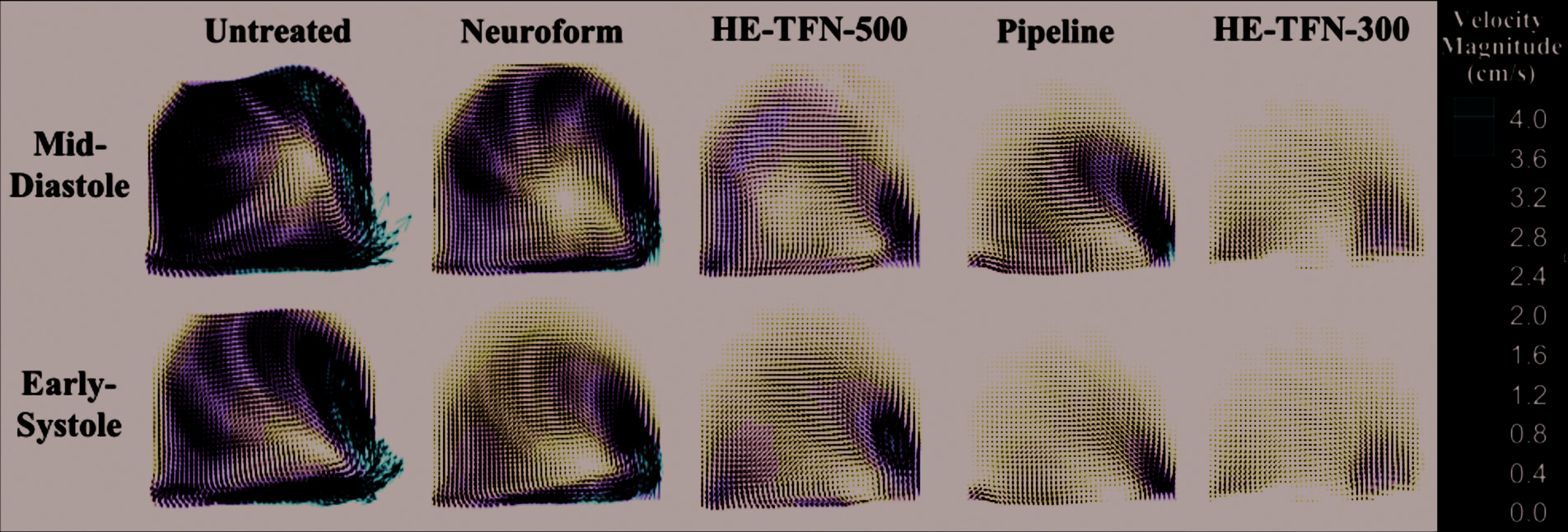
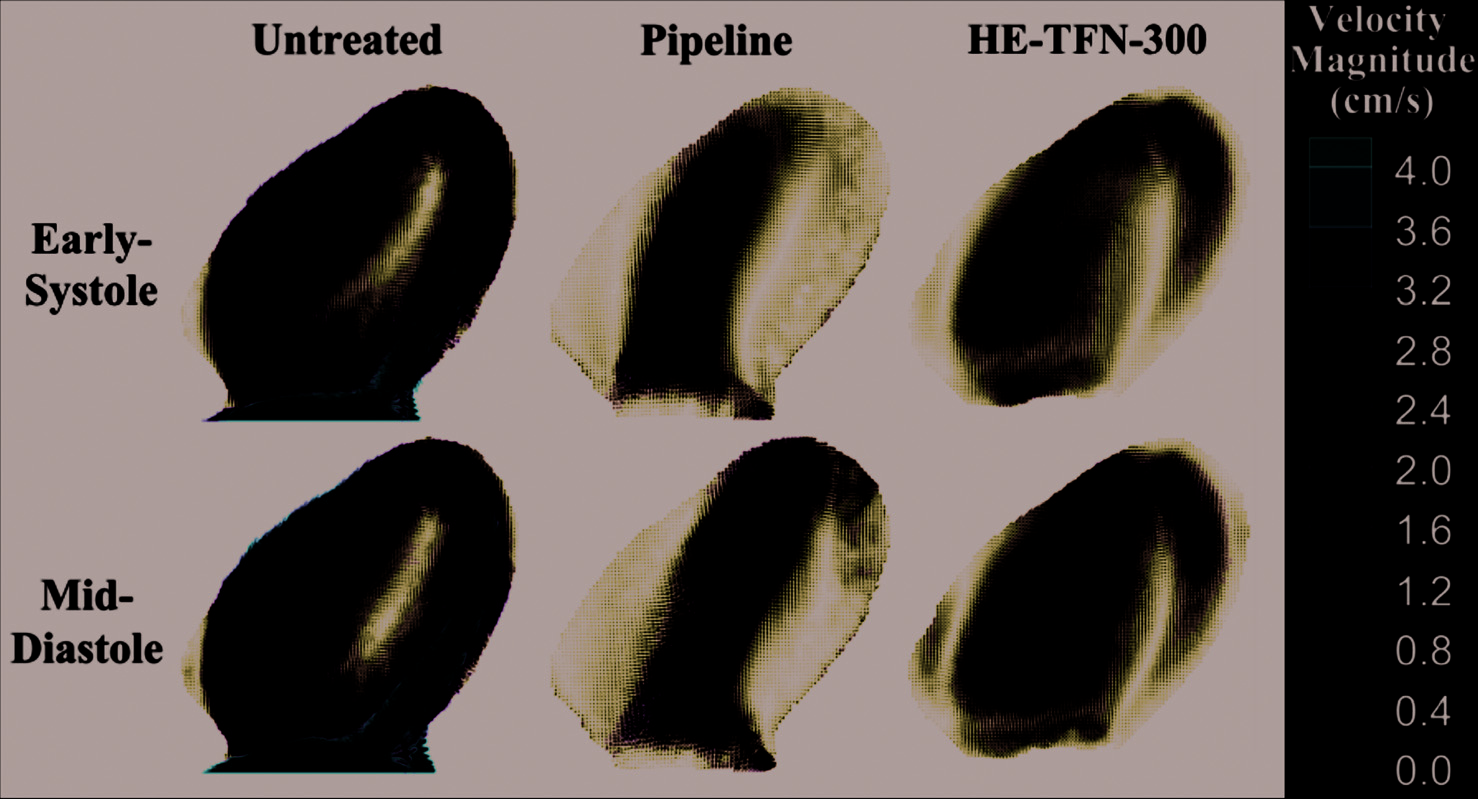
尽管在V RMS 理想化的颈动脉模型内的减少程度因不同的血流导向装置治疗而异,但其中的流动模式相似,如图5所示。每种治疗均导致在动脉瘤远端(右侧)形成一股射流,并发展为循环流动。
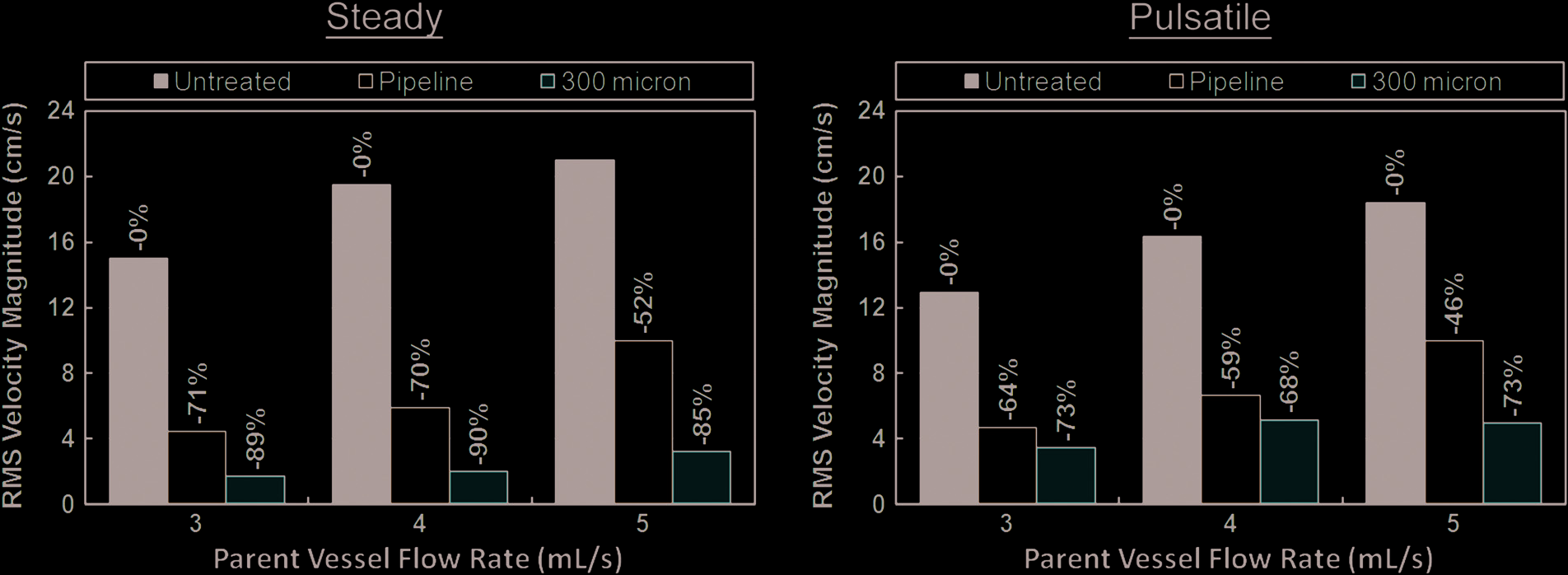
使用工程设计中的标准工具评估矩阵,根据性能对理想化模型中测试的四种装置进行了排名。具体而言,这些装置基于以下四个权重相同的指标,采用四分制进行评分:植入难易程度(由植入医生评定)、瘤内血流速度(速度越低越好)、穿支动脉血流速度(速度越高越好)以及瘤内血流模式(血流越弥散越好)。本研究的理想化阶段中,两种装置表现明显更优(即 HE-TFN-300和PED)。随后,这两种装置在解剖模型中进行了更详细的分析。图6显示了在解剖模型情况下,这两种装置所实现的V RMS 降低情况。PED引起的降低幅度显著,在稳态和脉动流条件下分别平均降低了64.3%和56.3%。然而,HE-TFN-300的降低幅度几乎高出近20%,在稳态和脉动流动条件下,平均分别为88%和71.3%。
与理想情况不同,在解剖学模型中,血流模式因所使用的治疗装置而表现出显著差异。如图7所示,PED和HE-TFN-300均降低了整体速度大小;然而,PED导致射流冲击动脉瘤囊的顶端,而HE-TFN-300则产生更弥散的瘤内血流。
穿支动脉血流速度
如图8所示,NF支架导致穿支动脉V RMS 的百分比降幅最低(即允许最多的穿支动脉血流通过);在所有测试的流量和类型下,平均降低了14%。相比之下,PED和HE-TFN-300对血流的降幅最大,在所有流动条件下降幅均超过35%。然而,尽管在动脉瘤囊内造成最大血流减少(临床有利)的是HE-TFN-300,但在穿支动脉中造成最大血流减少(临床不利)的则是PED。
动脉瘤内压力测量
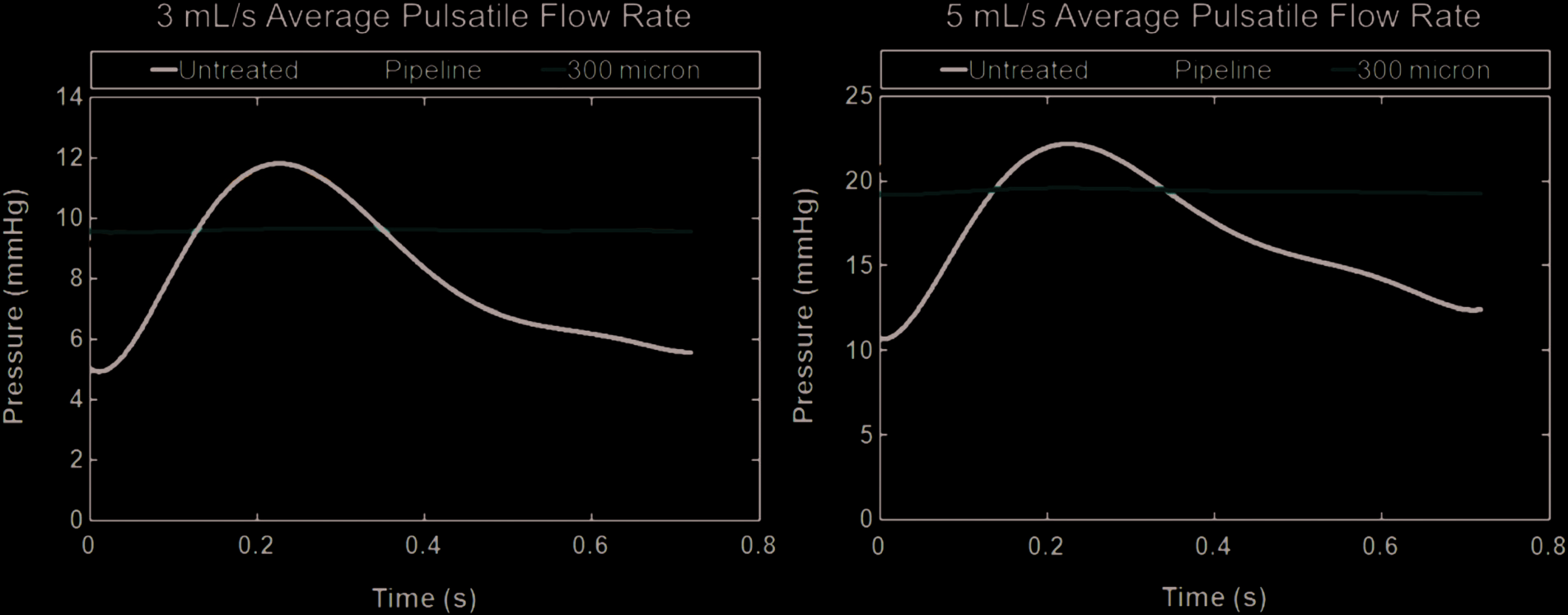
图9显示,与无装置情况相比,PED和HE-TFN-300均导致压力升高,且在部署任一血流导向装置后,脉动血流波形出现衰减。然而,PED引起的压力升高最为显著(甚至达到高于无装置情况在5毫升/秒流入时观察到的峰值压力的水平)。请注意,尽管模型内的绝对压力未保持在生理范围内,但模型上的压力降保持在生理范围内。
讨论
在比较本研究中表现最佳的两种血流导向装置时,HE-TFN-300对动脉瘤内V RMS 的降低程度优于PED。这一发现引人关注,因为传统观点认为,动脉瘤颈部较低的孔隙率与更显著的瘤内血流减少相关。然而,本研究观察到的结果恰恰相反,即具有较高孔隙率的HE-TFN-300表现更优。我们推测这可能归因于HE-TFN-300更高的孔隙密度(相较于PED)。尽管使用PED时在动脉瘤颈部覆盖的材料总量更多,但HE-TFN-300的材料在颈部区域分布更为均匀。这与本研究中观察到的更低的瘤内血流速度相关,该现象可能由器械孔隙周围的边界和惯性效应所解释。孔隙密度的重要影响还进一步体现在HE-TFN-300与HE-TFN-500之间性能的巨大差异上:两者的孔隙率相近(分别为75%和80%),但孔隙密度差异显著(分别为40孔/mm²和14.75孔/mm²)。类似的研究结果也支持这一点。
HE-TFN-300增加动脉瘤压力的程度也小于PED。这一发现具有重要意义,因为近期研究已对使用血流导向装置治疗后出现的迟发性破裂表示担忧,这可能与动脉瘤压力升高有关,正如在解剖模型结果中针对PED所观察到的情况。相比之下,HE-TFN-300支架引起的压力升高明显低于PED,且与PED及无装置情况相比,还减小了心动周期内动脉瘤内压力的变化范围。穿支血流速率的测量结果也更支持HE-TFN-300支架的设计,因其治疗后穿支血流减少程度最小,意味着更高的灌注水平,这在临床上更为理想。我们认为,HE-TFN-300更高的孔隙密度(从而支柱更细小)使其更难以完全闭塞细小的分支血管。
本研究存在若干局限性,值得注意。首先,仅考虑了两种血管几何结构,且它们代表了在血流动力学上略有不同的情况。具体而言,解剖学案例(除了更为复杂外)包含一个轻微弯曲的母血管,众所周知,这与直的母血管相比会产生不同的血流动力学效应。然而,HE-TFN-300在两种几何结构中均表现出最佳性能,这表明该新型器械在提供有利的血流动力学设计参数组合方面具有较强的鲁棒性。其次,本文所呈现的研究完全是实验性的,而采用虚拟器械模型进行更高分辨率的计算研究可进一步阐明血流导向装置设计参数如何影响动脉瘤内的血流。此类研究还应考虑器械通透性和压降系数,这些是流体动力学参数,可能比器械的几何参数与血流动力学结果的相关性强。最后,尽管本研究探讨了一系列相关的流动条件,但未考虑凝血因子和血液制品的影响。
结论
传统观点认为,低孔隙率的血流导向装置比高孔隙率的血流导向装置更能降低瘤内血流。然而,本研究的相反结果支持了一个重要发现:仅凭孔隙率并不能确定在不同血流导向装置中哪一个实际能最大程度地将血流从动脉瘤内分流出。总体而言,在理想化动脉瘤模型和解剖动脉瘤模型中,在稳态和脉动流条件下,HE-TFN-300装置的设计表现最佳。与PED相比,HE-TFN-300(具有更高的孔隙率和孔隙密度)在导航和部署时提供了更大的灵活性,更显著地降低了瘤内V RMS ,实现了更好的穿支动脉灌注,并维持了更低的瘤内压力。后一发现可能尤为重要,因为在使用血流导向装置治疗后,瘤内压力升高可能是导致迟发性破裂的相关解释。




















 481
481

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








