生物材料的化学本体性质
摘要
生物材料由不同类别的已知材料制成,包括金属和合金、陶瓷、玻璃以及天然和合成聚合物。这种材料的多样性源于生物材料在体内通常需要满足的不同应用需求。特定生物材料性能的基础是其原子和分子水平上的组成和结构,这决定了材料的化学性质及其在生物体内的最终行为。本章旨在介绍描述主要材料类别中原子键合及其相应分子结构的基本概念。将讨论这些材料的分子结构与其所表现出的化学行为之间的主要关联,以更好地理解和预测这些材料在与生命物质接触使用时的性能。
关键词 生物材料 Molecular结构 Chemistry Reactivity
1 引言
属于主要材料类别的多种不同生物材料,即金属、陶瓷和聚合物,被用于医学领域的植入物、假体、导管、支架、伤口敷料、心脏瓣膜、骨水泥、人工晶体及其他医疗器械。
如今,众所周知,用于人体内或人体上的医用材料的体相和表面性质会强烈影响组织‐材料界面的动态相互作用,并常常决定该材料的成败。
生物材料的体相和表面性质由其结构决定(Dee et al. 2002)。在原子级别,材料的特征表现为不同类型的强(主要)原子间键:共价键、离子键和金属的键。除了这三种强键外,还有几种弱(次要)键显著影响材料性质,尤其是天然和合成聚合物。这些弱键包括氢键、范德华键或疏水相互作用(Cooke 2004)。
材料的性能与其原子键合的性质相关。由于大多数生物材料是固体,固体中原子或离子的三维排列是特定材料最重要的结构特征之一。通常,原子或离子在三维空间中以有序重复的方式排列,这种排列称为晶体结构。晶体结构使原子紧密堆积,即具有最大可能数量的邻近接触的邻居,从而最大化强键的数量并同时最小化聚集体的能量。因此,具有高结晶度的生物材料通常与由原子非规则三维排列所表征的无定形材料具有截然不同的性能。不仅包括密度、硬度、熔化或沸点温度、溶解度、电导率或强度在内的宏观物理性质,而且诸如反应性、电负性、生物降解性、耐腐蚀性、酸性/碱性等化学特性也由特定材料的原子结构决定。特别是对化学降解的敏感性,根据具体的医学应用可能是期望的或不期望的,这是生物材料的一个重要特征。
与材料的体相相比,其表面在化学反应性方面 inevitably 存在差异。由于每个表面都是材料三维结构的终止,表面一侧的原子缺少近邻原子,从而改变了这些原子的电子性质。因此,表面原子比体相原子具有更高的反应性。为了降低自由能,表面原子倾向于与任何可获得的反应性分子结合,以达到更有利的能量状态。当生物材料被植入体内时,它将被一种含有多种活性物质(如离子、蛋白质、酶和其他带有反应性官能团的生物分子)的具有攻击性的多组分水介质所包围。这将在材料‐组织界面引发复杂的化学相互作用体系,从而决定引入材料的生物相容性及其在体内的正常功能。因此,研究材料‐组织界面的化学相互作用是开发具有高生物接受性和高功能性的植入材料的关键要素。
根据其主要的原子和分子结构,本章将讨论不同类别的生物材料的化学行为,特别参考它们在人体内所暴露的条件。
2 水在生物材料与生命物质相互作用中的作用
水是人体和其他生物体中的主要化学成分。它约占所有细胞重量的70%,且细胞内的大多数反应都在水介质中进行(Vogler 2004)。在一个水分子中,两个氢原子通过共价键与一个氧原子相连。电负性氧吸引电子的能力远强于氢,导致氢原子带有净正电荷,而氧原子带有净负电荷(图 1)。由于这些原子上的电荷存在,水分子具有净偶极矩。当一个带正电区域(即其两个氢原子)的水分子接近另一个水分子的带负电部分时,静电吸引可能形成一种弱相互作用,称为氢键。水中的氢键比共价键弱得多,且性质上是瞬时的,仅持续很短的时间。但每个水分子可以通过其两个氢原子与两个相邻的水分子形成氢键,从而形成三维(3D)网络。为了说明这一特性,普通化学中常见的路易斯酸性和碱性概念可能是一个有用的工具(Vogler 2004)。路易斯酸是指能够从供体分子接受电子或更广义地说接受电子密度的分子;相反,路易斯碱则是电子密度的供体。水是一种两性分子,其中氢原子作为路易斯酸,接受来自邻近水分子中作为路易斯碱的氧原子上的未共享电子对的电子密度。在此概念下,水通过路易斯酸‐碱自缔合反应形成三维(3D)网络。
这种倾向于自缔合并形成三维网络结构的一个非常重要的化学结果是,水作为溶剂对含有正负电荷的离子以及醇类、糖类、脱氧核糖核酸、核糖核酸和大多数蛋白质等极性化合物表现出特定的行为。离子键或极性化合物被尺寸相对较小(*3 Å)的水分子包围(“水合”)。水分子的部分负偶极端被溶质中的带正电组分吸引,而正偶极端则相反(Vogler 2004; Alberts et al. 2002)。
与亲水性物质相反,烃类等主要为非极性的疏水化合物无法被水溶解。非极性物质倾向于在水溶液中聚集,并将水分子排出。这种疏水效应是脂质形成双分子层的基础,而双分子层是生命的关键结构要素之一。此外,该效应还驱动了蛋白质折叠,这在生物材料中具有重要意义,因为它参与了蛋白质在材料表面的反应,例如在材料表面发生的变性。
在表面,水表现出不同的相互作用行为。在通常称为亲水的表面上,水会铺展开来;而在称为疏水性的表面上,水则会形成水珠。利用路易斯酸碱理论,可通过是否存在能够与水分子相互作用、竞争氢键并破坏体相水结构的路易斯酸或碱官能团,来区分亲水表面和疏水性表面(图2)。
细胞对生物材料的反应是决定生物医学植入物成功的关键因素。人们认为,这种生物反应是通过与材料相同薄层区域内的物质相互作用而发生的,该区域的厚度不超过几纳米,影响材料的水润湿性(Vogler 2004)。
此外,人们进一步认为,细胞并不直接与材料表面本身相互作用,而是与结合在
植入材料表面的蛋白质相互作用。当材料一接触血液时,蛋白质吸附过程几乎立即发生。因此,细胞到达表面后所接触到的并非生物材料表面,而是覆盖在生物材料上的蛋白质涂层。沉积的蛋白质以特定方式与细胞相互作用的性质和能力决定了最初的细胞反应以及随后的宿主反应。人们普遍认为,材料表面的润湿性在蛋白质和细胞与水合界面的相互作用过程中起着重要作用,可能是通过破坏或置换所谓的近邻水层实现的,该水层与表面结合的程度取决于原始水‐表面相互作用的强度(Voglerfi)。)
除了水作为生物材料表面的溶剂和润湿剂所具有的独特作用外,水还可直接作为化学试剂攻击可生物降解材料结构。大多数合成设计降解高分子材料(如聚乳酸及其共聚物)会发生水解敏感键的断裂。小水分子能够扩散进入高分子结构,根据水解降解速率与扩散速率的比值,可能仅在材料表面发生表面侵蚀过程,或发生不同程度的均匀本体侵蚀过程。由于水具有上述的路易斯酸碱特性,体液中含有的催化物质(如酸或酶)能够断裂聚合物中的极性连接,例如酯键。对于聚乳酸而言,会生成乳酸,而乳酸是动物体内肌肉收缩的天然产物。
总体而言,水是生物系统中的积极参与者,其在许多生化过程甚至化学反应中的特殊媒介作用必须被考虑,以研究生物材料与周围组织之间的复杂相互作用。
3 不同类别的生物材料的化学性质
目前用于生物医学应用的生物材料包括金属和合金、陶瓷以及聚合物。如上所述,这些材料的化学性质及其应用潜力由其原子和分子结构决定。下文将综述三大类生物材料的基本结构方面,并联系其特定的化学性质进行讨论。
3.1 金属和合金
三种不同类型的金属材料主导了医学应用领域:不锈钢、钴铬钼合金和钴镍合金,以及纯钛和钛合金(表 1)。在较小程度上也使用金合金、铂族金属和钽(Park 和 Kim 2003;Pilliar 2009)。
金属的特征是具有金属原子间键合。在原子级别上,金属由带正电荷的离子核组成,其价电子形成围绕金属离子的松散电子云。它们由重复的晶胞构成,每个晶胞中包含特定数量的原子,这些原子处于特定位置,以最大化最近邻原子之间的接触数目。在已知晶体晶格结构的各种晶胞中,作为生物材料使用的金属和合金通常形成面心立方、体心立方或六方密堆晶胞(图3; Cigada et al. 2002)。相邻原子的紧密排列以及共享的电子云导致金属键具有非定向性,并且金属内部的电子运动比具有离子或共价键合的材料更容易。
这些金属键的特定特性决定了此类生物材料共有的性能,尤其是许多金属的高强度、塑性变形能力以及高热导率和电导率。尽管具有这些有利性能,纯金属通常太软、脆或容易迅速腐蚀。为了克服这些缺点,金属通常以合金形式使用,例如316L不锈钢、钴铬钼合金和钛合金。合金由两种或更多种不同的金属或非金属元素(如碳、氢)组成,通常通过将组分共同熔化来制造。
| 元素 | 不锈钢 | 钴铬钼 | 纯钛 | Ti‐6Al‐4V |
|---|---|---|---|---|
| 元素 | 316L | F75(Vitallium) | 工业纯钛,4级 | |
| Fe | 60–65 | 最大值 0.75 | 最大值 0.5 | 最大值 0.25 |
| Cr | 17.00–20.00 | 27.0–30.0 | ||
| Ni | 12.00–14.00 | 最大值 2.5 | ||
| Mo | 2.00–3.00 | 5.0–7.0 | ||
| Mn | 最大值 2.0 | 最大值 1.0 | ||
| Co | 58.9–69.5 | |||
| Ti | 余量 | 88.9–90.8 | ||
| Al | 5.5–6.5 | |||
| V | 3.5–4.5 | |||
| Cu | 最大值 0.5 | |||
| Si | 最大值 0.75 | 最大值 1.0 | ||
| C | 最大值 0.03 | 最大值 0.35 | 最大值 0.10 | 最大值 0.08 |
| N | 最大值 0.1 | 最大值 0.05 | 最大值 0.05 | |
| P | 最大值 0.025 | |||
| S | 最大值 0.01 | |||
| O | 最大值 0.40 | 最大值 0.13 | ||
| H | 最大值 0.0125–0.015 | 最大值 0.0125 |
与上述理想晶体结构相比,实际的金属晶体中含有遍布结构的晶格缺陷,如空位、位错或晶界。这些缺陷的存在显著影响了金属材料的物理和化学性质。
金属或金属合金在生理环境中浸入可能导致腐蚀,这是一种电化学过程,导致金属材料的降解(Pourbaix 1984;Virtanen 2008;Angelini 等 2002)。植入物的腐蚀降解不仅意味着质量、机械稳定性和功能性的丧失,更重要的是腐蚀产物释放到活体组织中,并产生腐蚀电流,该电流常常对植入物周围的细胞造成细胞毒性或过敏反应,此外,在腐蚀副产物被运输至体内远处位置后,也可能对身体远端部位的细胞造成影响。
当电化学反应在人体内的金属表面发生时,会发生腐蚀 fluid 作为复杂电解质。会发生两个反应:阳极氧化(1),产生金属阳离子,以及阴极反应,在该反应中(1)产生的电子被消耗。具体的阴极反应取决于电解质的性质。
$$ \text{Me}(s) \rightarrow \text{Me}^{2+} (aq) + 2e^- \quad (1) $$
$$ 2\text{H}^+ (aq) + 2e^- \rightarrow \text{H}_2(g) \quad (2) $$
$$ \text{O}_2(g) + 4\text{H}^+ (aq) + 4e^- \rightarrow 2\text{H}_2\text{O}(g) \quad (3) $$
$$ \text{O}_2(g) + 2\text{H}_2\text{O}(aq) + 4e^- \rightarrow 4\text{OH}^-(aq) \quad (4) $$
最重要的反应是氢还原(2)以及在酸性条件下溶解氧的还原(3)和在中性或碱性溶液中的还原(4)。
作为基本原理,阳极氧化反应的速率必须等于阴极还原反应的速率( Williams 和 Williams 2004)。从热力学角度考察腐蚀时必须考虑到,当金属与溶液接触时,由于溶解反应的吉布斯自由能 $DG$ 小于逆反应的吉布斯自由能,因此会发生金属离子的净溶解。这使得金属带有净负电荷,从而使得阳离子更难离开表面,并增加溶解反应的 $DG$。最终会达到一个点,此时溶解反应的 $DG$ 等于逆反应的 $DG$。在此点达到动态平衡,且在围绕金属的带电双层上建立起电势差。该电势差是金属的一个特征参数,可在标准条件下相对于标准氢电极进行测量,以获得该金属的标准电极电位。标准氢电极电位列表(表2),称为电化学序列,是判断金属材料在水介质中反应性的一般指南。
位于列表顶部的金属是相对不活泼的贵金属,而位于列表底部的是最活泼的金属。
因此,理论上可以根据标准电极电位预测腐蚀。然而,无论标准电极电位如何,许多金属的耐腐蚀性都强烈地受到其钝化能力的影响。由于这一原因,一些具有负标准电极电位的金属和合金,如钛和钴铬合金,可以在医学中用作外科植入物。
| 金属 | 反应 | 电位(V) |
|---|---|---|
| Gold | $\text{Au}^{3+} + 3 e^- \rightleftharpoons \text{Au}$ | 1.498 |
| 铂 | $\text{Pt}^{2+} + 2 e^- \rightleftharpoons \text{Pt}$ | 1.188 |
| 钯 | $\text{Pd}^{2+} + 2 e^- \rightleftharpoons \text{Pd}$ | 0.987 |
| 银 | $\text{Ag}^+ + e^- \rightleftharpoons \text{Ag}$ | 0.799 |
| 汞 | $\text{Hg}^{2+} + 2 e^- \rightleftharpoons \text{Hg}$ | 0.788 |
| 铜 | $\text{Cu}^{2+} + 2 e^- \rightleftharpoons \text{Cu}$ | 0.337 |
| 氢 | $2 \text{H}^+ + e^- \rightleftharpoons \text{H}_2$ | 0.0 |
| Tin | $\text{Sn}^{2+} + 2 e^- \rightleftharpoons \text{Sn}$ | -0.136 |
| 钼 | $\text{Mo}^{3+} + 3 e^- \rightleftharpoons \text{Mo}$ | -0.200 |
| 镍 | $\text{Ni}^{2+} + 2 e^- \rightleftharpoons \text{Ni}$ | -0.250 |
| 钴 | $\text{Co}^{2+} + 2 e^- \rightleftharpoons \text{Co}$ | -0.277 |
| Iron | $\text{Fe}^{2+} + 2 e^- \rightleftharpoons \text{Fe}$ | -0.440 |
| 铬 | $\text{Cr}^{3+} + 3 e^- \rightleftharpoons \text{Cr}$ | -0.744 |
| 钽 | $\text{Ta}^{5+} + 5 e^- \rightleftharpoons \text{Ta}$ | -0.810 |
| 锆 | $\text{Zr}^{4+} + 4e^- \rightleftharpoons \text{Zr}$ | -1.539 |
| 钛 | $\text{Ti}^{2+} + 2 e^- \rightleftharpoons \text{Ti}$ | -1.630 |
| 钙 | $\text{Mg}^{2+} + 2 e^- \rightleftharpoons \text{Mg}$ | -2.360 |
| $\text{Ca}^{2+} + 2 e^- \rightleftharpoons \text{Ca}$ | -2.870 |
由于这些金属或合金具有高反应性,它们能够与环境空气中的氧气发生反应,在植入金属表面形成一层不溶性、薄且非常稳定的氧化物或氢氧化物层,从而保护底层金属。所形成的氧化物或氢氧化物具有陶瓷性质,意味着它们是电绝缘体,可减少或完全阻止电化学反应。因此,氧化物或氢氧化物层的稳定性决定了整体的耐腐蚀性。
目前,金属或合金作为永久性植入物在临床上应用于内假体、牙科植入物、心血管支架或起搏器外壳。在所有这些应用中,腐蚀或其他类型的降解都是不良反应,会危及植入物的成功。因此,大量的研究致力于开发耐腐蚀金属植入材料。然而,在某些情况下,植入物仅需在人体内临时使用,例如用于支持组织再生或从合适载体释放药物。在完成其功能后,这些材料能够可控且完全地降解是有利的,因为无需手术取出植入物,且不会在体内留下可能引起不良反应的异物材料。
已知的可生物降解材料,如聚合物、生物玻璃或不同类型的磷酸钙,已被临床应用于缝合线、骨固定材料、骨替代材料及其他类型的植入物。近年来,包括镁、铁或锌在内的金属或金属合金也被广泛研究,以用作可生物降解植入物(Niinomi et al. 2012; Witte et al. 2008; Chen et al. 2014)。在这类金属中,迄今为止只有镁及其合金受到广泛关注,旨在将生物降解能力与金属优良的力学性能相结合,开发出可用于承重植入物的植入材料。
正如从镁在电化学序中的位置所预期的那样,传统的铸态镁材料会与水发生反应,生成氢氧化镁和氢气,总反应如下(5):
$$ \text{Mg}(s) + 2\text{H}_2\text{O}(aq) \rightarrow \text{Mg(OH)}_2(s) + \text{H}_2(g) \quad (5) $$
氢氧化镁能在水中起到腐蚀防护层的作用,但由于在介质中氯离子浓度升高时会转化为高溶解度的氯化镁,从而失去这种功能。大量氢气的不受控释放是镁及其合金在临床应用中的主要担忧。
在过去的十年中,人们提出了各种策略,通过持续调整和控制镁及镁合金的降解速率来解决这一问题。这些方法包括制备超高纯镁、利用合金元素设计具有特定微观结构(尤其是晶粒细化)的镁合金,以及为镁植入物开发无机或有机(聚合物)涂层(Hornberger 等,2012;Reifenath 等, 2011)。
生物材料的化学本体性质
3.2 陶瓷和生物活性玻璃
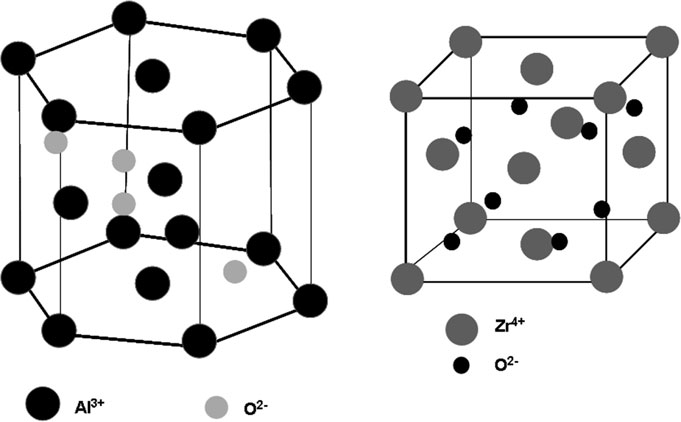
陶瓷和玻璃是由金属和非金属元素通过离子键和/或共价键结合而成的材料(Park 2008;Turner 2009)。其中以离子键为主的陶瓷由带正电的金属和带阴离子电荷的非金属组成。通常,阴离子形成规则的三维晶格,为阳离子提供间隙位点,使其能够适配并实现理想的配位。晶体单元中阳离子和阴离子的排列必须满足离子半径比的要求,并确保适当的电荷平衡。例如,在氧化铝中,氧离子(O²⁻)形成密堆积的六方晶胞,其中八面体位点的三分之二被铝离子(Al³⁺)占据(图4,左)。相比之下,另一种重要的生物陶瓷氧化锆则形成面心立方晶胞,其中锆(Zr⁴⁺)构成骨架,氧离子(O²⁻)占据四面体位点(图4,右)(Turner 2009)。在这两种结构中,离子均呈紧密堆积的有序排列,从而在整个结构中形成强离子键。在以共价键合为主的陶瓷中,相邻原子共享电子,导致在整个结构中形成数量固定的强方向性键。这类陶瓷通常具有扩展的链、片层或三维网络结构特征。
某些陶瓷如果熔化后在冷却过程中不会形成晶体结构。其单个原子几乎具有理想数量的最近邻原子,但在整个结构中并未保持有序重复排列。这类化合物被称为玻璃。玻璃陶瓷是可以通过两步过程转化为细晶粒多晶材料的玻璃,其中包括析晶过程。
基于上述陶瓷、玻璃和玻璃陶瓷的结构多样性,显然这些材料在化学行为上存在显著差异,包括生物降解和表面反应性。
陶瓷和玻璃的降解机制和降解速率取决于其特定的化学组成和结构。临床上使用的氧化物陶瓷氧化铝和氧化锆被视为几乎不发生降解的生物惰性材料,而磷酸钙和各种生物玻璃则是具有不同降解速率的众所周知的可生物降解材料。
氧化铝和氧化锆由于其惰性,具有较高的生物相容性和组织非致敏性,在与其他材料(尤其是金属)相比时具有显著优势(Turner 2009;Chevalier 2006)。它们优异的体内耐磨性和摩擦性能使其适用于人工关节表面。尽管这两种陶瓷都具有较高的抗压强度,但它们相对较脆,容易发生拉伸断裂。
用于植入体制备的氧化铝大多为高纯度(>99.5%)的多晶高密度材料,或人工生长的单晶材料(Park 2008)。在多晶材料中,决定其力学性能的关键因素是晶粒尺寸、晶粒尺寸分布和孔隙率。氧化铝在温度高达2000 °C时仍保持热力学稳定。
氧化锆的化学性质比氧化铝更复杂。氧化锆可根据温度和环境以三种不同的相存在。单斜相在900–1220 °C时转变为四方结构,而该四方结构在 2370 °C时进一步转变为立方相。四方相向单斜相转变时伴随着3–5%的体积膨胀(Park 2008)。因此,从烧结温度冷却纯氧化锆会导致开裂。因此,骨科级氧化锆含有少量稳定剂(5 wt% Y₂O₃, 2 wt% HfO₂, 和0.5 wt% Al₂O₃),用于实现稳定化。超过95%的氧化锆处于亚稳四方相,其余部分为立方相或单斜相氧化锆(Park 2008)。晶粒尺寸保持在0.5μm以下,以确保四方相在生理条件下保持稳定(Park 2008)。在过去几十年中,一种有前景的方法是研究将氧化铝与氧化锆结合于复合陶瓷中,从而形成所谓的氧化铝增韧氧化锆(ATZ)或氧化锆增韧氧化铝(ZTA)弥散陶瓷(Piconi et al. 2003;Gadow和Kern 2010)。这些材料表现出改善的力学性能,尤其是更高的断裂韧性和可靠性(De Aza et al. 2002;Kelly和 Denry 2008)。
生物活性陶瓷由于能与组织发生主动相互作用而得名,主要包括磷酸钙,这是一类复杂的化学化合物,其中最突出的成员是羟基磷灰石和磷酸三钙。
磷酸钙的行为直接取决于其化学组成和结构。羟基磷灰石类似于骨和牙的矿物相,结晶为六方菱形棱柱(图5)。它由PO₄³⁻四面体构成,中心为P⁵⁺离子,四个角上为O²⁻离子。类似地,(OH)⁻基团通过离子键结合。
羟基磷灰石可以通过不同的方法从各种含钙和含磷的起始化学品以及生物来源合成。重要的合成方法概述见表3。
| Procedure | Starting materials | Synthesis conditions | Properties of HA |
|---|---|---|---|
| Solid-state reaction | Ca₃(PO₄)₂+ CaCO₃ Ca₂P₂O₇+ CaCO₃ | 900–1300 °C | Ca/P= 1.67, large grain size, irregular forms |
| Wet chemical method | Ca(NO₃)₂+(NH₄)₂HPO₄ Ca(OH)₂+ H₃PO₄ | r. t. to 100 °C, pH= 7–10 | Ca/P< 1.67, fine irregular crystals, low crystallinity |
| Emulsion method | Ca(NO₃)₂+ H₃PO₄ | H₂O/cyclohexan, PEG-nonylphenol pH= 7, r. t.—80 °C | Usually non-stoichiometric, small size(nano, narrow distribution) |
| Hydrothermal method | Wet chemically prepared HA, other calcium phosphates | 100–200 °C(1–2 MPa), 300–600 °C(1–2 kbar) | Ca/P= 1.67, fine single crystals or large crystals, often needle-like morphology |
| Sol-gel preparation | Gel+ Ca²⁺ PO₄³⁻, e.g. Ca(OC₂H₅)₂+ P(OC₂H₅)₃ | r. t.—60 °C, pH= 7–10 | Other calcium phosphates as impurities |
| Molten salt synthesis | (NH₄)₂HPO₄+ Ca(NO₃)₂ K₂SO₄, KCl, KBr, CaCl₂ | 1080–1200 °C | Ca/P* 1.67, Large crystals |
| Mechano-chemical preparation | CaHPO₄+ CaO(CaCO₃) | High-energy mechanical activation | Usually non-stoichiometric CaP ratio, small crystals, diverse morphology |
| Synthesis from biogenic sources | Biowaste(bovine bones, fish-scales, egg shells), coral, sea shell | Various processes(calcination, hydro-thermal process) | Ca/P* 1.67, diverse morphology, high degree of crystallinity |
羟基磷灰石的合成路径和条件极大程度影响其物理和化学特性,尤其是吸收速率。所获得的羟基磷灰石的质量通常以理论化学计量Ca/P比值1.67为参考标准。在羟基磷灰石结构中,晶格中的离子容易被其他外来离子取代。例如,羟基或磷酸根离子可被碳酸根、羟基或氟离子取代,磷酸根离子可被硅酸根离子取代,钙离子可被镁离子取代(Hench和Best 2004)。
羟基磷灰石在碱性溶液中不溶,但在酸性溶液中可溶。在蒸馏水中,羟基磷灰石仅微溶,但加入电解质后其溶解度增加。烧结羟基磷灰石的溶解度非常低。羟基磷灰石具有高度生物相容性,这似乎是由于其能与硬组织中存在的蛋白质、脂质及其他有机化合物直接发生化学结合所致。
除了羟基磷灰石外,还有多种其他磷酸钙,它们在化学组成、结构和特性性能上有所不同。表4概述了用于医疗应用的这些磷酸钙。
| Ca/P 比率 | 化合物 | 化学式 | −log Ks | g/l | pH 稳定性 |
|---|---|---|---|---|---|
| 0.5 | 磷酸二氢钙 一水合物 | Ca(H₂PO₄)₂·H₂O | 1.14 | *18 | 0.0–2.0 |
| 0.5 | 磷酸二氢钙 无水 | Ca(H₂PO₄)₂ | 1.14 | *17 | a |
| 1.0 | 磷酸二钙 二水合物(Brushite(二水磷酸氢钙)) | CaHPO₄·2H₂O | 6.59 | *0.088 | 2.0–6.0 |
| 1.0 | 磷酸二钙 无水(Monetite) | CaHPO₄ | 6.90 | *0.048 | a |
| 1.33 | 八磷酸钙 | Ca₈(HPO₄)₂(PO₄)₄·5H₂O | 96.6 | *0.0081 | 5.5–7.0 |
| 1.5 | α‐磷酸三钙 | α‐Ca₃(PO₄)₂ | 25.5 | *0.0025 | b |
| 1.5 | β‐磷酸三钙 | β‐Ca₃(PO₄)₂ | 28.9 | *0.0005 | b |
| 1.2–2.2 | 无定形钙 磷酸盐 | CaₓHᵧ(PO₄)z·nH₂O;n= 3–4.5, 15–<20% H₂O | 25–33c | c | 5–12d |
| 1.5–1.67 | 缺钙的 羟基磷灰石 | Ca₁₀−ₓ(HPO₄)ₓ(PO₄)₆ₓ(OH)₂−ₓ | *85 | *0.0094 | 6.5–9.5 |
| 1.67 | 羟基磷灰石 | Ca₁₀(PO₄)₆(OH)₂ | 116.8 | *0.0003 | 9.5–12 |
| 2.0 | 四钙磷酸盐 | Ca₄(PO₄)₂O | 38–44 | *0.0007 | b |
a 在100摄氏度以上温度下稳定; b 该化合物无法从水溶液中沉淀出来; c 无法精确测量; d 始终处于亚稳态
一些研究表明,在体内吸收α‐磷酸三钙的过程中会形成羟基磷灰石。由于磷酸钙的降解速率随着钙磷比的降低而增加,因此Ca/P比为1.5的磷酸三钙相比羟基磷灰石被更快地吸收。
原则上,不同磷酸钙的生物降解(吸收)速率是这些材料的一个主要应用相关特性,受到多种因素的影响:
- 化学参数(钙磷比、原子和离子取代、杂质)
- 物理特性(压实状态、晶粒微观结构、孔隙率、结晶粒尺寸、表面积)
- 理化溶解,取决于特定磷酸钙的溶度积和环境的局部pH值
- 生物因素(植入物周围细胞类型、吞噬作用、年龄、性别、激素水平)。
大约30年前,人们首次发现某些组成的玻璃和玻璃陶瓷能够与骨结合(Hench first discovered that certain compositions of glass and glass-ceramics are able to bond to bone (Hench 1988))。后来观察到,某些玻璃组成甚至能与软组织结合(Wilson et al. 1981)。
进一步研究表明,适当规定确定玻璃的组成可控制这种结合的速率。通过研究广泛的玻璃组成范围,发现骨结合反应会随组分而变化(Jones 2013)。
原则上,生物玻璃由SiO₂, Na₂O、CaO和P₂O₅以不同比例组成(Hench 和 Best 2004)。与传统的钠钙玻璃相比,二氧化硅在玻璃组成中的含量低于 60 mol%,且玻璃中含有相对较高量的钠和钙,以及较高的钙磷比,这有助于促进羟基磷灰石晶体的形成,而二氧化硅和氧化钙可作为结晶核。著名的生物玻璃45S5含有45 wt% SiO₂,、24.5 wt% Na₂O和CaO,以及6 wt% P₂O₅,从而得到约为5:1的钙磷比。已研究了其他多种组成变化。重要的是,氧化铝的含量必须低于3 wt%以避免抑制骨结合。近年来开发的其他玻璃和玻璃陶瓷示例及其组成见表5。
| 成分 | 45S5 生物玻璃 | 生物活性陶瓷体 | A−W GC | Bioverit III |
|---|---|---|---|---|
| SiO₂ | 45 | 40–50 | 34.2 | |
| P₂O₅ | 6 | 10–15 | 16.3 | 45–55 |
| CaO | 24.5 | 30–35 | 44.9 | 13–19 |
| Na₂O | 24.5 | 5–10 | 11–18 | |
| CaF₂ | 0.5 | |||
| MgO | 4.6 | |||
| Al₂O₃ | 6–18 | |||
| 结构 | 玻璃 | 玻璃陶瓷 | 玻璃陶瓷 | 逆向玻璃 |
在人体的水环境中,生物活性玻璃会发生快速的表面反应,从而与组织结合(Hench 和 Best 2004)。在某些情况下,接触一周后即可在界面处检测到矿化骨。这种高水平的生物活性得益于玻璃与周围体液之间的离子自由交换。离子向水介质中的溶解被认为是反应的第一步(Hench and Best 2004)。由于传统玻璃与具有更开放硅酸盐网络结构的生物活性玻璃之间存在结构差异,生物活性玻璃在接触水溶液(例如体液)时开始溶解并释放离子(Hench 1991)。据认为,对于45S5生物玻璃而言,由于玻璃网络持续发生水解,会释放出可溶性硅酸盐物种(Brauer 2015)。在生理条件下释放钙和磷酸根离子会迅速导致过饱和,并沉积形成富含CaO–P₂O₅的非晶层。进一步结合碳酸根、氢氧根和氟离子等其他离子,最终形成结构类似于羟基磷灰石的非晶类磷灰石层。有机生物活性物质(蛋白质、糖胺聚糖)的吸附以及细胞的黏附进一步促进了与骨的结合。
3.3 聚合物
用于医疗应用的聚合物种类繁多,包括天然生物聚合物,特别是蛋白质、多糖、糖胺聚糖、多核苷酸和天然橡胶,以及合成聚合物,如聚烯烃、聚酯、聚醚、聚碳酸酯、聚酰胺、聚氨酯、聚(醚‐醚‐酮)、聚砜和硅酮。
聚合物是由大量被称为单体的低分子量分子结合而成的大分子。这些单体含有一个或多个反应性功能位点,可通过化学或酶促聚合反应与其他单体反应形成聚合物。大多数聚合物具有高分子量,通常在10⁴–10⁷ g mol⁻¹之间。
需要注意的是,聚合物的分子量不像小分子那样具有唯一值(Parisi et al. 2015)。聚合反应通常生成一系列在单体单元数量上不同的大分子混合物,即得到具有平均分子量和特定分子量分布的聚合物。两种具有统计意义的分子量定义是数均分子量Mn和重均分子量Mw,其中Ni为物种i的摩尔数,Mi为物种i的分子量Mi。比值Mw/Mn称为多分散指数PI,用于衡量分子量分布的宽度。
$$ M_n = \frac{\sum N_i M_i}{\sum N_i} \quad (6) $$
$$ M_w = \frac{\sum N_i M_i^2}{\sum N_i M_i} \quad (7) $$
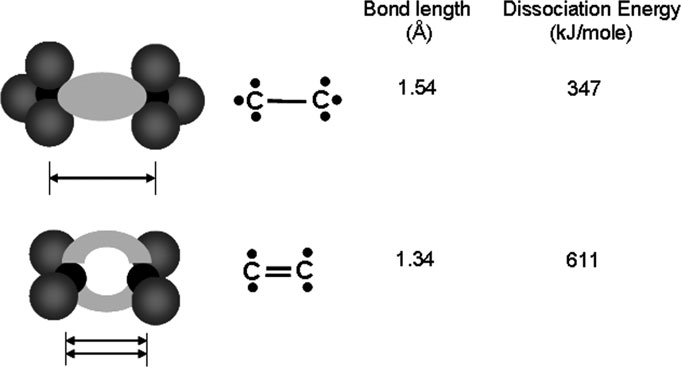
聚合物中的原子主要通过共价键连接。当两个原子共享一对或多对价电子从而形成稳定的电子壳层时,就会形成这些键。与电子从一个原子转移到另一个原子的离子键不同,在共价键合中,形成的电子对属于两个原子共有,使每个原子都达到相当于外层电子壳层填满的稳定电子构型。共价键受成键原子电负性的影响。电负性相等的两个原子会形成非极性共价键,例如C–C。成键原子之间电负性不同时,则形成极性共价键,例如C–N。共价键合包括多种相互作用,如聚合物中的σ键以及许多单体或共轭聚合物中的π键(见图6)。σ键可沿键轴几乎自由旋转,而在C=C π键中,由于其键长比 C–C单键更短,因此失去了这种旋转性。
除非大分子发生交联,否则它们通过氢键和范德华键以及缠结相互作用。由于聚合物中的化学键具有共价键特性,且除导电聚合物外,聚合物中的电子是局域化的,因此它们是热和电的不良导体。
根据来源,聚合物有多种分类方式:来源于植物和动物的天然聚合物、通过化学改性天然聚合物得到的半合成聚合物,以及“人工合成”的合成聚合物;此外,也可根据不同的结构参数进行聚合物分类。
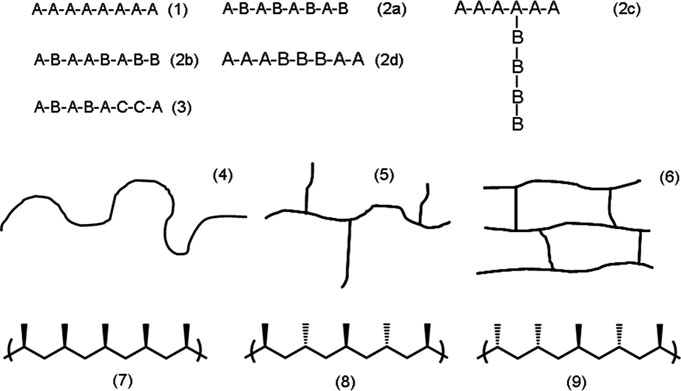
- 单体类型(均聚物 (1),见图 7),仅包含一种类型的单体;共聚物 (2) 或 三元共聚物 (3),由两种或多种单体合成,并可根据链中重复单元的排列方式进一步区分为:交替共聚物 (2a)、嵌段共聚物(2b)、接枝共聚物(2c) 和 无规共聚物 (2d)
- 链结构(线性聚合物 (4) 含有长而直的链,支化聚合物 (5) 沿主链带有不同长度的线性侧链,交联聚合物 (6) 由通过多功能单元相互连接的长线性链构成的三维网络)。
- 立构规整度(全同立构聚合物 (7),其侧基位于聚合物主链的同一侧;间同立构聚合物 (8),其侧基呈交替排列;以及 无规立构聚合物 (9),其侧基呈随机排列)。
- 分子间作用力(弹性体 以聚合物链之间弱吸引力为特征,形成具有高弹性程度的非晶态材料,热塑性塑料 以中等强度的分子间作用力为特征分子间作用形成可热加工材料,以及由于加热过程中发生交联而无法熔化的热固性材料。
- 分子量(低聚物的分子量范围为500至5000 g/mol⁻¹,高分子量聚合物的分子量范围为10⁴–10⁶ g/mol⁻¹)。
根据上述结构特征,聚合物可以形成高度有序的结晶性、半结晶性或无定形结构。通常在一个聚合物中可以同时存在结晶区域和无定形区域。
合成聚合物主要通过两种聚合机制合成:逐步-增长聚合 和 链式聚合。
在逐步增长聚合反应中,含有羧基、羟基或氨基等功能单元的活性单体通过化学缩合反应延伸而连接在一起,并释放出水或醇等低分子量副产物(图 8)(Cooper 等,2004)。
形成的逐步增长聚合物(例如见图 9)在加入被消除的小分子后可降解为其起始单体。
$$ \ce{HO-R-OH + HOOC-R’-COOH ->[{}] R-O-C(O)-R’-C(O)-O-R + H2O} \quad (8) $$
R, R’:烷基,芳基,烷基芳基
n: 1,2....数千
聚酯(例如聚对苯二甲酸乙二醇酯、聚乳酸)、聚酰胺或聚氨酯是典型的逐步增长聚合物。
相比之下,链式聚合是通过双键的打开将不饱和单体连接起来(图10)。目前已知的链式聚合主要有三种类型,即自由基聚合、离子键(阳离子和阴离子)聚合和配位聚合。通常情况下,链式聚合反应需要一个引发步骤(9),以生成第一个活性单元并启动链增长。在随后的链增长反应(10)中,单体被添加到正在增长的聚合物链的反应位点上,该聚合物链由单键构成的全碳骨架组成。最后一步是终止反应(11),其中反应性端位失去活性。
聚乙烯、聚苯乙烯和聚甲基丙烯酸酯等众所周知的聚合物是通过链式聚合机理生产的(图11)。这两种聚合反应在多个方面有所不同,包括聚合物分子尺寸增加的速率、达到高单体转化率所需的时间、反应机理、活性中心的存在以及终止反应(Parisi 等人,2015)。
聚合物性能在很大程度上受其组成、链结构和侧基以及分子量的影响。由于具有长链,聚合物不能完全结晶,但许多聚合物会形成由无序(非晶态)和有序晶区组成的半结晶结构。增加分子量会导致聚合物链更长且移动性降低,从而形成更刚性的材料。同时,聚合物链的长度应保持一致,因为如果存在短链,它们将起到增塑剂的作用。改变主链和侧链的化学组成也会改变聚合物性能。在–C–C–链中用氧气取代主链碳原子会降低熔化温度和玻璃化转变温度。
因为链的柔韧性增加(Lee等,flexible 2003)。同样地,在线性聚合物中增大侧链尺寸会降低结晶度,从而导致熔点下降。关于它们的化学性质,聚合物之间存在显著差异。对于生物材料应用而言,一个关键参数是其在生理介质中的行为。
通常,聚合物在体内不会发生明显的化学变化,在较长时间内也不会显著降解,这类聚合物被称为生物惰性材料。这些聚合物的特征是具有特定的结构单元,如–C–C–、–C–O–C–或–Si–O–Si–主链。含有更多极性单元的聚合物,如聚酰胺、聚氨酯或聚酯,如果其主链中包含较长的脂肪族或芳香族结构单元,或经过交联处理,也可具备耐降解性。此类材料的例子包括聚酰胺6.6、聚对苯二甲酸乙二醇酯和交联聚硅氧烷弹性体。这些聚合物中的许多本质上是疏水性的,如聚丙烯、聚四氟乙烯、聚醚醚酮,但也包括广泛对细胞呈惰性且为非降解材料的亲水性高分子材料,如聚乙二醇、聚乙烯基吡咯烷酮和聚(2‐羟乙基甲基丙烯酸酯)。
与生物惰性聚合物不同,有些聚合物材料会主动与生物体的组分相互作用,并刺激特定的细胞反应。在这些材料中,最突出的是天然聚合物,例如蛋白质(Srichana和Domb 2009;Yannas 2004),如胶原蛋白、白蛋白、纤维蛋白原和弹性蛋白,以及多糖(Dräger等 2011;Kaplan 1989)和糖胺聚糖,如肝素、硫酸类肝素、硫酸软骨素,甚至非硫酸化的透明质酸(Volpi 2006;Schnabelrauch等 2013)(图12)(表 6)。
胶原蛋白虽然是哺乳动物中不含化学活性侧链的结构蛋白,但在细胞粘附和调控方面具有多种功能。肝素是一种高硫酸化糖胺聚糖,已被用作强效抗凝剂多年医学领域已有多年应用(Gray 等人,2012)。含有特定功能基团的半合成或合成聚合物也可能具有生物活性。除了聚阴离子聚合物(例如戊聚糖多硫酸酯)外,一些聚阳离子聚合物也被证明具有生物活性。某些带有季铵基团的聚合物对多种细菌或真菌具有活性,可增强细胞抗原摄取,并表现出抗肿瘤活性(Kenawy 等人,2007)。聚乙烯亚胺是一种合成阳离子聚合物,主要被研究作为非病毒载体(Godbey 等人,1999)。
| 蛋白质 | 结构 | 化学性质 |
|---|---|---|
| 胶原蛋白(银和 Garg 1997年; Khan et al. 2011) | 由3个组成的蛋白质家族 螺旋排列的多肽链 每条具有通式序列 –甘氨酸‐X‐Y‐(X 常为脯氨酸,Y常为 羟脯氨酸);例如胶原蛋白 I:33% 甘氨酸,25% 脯氨酸和 羟脯氨酸,天然分子量 胶原蛋白>100,000 克/摩尔 | 三螺旋胶原蛋白存在 仅在酸性溶液中(薄膜和 海绵形成)且不 在中性pH值下水溶性; 在体内可降解; 通过交联实现稳定化 (例如戊二醛) |
| 明胶(Keenan 1997年) | 胶原蛋白的衍生物, 单链大分子 通过破坏胶原蛋白的三螺旋 结构而形成, 酸或碱水解 | 在宽pH范围内水溶性 范围;热可逆溶胶‐凝胶 转变;化学 交联以调节在 体内降解 |
| 白蛋白 (Doppalapudi 等人。 2015;Sewald和 Jakubke 2002) | 球状蛋白家族 (最常见的是血清白蛋白), 非糖基化的,低分子 质量(*66 千道尔顿),富含 谷氨酸和天冬氨酸 (20–25%)以及亮氨酸和 异亮氨酸(高达16%),以及 半胱氨酸(二硫键) | 易结晶的 水溶性,等电 点 *4.6,两性电解质(能够 可逆结合阴离子和 阳离子),高结合容量 用于钙‐、钾‐、钠离子、脂肪酸 和药物 |
| 纤维蛋白原(韦塞尔 and 塞德霍尔姆‐威廉姆斯 1997年) | 大型复杂糖蛋白 (分子量:340 kDa)由3组成 非相同的对, 同源肽链 通过二硫键交联 以及2对N‐连接的 寡糖 | 转化为不溶性, 由作用形成的交联纤维蛋白 凝血酶(血块形成, 纤维蛋白粘合剂) |
| 弹性蛋白(Gagner 等人 2014) | 纤维蛋白(分子 量*72千道尔顿)由 三维纤维网络的 疏水性和亲水性 区域;高含量的 甘氨酸、丙氨酸、缬氨酸和 脯氨酸;在广泛 交联的、亲水的 区域 高赖氨酸含量 | 橡胶状弹性行为 通过嵌段结构和 交联,该过程被执行 通过赖氨酸衍生交联剂 (锁链素) 使用 铜依赖性酶 赖氨酰氧化酶 |
这些活性的主要机制基于对带负电荷的细胞外表面的吸引和泄漏。
由于大多数天然聚合物的亲水性及其多官能团特性,这些材料注定会形成水凝胶——一类能够吸附大量水分的独特材料。水凝胶是交联聚合物网络,在溶胀状态下具有中等到较高的物理、化学和机械稳定性。它们模拟了人体中许多软组织的自然状态(Omidian 和 Park 2010)。通过选择合适的起始材料和加工技术,可以针对特定应用设计水凝胶的结构和性能。此外,各种水凝胶能够通过改变其性能来响应环境中的微小变化,这使得水凝胶在许多生物医学应用中成为有价值的材料。一些天然聚合物仅通过改变物理参数(例如,将水明胶溶液冷却至35 °C以下使明胶发生凝胶化)或通过添加可物理或化学交联的物质(如加入钙盐形成海藻酸盐凝胶)即可形成水凝胶。其他生物聚合物则需要通过引入甲基丙烯酸酯、醛、异氰酸酯、环氧树脂或巯基等交联功能基团进行化学改性(Van Vlierberghe 等 2011)。
可生物降解聚合物是指通过体内化学或酶促水解作用转化为水溶性降解产物的聚合物。
根据聚合物结构的不同,已知有三种形成可降解水溶性产物的途径(图 13)。聚合物可以具有在体内发生水解的可降解侧链,从而留下带有羟基、羧基或其他亲水基团的残余聚合物,使聚合物具备水溶性并可从体内排出。另一种途径是使用可水解的交联单元将水溶性聚合物进行交联。当置于体内时,交联单元发生水解,生成水溶性聚合物,也可被排出体外。然而,在大多数情况下,可水解单元
直接结合在聚合物链的主链中。当此类聚合物置于体内时,聚合物链会随着时间缓慢水解,形成越来越短的聚合物片段,并在特定时间点变为水溶性,从而被排出或代谢出体外。
决定降解过程总体速率的主要材料相关因素包括:聚合物主链中易水解基团的化学稳定性、重复单元的亲水/疏水性、聚合物的形态(包括孔隙率)、初始分子量和分子量分布、器件制造工艺、催化剂和添加剂的存在,以及植入体内器件的几何形状。此外,还有多种介质相关因素影响降解速率,包括 pH值、温度、溶质、盐类、酶和微生物的存在及其浓度,以及应力或应变的发生情况。
聚合物链的化学组成,即易水解单元的类型,可能是决定降解速率的关键参数。图14给出了聚合物主链中常见易水解键的概述。例如,酸酐比酯键更容易发生水解,而酯键又比氨基甲酸酯或酰胺键更容易水解。因此,相应聚合物的降解顺序为:聚酸酐 > 聚酯 > 聚氨酯、聚酰胺。基于对聚合物主链结构水解敏感性的了解,可以对特定聚合物的降解速率进行预测。
影响聚合物主链降解的另一个重要参数是聚合物的形态。聚合物可分为无定形或半结晶性。在结晶状态下,聚合物链紧密堆积,阻碍水的渗透。因此,主链水解 tends to 发生在半结晶性聚合物的无定形区域以及结晶区域的表面。在聚酯类中,聚(L‐丙交酯)和聚乙醇酸是典型的半结晶性聚合物,而聚(D,L‐丙交酯)为无定形(Tsuji 2010)。正因如此,化学组成相同的聚(L‐丙交酯)和聚(D,L‐丙交酯)在降解速率上表现出显著差异,其中无定形的聚(D,L‐丙交酯)通常降解得更快。
在水解降解过程中,聚合物链发生断裂,形成低分子量的水溶性低聚物,并释放到介质中,导致聚合物质量损失。目前已知有两种不同的基本机制来描述聚合物材料的降解:表面侵蚀和本体侵蚀(Goepferich 1997年)(图 15)。当水解降解速率远高于水在聚合物内的扩散速率时,发生表面侵蚀。此时,水解降解仅发生在聚合物表面。
相比之下,当聚合物的水解降解速率远低于水在聚合物中的扩散速率时,会发生本体侵蚀。因此,水解降解几乎在整个材料中均匀发生,而与距材料表面的深度无关。这可能是一个尚未解决的问题,因为在降解的最后阶段,整个聚合物结构可能发生崩溃,导致大量聚合物碎片的释放。
4 结论
如今,已知有多种生物材料,它们在原子和分子结构上各不相同,因而具有广泛的化学性质。在过去,生物材料研发的主要目标是提供具有特定物理性能的材料,例如机械强度、耐磨性和抗疲劳性以及温度和中长期稳定性,并使其对生命物质的组织表现出或多或少的惰性。从化学角度来看,其目的是创造不与环境发生反应的材料,或通过合适的保护层来保护这些会发生反应的材料。尽管这仍然是研究的重点之一,但如今正发生一种范式转变,即开发能够以主动方式与生命有机体的细胞和组织相互作用的生物材料概念正受到越来越多的关注。未来的生物材料概念将聚焦于干预策略,旨在在材料‐组织界面主动刺激化学和生物过程,以提高植入物的材料和生物学性能,例如延长寿命或实现植入物的真正整合。这无疑会使生物材料化学成为一个更加复杂的过程,并为开发新材料和材料组合带来真正的挑战。除了这些未来材料的本体化学之外,生物材料表面的化学将在这些材料的成功中发挥决定性作用。




















 556
556

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








