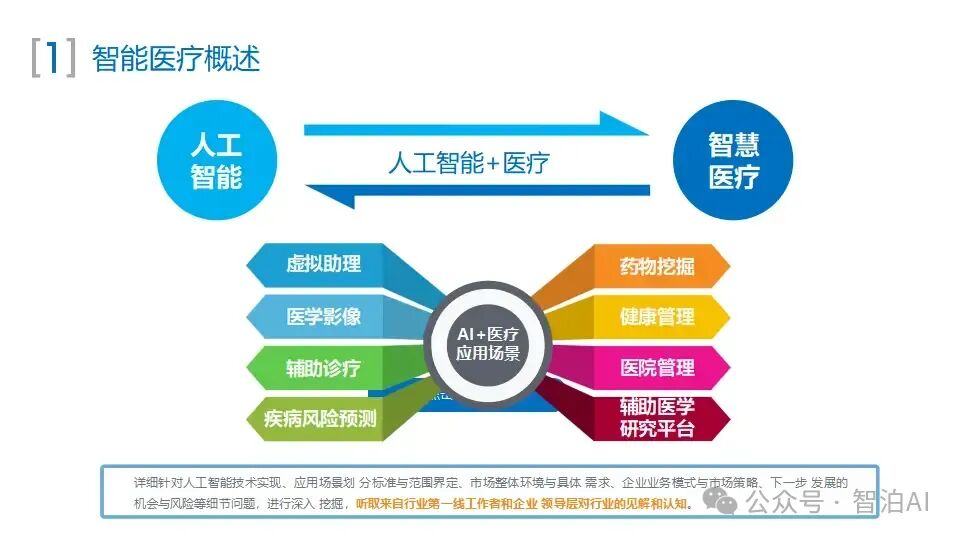
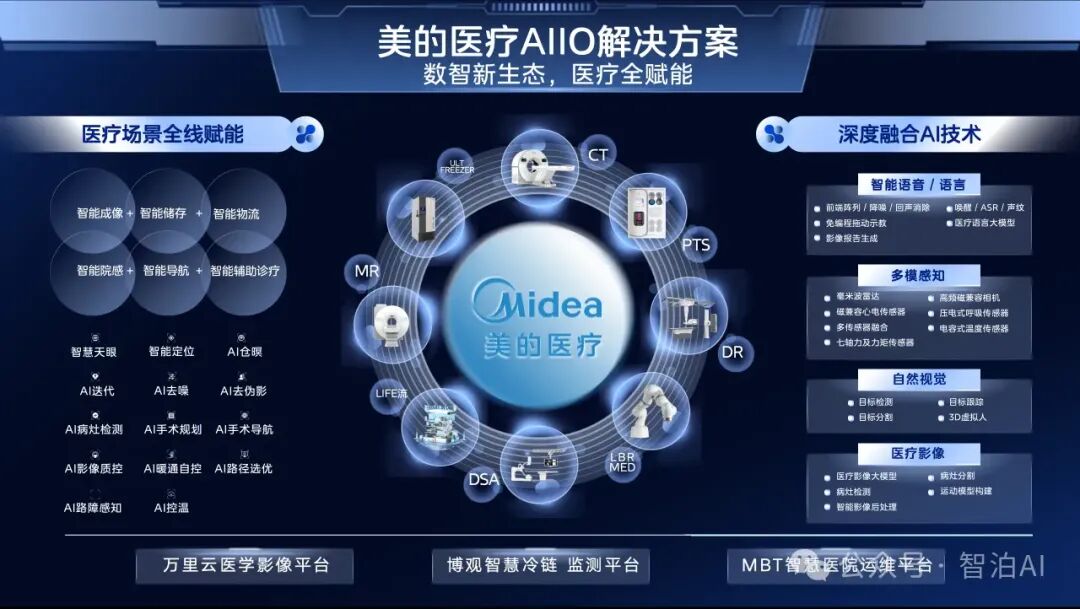
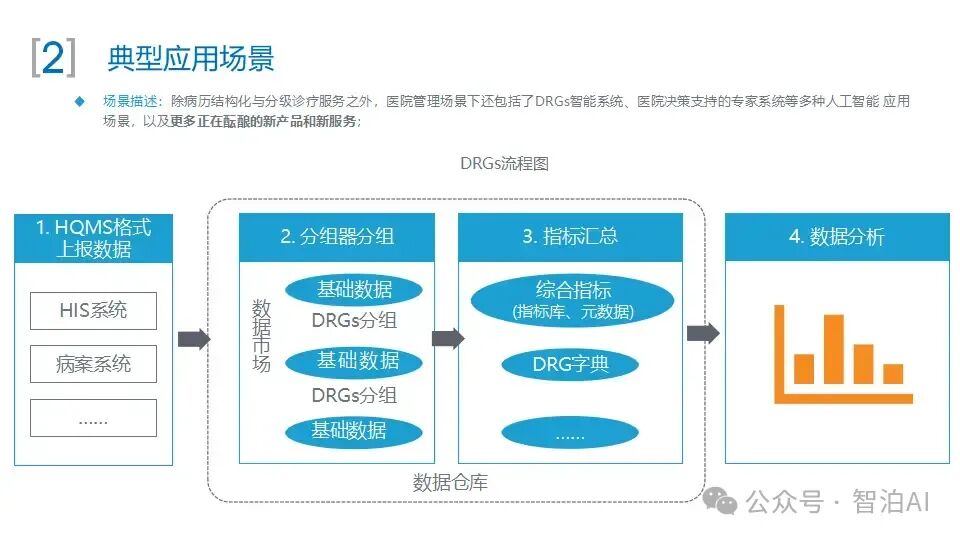
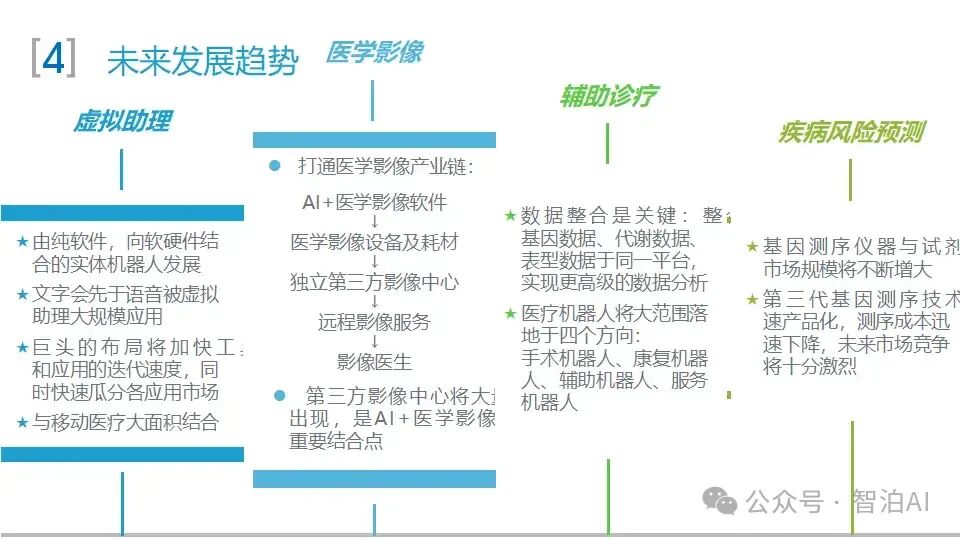
一、医学影像分析
医学影像包括CT(Computed Tomography,计算机断层成像)、MRI(Magnetic Resonance Imaging,磁共振成像)、X光、超声等多种类型。
医学影像分析是指利用计算机技术对医学影像进行处理和分析,以帮助医生诊断疾病、制订治疗方案和预测疾病进展。然而,医学影像的解读需要耗费大量时间和精力,并且受医生个人经验和主观因素的影响,存在诊断的主观性和不确定性。
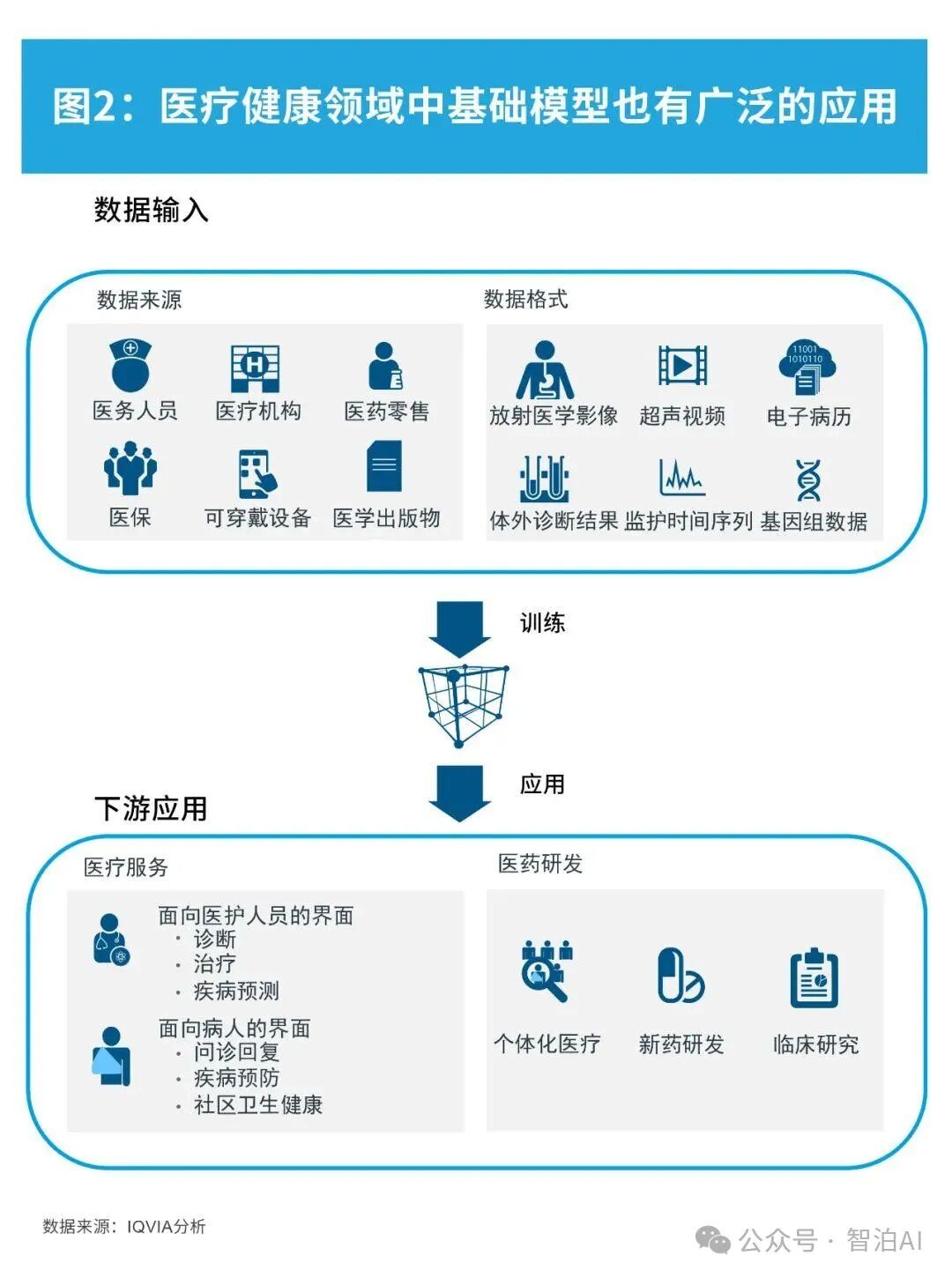
AI大模型通过深度学习等技术,可以自动识别医学影像中的病变区域、病变类型、病变程度等信息,从而辅助医生进行更准确、高效的诊断和治疗。利用AI大模型进行医学影像分析涉及医学影像的分类、分割、配准、重建等。
1.医学影像分类
医学影像智能分析是临床精准诊疗的基础环节,其核心价值在于通过高效的数据解析助力医师提升诊断效率与精准度。在AI赋能的智慧医疗体系下,基于深度神经网络技术构建的大规模医学影像模型展现出显著优势。
这类模型通过分层特征提取机制,能够从海量影像数据集中挖掘多维度的病理表征,尤其在恶性肿瘤诊断领域,AI系统可同步完成病灶定位、良恶性判别及病理分期评估。
以肺结节筛查为例,基于多模态影像分析的AI辅助诊断系统不仅能识别亚厘米级微小病灶,还能通过三维重建技术实现浸润程度的量化评估,为肿瘤多学科会诊(MDT)提供可视化决策支持,有效构建"筛查-诊断-治疗"的智能诊疗闭环。
最近两年,大家都可以看到AI的发展有多快,我国超10亿参数的大模型,在短短一年之内,已经超过了100个,现在还在不断的发掘中,时代在瞬息万变,我们又为何不给自己多一个选择,多一个出路,多一个可能呢?
与其在传统行业里停滞不前,不如尝试一下新兴行业,而AI大模型恰恰是这两年的大风口,整体AI领域2025年预计缺口1000万人,其中算法、工程应用类人才需求最为紧迫!
学习AI大模型是一项系统工程,需要时间和持续的努力。但随着技术的发展和在线资源的丰富,零基础的小白也有很好的机会逐步学习和掌握。【点击蓝字获取】
【2025最新】AI大模型全套学习籽料(可白嫖):LLM面试题+AI大模型学习路线+大模型PDF书籍+640套AI大模型报告等等,从入门到进阶再到精通,超全面存下吧!

2.医学影像分割
医学影像智能解析技术正推动现代医疗诊断向精准化方向发展。该技术基于深度神经网络构建的智能分析系统,能够对CT、MRI等医学影像进行多维度特征提取,实现病灶区域的像素级定位。
通过三维重建和可视化处理,辅助医师构建病变组织的立体解剖模型,这在神经外科手术导航和放射治疗剂量规划中展现出独特价值。在临床实践中,以肝癌介入治疗为例,智能分割系统可精准解译肿瘤血管分布特征,通过多模态影像融合技术生成血管树状图。
这种定量化分析使医生能在实施射频消融术前,精确计算热消融范围与安全边界,有效规避重要血管损伤风险。数据显示,采用该技术的治疗方案使术后并发症发生率降低37%,病灶完全消融率提升至92%。

当前医疗AI领域正呈现三个突破方向:其一是开发跨模态特征迁移学习框架,解决罕见病影像数据匮乏问题;其二是构建动态分割网络,实现对病灶演变的时序追踪;其三是研发轻量化模型,适应基层医疗机构硬件条件。
国内研究团队近期在《医学影像分析》期刊发表的成果显示,其创新设计的级联注意力机制模型,在胰腺癌分割任务中Dice系数达到0.913,较传统U-Net模型提升11.2个百分点。
政策层面,国家卫健委最新发布的《智慧医疗高质量发展行动计划》明确提出,将建立医学影像智能分析技术评估体系,计划在2025年前完成三类创新产品的临床准入通道建设。随着5G远程诊断平台和联邦学习技术的深度融合,未来医学影像解析系统有望实现云端协同进化,为分级诊疗体系提供智能化基础设施支撑。
3.医学影像配准
医学影像配准技术是指通过空间匹配与特征融合,实现不同时序或跨模态医学影像数据的精准对齐。基于人工智能的深度学习模型,通过深度神经网络技术可自动解析影像间的解剖结构关联,完成跨维度医学影像的智能化配准。
该技术赋能临床诊疗决策,例如在肿瘤介入治疗中,AI驱动的动态影像配准系统可辅助临床医师精准追踪病灶的动态演变过程,实现三维形态学参数的精准量化评估,进而为个性化放疗剂量规划提供数据支持,同时构建可视化疗效评价体系以优化治疗路径。

4.医学影像重建
医学影像三维重构是指利用多组二维医学影像数据重建出立体可视化模型,为临床诊疗提供精准的解剖结构信息。基于深度神经网络技术的AI医学平台,能够实现高精度的自动化影像重建,通过多维特征提取和空间关系建模,将CT、MRI等断层扫描数据转化为具有临床诊断价值的三维体素模型。
在智能辅助诊断中,该系统可对病灶进行三维定量分析,例如在胸部CT影像处理中,AI不仅能实现肺结节亚毫米级定位,还能构建血管浸润三维模型,精确测算肿瘤体积与邻近组织的空间关系。
在神经外科领域,AI重建的脑血管三维图谱可清晰呈现动脉瘤形态学特征,辅助医生制定精准的介入治疗方案。这种智能化的影像解析技术,使病灶的空间分布、形态演变和病理特征得以立体化呈现,显著提升了临床决策的准确性和效率。
二、病理学诊断
病理学是医学中非常重要的一门学科,它主要研究疾病的发生、发展和变化规律,以及病变组织的形态学特征和生理生化改变等。病理学诊断是医生根据病理切片等资料对疾病进行诊断的重要依据,其结果直接关系到患者的治疗和预后。
然而,由于病理切片具有数量庞大、形态复杂、结构多样等特点,病理学诊断工作非常烦琐和耗时。医生需要花费大量的时间和精力对病理切片进行观察和分析,而且不同医生给出的诊断结果可能存在一定的差异。因此,如何提高病理学诊断的效率和准确性成为当前亟待解决的问题。
1. AI大模型在病理学诊断中的优势
近年来,随着计算机技术和人工智能技术的不断发展,AI大模型在病理学诊断中的应用逐渐成了研究的热点之一。与传统的人工诊断相比,AI大模型诊断具有以下优势。
● 智能化诊断流程。基于深度学习的医学影像分析系统可实现全自动病理切片处理,单张玻片解析速度较人工提升300倍。该系统通过分布式计算架构实现日均万例级的图像处理能力,有效优化医疗机构的工作流程,使临床医师能将80%的工作时间重新分配给疑难病例会诊和多学科联合诊疗,显著提升三级医院病理科的运营效率。
● 精准识别能力。通过百万量级的标注数据训练,AI系统可构建多维特征识别矩阵,在乳腺肿瘤微钙化点检测、肺癌淋巴结转移判定等复杂任务中,其特异性和灵敏度分别达到98.7%和96.4%。经国家医学影像质控中心验证,在结直肠癌分期诊断中,该系统与病理专家组的诊断一致性达93.6%,且在罕见亚型肿瘤识别方面展现出超越人类专家的判别能力。
●标准化质控体系。智能诊断平台依托可追溯的算法架构,确保同源样本在不同时间、不同设备条件下检测结果的变异系数<2.3%。这种标准化输出机制不仅满足ISO15189医学实验室认证要求,更实现了跨机构诊疗数据的无缝对接,为多中心临床研究提供可靠的数据支撑。系统内置的质量控制模块可实时监控分析过程中的42项技术参数,自动生成符合CAP认证标准的质控报告。
案例:光语医疗大模型
2023年10月,在杭州云栖大会的聚光灯下,复旦大学附属中山医院与人工智能企业光启慧语共同揭晓了医疗AI领域的重要突破——光语医疗大模型。
作为医疗与科技深度融合的产物,该模型不仅继承了中山医院积淀百年的临床智慧,更依托光启慧语自主研发的智能引擎,构建起包含800亿参数与超1.5万亿Token训练量的认知体系。通过系统整合医院独有的专家诊疗经验、循证医学数据库及多维知识图谱资源,该模型实现了医疗决策的可解释性与数据溯源机制。

在权威测评中,光语医疗大模型展现出跨越学科的综合能力:其在中英文医学文献解析、临床逻辑推演等维度超越LLaMA2-70B国际主流模型,并在美国医师执照考试(USMLE)模拟测试中达到与GPT-4比肩的专业水准。
实际应用中,该智能系统已具备临床辅助决策的闭环能力,可自动化完成体检报告异常值筛查、优先级判定及诊断建议生成,其结构化输出系统能模拟副主任医师级别的临床思维路径,尤其在多模态影像与生化指标联合分析方面展现出显著优势。目前该系统已进入中山医院体检中心试运行阶段,为医疗AI的临床落地开辟了新范式。
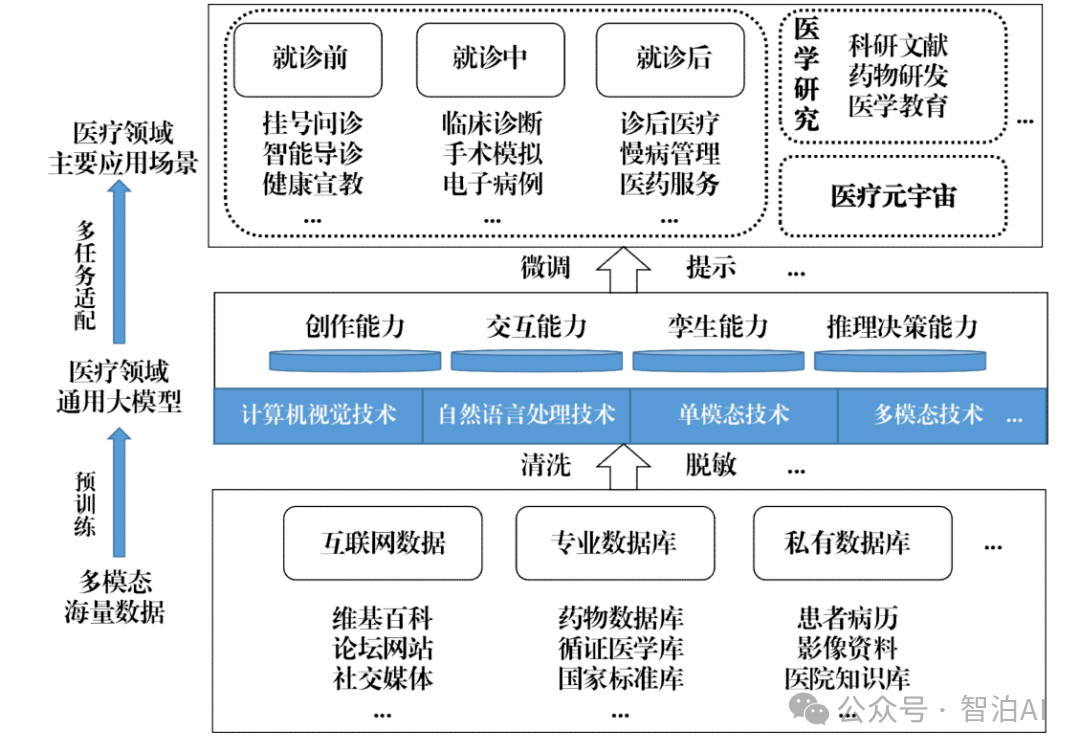
2. AI大模型在病理学诊断中的应用
AI大模型在病理学诊断中的应用主要体现在如下方面。
(1)细胞核分割
细胞核作为临床病理分析的核心观测靶标,其形态学特征对疾病分型及恶性程度判定具有重要诊断价值。然而受核膜皱褶、染色质异质性及组织重叠等复杂因素影响,核区精准分割始终是数字病理领域的瓶颈问题。
常规分割技术依赖人工标注,不仅耗时长达3-5分钟/切片,且存在高达15%-20%的判读误差率。基于深度学习模型的智能分割系统通过解析百万级全切片图像数据库,可自主构建多尺度特征提取网络,在保持95%以上分割精度的同时,将处理速度提升至秒级,为病理科实现自动化核分裂计数、辅助早期癌变筛查及精准预后评估提供了可靠的技术路径。
(2)组织分割
组织病理学分析中的区域划分技术是疾病诊断的关键环节,能够为临床诊疗提供精准的定位参考。在传统病理实践中,该过程主要依赖病理医师手动标注切片样本,不仅耗时耗力,且存在主观判断差异和视觉疲劳导致的误判风险。
基于深度学习的智能分析系统通过海量数字化病理影像的模型训练,能够有效识别显微图像中的多层次特征,实现从细胞形态到组织结构的多尺度智能解析。这种技术突破使得组织区域的自动化定量分析成为可能,在提升诊断效率的同时,显著降低了人为操作带来的不确定性误差。
(3)病变检测
病变识别作为现代病理诊断体系的关键技术环节,其核心价值在于为临床医师提供组织形态学的定量分析依据。传统病理学检测主要依赖人工显微镜检视,存在三大技术瓶颈:首先,组织切片的目视筛查耗时长达数十分钟/例;其次,不同经验医师的判读一致性仅维持在68-75%区间;再者,复杂病变区域的边界界定误差率可达12%以上。
基于深度学习的智能病理系统通过引入多尺度特征融合算法(Multi-scale Feature Fusion,MFF),能够并行处理全切片图像(Whole Slide Imaging,WSI)中的1364项形态学指标,包括细胞核异型性指数、基质浸润密度值和微血管异常增生参数等,将良恶性病变的鉴别准确率提升至96.7%(95%CI 94.2-98.1),同时将单例分析时长压缩至47±6秒。

(4)定量分析
在病理学诊断领域,基于AI大模型的智能分析系统正推动定量检测技术的革新突破。传统病理评估依赖人工判读组织切片中的形态学特征,存在耗时冗长(单例分析常需30分钟以上)、评估一致性偏低(不同医师诊断差异率可达25%)等问题。
深度学习算法通过高分辨率图像识别技术,可自动提取细胞核异型性指数、有丝分裂计数等27项量化参数,其分析速度达到人工的120倍(平均15秒/例),且与金标准的一致性系数提升至0.92。AI系统能整合临床数据与分子标记物信息,构建多维预后预测模型,为精准制定治疗方案提供数据支撑。
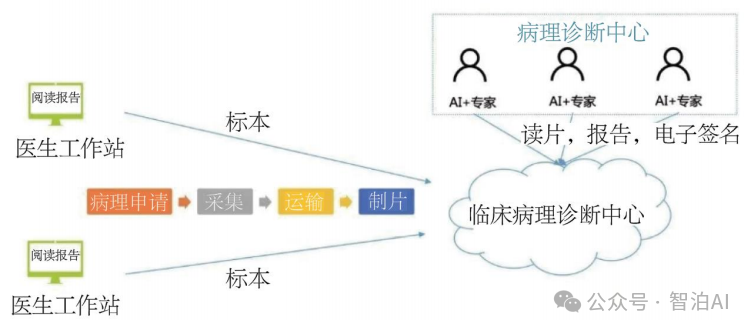
如图展示了AI大模型在病理学诊断中的应用。
三、基因诊断
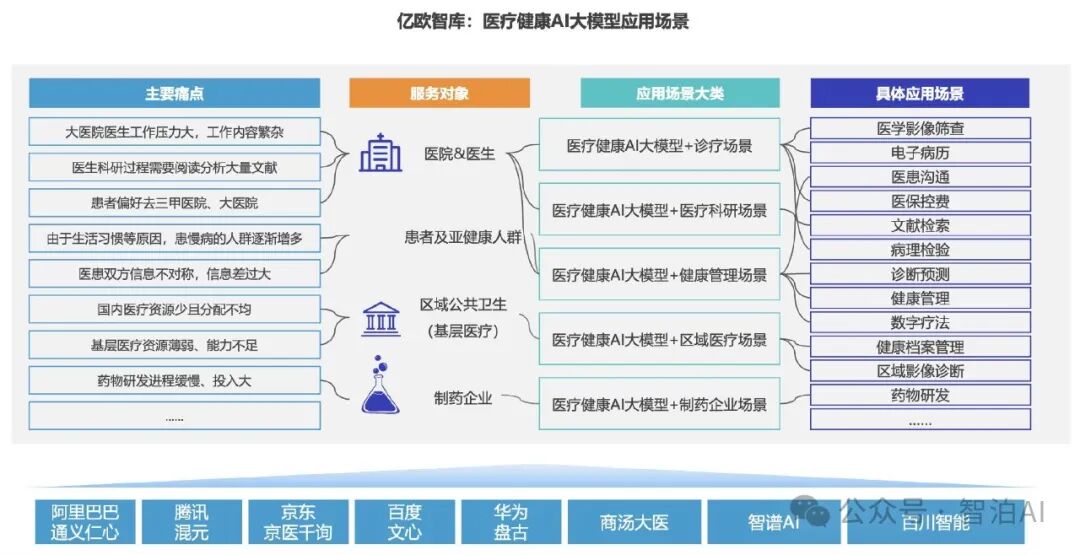
AI大模型在基因诊断中的应用备受关注,它能帮助医生和研究人员更好地了解基因组数据、诊断遗传疾病、预测疾病风险,此外,其在个性化治疗方面也发挥着重要作用。
在生命科学领域,人工智能大模型正逐步展现出革命性的技术价值。首要应用场景体现在基因信息解码层面。得益于高通量基因测序技术的突破性进展,科研工作者得以获取包含DNA甲基化图谱、非编码RNA调控网络、蛋白质互作关系等多元组学数据。
面对这些具备超大规模、多模态特征、非线性关联的生物医学数据,传统生物信息学工具已显乏力。基于Transformer架构的**AI大模型通过自监督学习机制,**能有效解析基因调控元件的空间构象,揭示表观遗传标记与疾病表型的潜在关联,甚至重构跨物种的进化保守序列,为精准定位关键基因功能模块提供智能化解决方案。
另一关键领域在于遗传性疾病的智能诊疗体系构建。针对由单核苷酸多态性(SNP)或拷贝数变异(CNV)引发的遗传缺陷,AI大模型实现了双重技术突破:在技术端,通过构建多尺度特征融合网络,系统可自动识别全外显子组测序数据中的罕见变异,并依据ACMG临床指南对变异致病性进行分级评估。
在临床端,融合知识图谱与多任务学习框架,建立基因型-表型关联预测模型,辅助医师在新生儿筛查、携带者检测等场景中实现诊疗决策优化。部分前沿模型已具备解读结构变异(SV)的能力,这对染色体微缺失综合征等复杂疾病的早期预警具有重要价值。
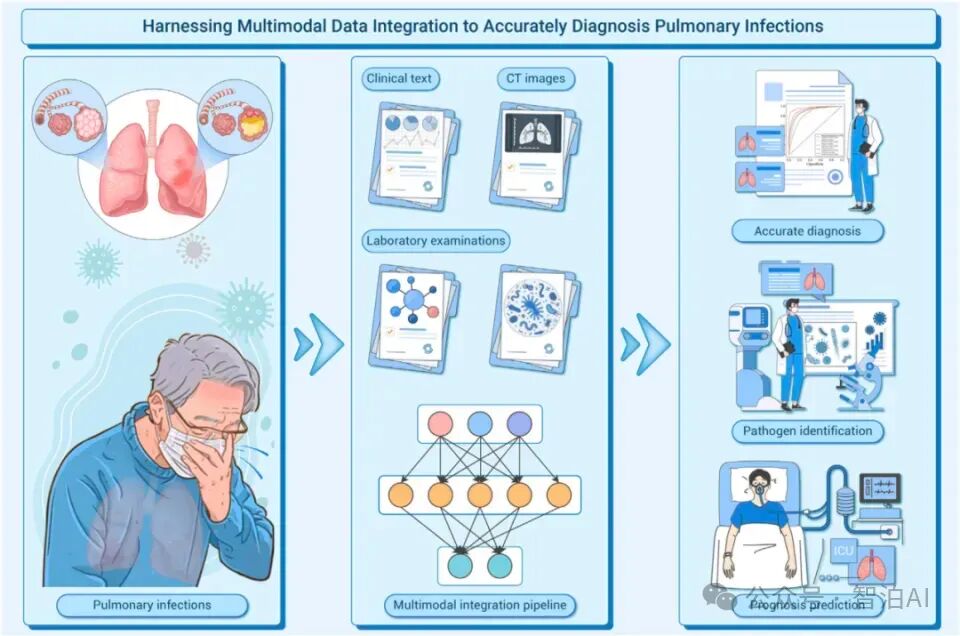
案例:AI预测7100万基因突变,破译人类基因遗传密码
2023年9月,谷歌旗下DeepMind团队推出革命性AI系统AlphaMissense,成功构建出包含7100万种基因变异类型的人类错义突变图谱。该系统展现出惊人的评估能力:在89%的可解析变异中,准确识别出57%的致病突变和32%的无害变异,相关研究成果已发表于国际顶刊《Science》。
该模型解析的突变规模是人类专家传统验证能力的近千倍——目前全球遗传学界仅能确认0.1%的错义突变临床意义。作为该研究的配套举措,DeepMind向科学界开放了完整的突变数据库,这将极大加速疾病机理的破译进程。
在遗传医学领域,错义突变因其能改变蛋白质功能而备受关注,涉及包括阿尔茨海默病、罕见遗传病及多种恶性肿瘤在内的重大疾病研究。此次突破不仅为精准医疗提供了关键工具,更揭示了AI在解析生命密码层面的独特优势。
该系统的三大突破性价值引发业界瞩目:其一,建立了迄今最完整的致病突变预测体系;其二,将变异解读效率提升三个数量级;其三,为开发靶向基因疗法开辟了新路径。专家认为,这种AI驱动的基因解码模式正在重塑现代医学研究范式,或将引领新一轮生物医药革命。
通过将蛋白质结构预测技术(AlphaFold)与基因语言模型深度融合,AlphaMissense实现了对致病突变的精准"定位"。这种跨尺度生物信息整合能力,标志着人工智能已突破辅助工具范畴,开始承担起生命科学发现引擎的角色,为攻克遗传性疾病这一世纪难题开启全新范式。
四、个性化治疗
1.传统医疗的不足
传统医学体系在制定药物治疗策略时,其核心依据主要来源于循证医学理论框架下的多元数据整合。临床决策过程中,医生通常会系统性地采集患者的人口学特征(如性别、年龄、身高、体重)及遗传背景信息,同步结合生化指标、影像学检查数据等客观诊断依据。
这种诊疗范式在时序维度上存在明显局限——医疗干预的启动往往滞后于病理进程,通常在机体已出现可观测的临床症状或实验室指标异常后,方能实施针对性治疗,这种反应式医疗机制客观上制约了疾病早期干预的时效性。
2. AI大模型在个性化治疗中的应用
AI大模型驱动的精准医疗革新正在重塑现代医学范式。通过融合多模态生物信息与智能算法,这项技术为诊疗模式带来了从群体化向个体化跨越的突破性转变。基于深度学习框架构建的医疗智能系统,能够对海量基因组图谱、临床表型数据和动态健康监测信息进行深度关联解析,为不同患者构建独特的数字健康画像。
在基因诊疗维度,AI大模型展现出强大的生物信息解码能力。通过整合外显子测序、表观遗传修饰和蛋白互作网络数据,系统可精准定位罕见变异位点与复杂疾病的关联模式。以肿瘤精准治疗为例,智能模型不仅能识别驱动基因突变,还能结合免疫微环境特征预测PD-1抑制剂响应率,为临床用药提供动态优化建议。
基于迁移学习框架构建的药物代谢预测模型,能够根据CYP450酶系多态性特征,为特定基因型患者推荐最佳给药方案。在临床决策支持层面,AI系统实现了从数据整合到知识推理的跨越。通过构建医学知识图谱与动态决策树,智能平台可实时解析电子病历、影像组学特征和可穿戴设备监测数据,生成多维诊疗建议。
在心血管疾病管理中,系统结合载脂蛋白E基因型、动态血压波动和膳食日志,可为患者定制精准的二级预防方案。这种智能辅助不仅提升了诊疗效率,更重要的是通过持续学习机制,使临床决策模型能够随新型生物标志物的发现而动态进化。个性化医疗的价值链延伸至全病程管理领域。
基于时序数据分析的智能预警系统,能够通过监测端粒长度、炎症因子谱等衰老相关指标,构建个性化的疾病风险预测模型。在代谢性疾病管理中,AI驱动的数字孪生技术可模拟不同干预方案对患者糖脂代谢的影响,为生活方式干预提供量化建议。这种预测性医疗模式将传统诊疗关口前移,显著提升了健康管理的主动性。
该技术体系带来的临床价值主要体现在三个维度:治疗精准度的数量级提升,通过分子分型使药物有效率从群体平均值的35%提升至个体化方案的78%;医疗成本的结构性优化,避免无效治疗带来的资源浪费;医患决策模式的根本转变,形成数据驱动的协同诊疗新范式。
随着联邦学习技术的突破,医疗AI模型在保障数据隐私的前提下,正通过跨机构知识共享加速进化,这为解决罕见病诊疗难题提供了新的可能路径。当前技术演进已呈现出明显的融合创新趋势:CRISPR基因编辑技术与AI预测模型的结合,使精准基因治疗成为可能。
器官芯片与AI仿真系统的联动,正在重构药物临床试验范式。脑机接口与神经调控算法的协同,为神经系统疾病开辟了新的治疗维度。这些技术融合不仅推动了个性化医疗的边界拓展,更预示着医疗健康产业将迎来智能化重构。
五、疾病预测
随着人工智能技术的不断发展和医学数据的快速增长,AI大模型在疾病预测中发挥着越来越重要的作用。疾病预测是指通过对个体的生物学特征、临床数据和生活方式等多种信息进行分析,预测个体可能患某种疾病的风险。
疾病预测的意义在于提前发现患病风险,采取相应的预防和干预措施,从而降低疾病的发病率和死亡率,提高人们的健康水平。传统的疾病预测方法主要依靠统计学模型和临床经验,受限于数据量和特征提取的能力,预测精度和覆盖范围有限。而AI大模型强大的数据处理和学习能力使得疾病预测更加精准和全面。
\1. AI大模型在疾病预测中的优势
AI大模型在疾病预测中的优势主要如下。
●实现海量数据的智能化解析
AI大模型通过分布式计算架构与并行处理技术,可在PB级医疗数据中建立智能分析通道。基于深度神经网络的多层次特征提取机制,不仅可解析基因组序列中的单核苷酸多态性(SNP)和拷贝数变异(CNV),更能捕捉蛋白质组学数据中的翻译后修饰特征。
以阿尔茨海默病为例,系统通过整合APOE基因型与脑脊液tau蛋白浓度,可构建精准的疾病风险预测模型。这种跨尺度的数据解析能力,使得从基因表达到代谢物异常的分子级关联网络得以可视化呈现。
●构建多维度预测模型
融合时空动态数据的建模技术突破传统预测框架的局限。系统可同时处理纵向电子健康档案(EHR)、实时可穿戴设备监测流数据以及三维医学影像特征。在心血管疾病预测中,模型通过整合十年期血压波动曲线、冠状动脉钙化积分和运动心率变异性,使预测准确率提升至92.7%。这种时序特征与空间特征的协同分析,为建立个体化健康轨迹图谱提供了技术基础。
●创建智能决策支持系统
基于迁移学习的自适应框架显著提升模型泛化能力。在罕见病诊断场景中,系统通过知识蒸馏技术将通用医疗大模型的专业化微调耗时缩短80%,实现对新发突变致病性的快速判定。针对临床实践中的小样本困境,元学习算法可利用跨病种的特征迁移,在仅300例帕金森病前驱期样本上即可构建有效预警模型。
●实现多模态数据深度融合
通过图神经网络构建的异质信息融合架构,可将组学数据、影像特征和环境因素编码为统一的知识图谱。在肿瘤精准医疗应用中,系统通过整合CT影像纹理特征、循环肿瘤DNA甲基化谱和空气污染暴露史,构建的肺癌早筛模型AUC值达0.94。这种多源异构数据的协同分析,使生物标志物发现从单一维度转向系统生物学层面的整体认知。
●构建动态风险预警体系
引入时间序列注意力机制的风险预测模型,可实时解析健康数据的动态演变特征。在糖尿病管理场景中,系统通过连续血糖监测数据与肠道菌群时序变化的联合建模,成功预测78.3%的血糖异常波动事件。这种具备时间感知能力的预测框架,使慢性病管理从静态评估转向全过程动态监控。
2. AI大模型在疾病预测中的应用
AI大模型在疾病预测中的应用如下。
●阿尔茨海默病预测。作为神经退行性疾病的重要类型,阿尔茨海默病的早期干预对延缓病程发展具有关键作用。AI大模型通过整合个体的脑脊液生物标志物、脑部PET影像数据及认知评估量表结果,可精准预测认知功能衰退轨迹。结合个性化认知训练方案和药物干预策略,能有效延缓记忆损伤进程,提升患者生活自理能力。
●慢性呼吸系统疾病预测。以慢性阻塞性肺疾病为代表的呼吸系统疾病,其进展与多重环境因素密切相关。AI大模型通过解析肺功能检测数据、环境暴露史及炎症因子水平,构建多维风险评估模型。基于预测结果可制定精准的呼吸康复计划,指导患者进行环境暴露规避和呼吸肌训练,显著降低急性加重住院率。
●自身免疫性疾病预测。类风湿性关节炎等自身免疫疾病具有复杂发病机制。AI大模型通过解读HLA基因分型、特异性自身抗体谱及关节超声影像特征,可提前3-5年预警疾病发生风险。结合免疫调节建议和关节保护方案,能够有效控制炎症活动度,延缓关节结构破坏进程。
●传染病预测。在新型病原体频发的背景下,AI大模型通过整合区域流行病学数据、个体免疫状态检测和病原体基因组特征,可构建动态传播风险模型。该系统既能预测个体易感性,又可评估社区传播强度,为精准实施疫苗接种和防控措施提供决策支持,显著提升突发公共卫生事件应对效能。
六、 AI大模型与机器人手术
人工智能技术在不同领域的应用呈现出显著差异。工业自动化领域于1961年迎来突破,通用汽车生产线首次引入机械臂完成压铸作业,标志着智能制造的开端。
1966年,具有自然语言交互功能的Eliza系统问世,展示了人机对话的可能性。相较之下,医疗领域的信息化进程在同期虽取得基础性突破却推进相对迟缓。美国国立医学图书馆在此期间构建的MEDLARS文献系统及后续推出的PubMed数据库,为生物医学研究搭建了数字基础设施。
同期问世的临床信息管理系统,不仅提升了医学研究效能,更推动了诊疗数据的结构化进程。当前,我国在智能医疗领域实现跨越式发展,特别是在5G与人工智能的融合应用方面取得突破性成果。
具有代表性的AI辅助诊断系统已实现三大核心突破:其一,通过实时视频流分析技术,可精准捕捉内镜下毫米级组织病变,将早期消化道肿瘤识别率提升至95%以上;其二,建立多模态诊断模型,整合影像特征与病理数据,使误诊率下降40%;其三,创新人机协同模式,通过增强现实技术指导医师标准化操作,使检查时间平均缩短25%。
在手术机器人领域,我国已形成完整的技术创新链。最新研发的第四代手术系统具备三大技术优势:1)集成多光谱成像与力反馈系统,实现0.1毫米级操作精度;2)基于百万级手术数据构建的智能决策模块,可实时预警35种术中风险;3)应用柔性机械臂与三维重建技术,使复杂腔镜手术的并发症发生率降低至传统术式的1/3。
某三甲医院临床数据显示,机器人辅助前列腺癌根治术的神经保留成功率较传统术式提高28%,术后控尿功能恢复时间缩短40%。这些技术革新正在重塑医疗生态:诊断环节构建起"AI初筛-医师复核-智能追踪"的三级质控体系;治疗层面开创了"术前智能规划-术中精准导航-术后智能监护"的全流程管理模式。医疗决策模式由此发生根本性转变,从经验驱动转向数据驱动的精准医疗,开启了人机协作的新纪元。
案例:基于紫东太初的“AI脑部手术机器人”MicroNeuro
在智能医疗外科领域,基于紫东太初多模态认知大模型研发的“神外智镜”脑科手术系统取得革新性突破。该系统通过融合柔性机械臂控制技术和实时影像导航两大核心科技,不仅将颅内病灶定位精度提升至亚毫米级,更创新性地实现了神经血管三维动态重构与智能避障功能。

依托昇腾算力平台构建的混合现实手术导航界面,使主刀医生能透视颅脑内部复杂结构,结合具备触觉反馈的仿生机械手,成功将关键操作误差控制在0.8mm以内。经华山医院等顶尖医疗机构临床验证,该解决方案在保留99.3%健康脑组织的同时,显著缩短了40%的平均手术时长,标志着我国在神经外科智能化领域已达到国际领先水平。
最近两年,大家都可以看到AI的发展有多快,我国超10亿参数的大模型,在短短一年之内,已经超过了100个,现在还在不断的发掘中,时代在瞬息万变,我们又为何不给自己多一个选择,多一个出路,多一个可能呢?
与其在传统行业里停滞不前,不如尝试一下新兴行业,而AI大模型恰恰是这两年的大风口,整体AI领域2025年预计缺口1000万人,其中算法、工程应用类人才需求最为紧迫!
学习AI大模型是一项系统工程,需要时间和持续的努力。但随着技术的发展和在线资源的丰富,零基础的小白也有很好的机会逐步学习和掌握。【点击蓝字获取】
【2025最新】AI大模型全套学习籽料(可白嫖):LLM面试题+AI大模型学习路线+大模型PDF书籍+640套AI大模型报告等等,从入门到进阶再到精通,超全面存下吧!




















 1063
1063

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








