第14章 使用主成分分析滤波器改进胸部X光片中的结节检测
14.1 引言
基于技术的智能解决方案正在转变医疗保健,日益缩小自动化与人工诊断之间的差距。
智能医疗中的信息学将计算领域的普遍概念和实践应用于提供更优、高效的健康结果。
随着城市和乡村在可持续发展议程下变得更加智能化,医疗成为主要关注点,利益相关方正高度依赖维斯维齐、莱特拉斯、达米亚尼和马特库尔(2018)所提出的智能医疗系统,并高度重视将新兴技术嵌入传统医疗实践之中。
在过去的十年中,计算机技术的处理能力大幅提升,使得用于智能医疗系统和应用的计算机模型得以常规开发并投入使用,以自动化完成一些疾病诊断中的复杂决策工作,从而改善医疗质量,甚至管理某些健康相关并发症。医疗信息学创新的一个可能方向是放射成像领域。由于农村地区缺乏必要的放射服务和专业人员,使用计算机进行筛查显得尤为必要。本研究致力于开发用于自动筛查X光图像中疾病征象的软件方法。
具体目标是开发算法,以自动分割肺部区域、检测并去除肋骨,然后检测肺部疾病的特征性纹理特征。
肺癌已被美国癌症协会(2003)列为男性和女性中最常见的癌症相关死亡原因之一。
数十年的研究表明,早期发现肺癌是提高患者生存率最有希望的策略(弗洛拉克、特哈尔罗梅尼、科恩德林克和维尔格弗(1992);许瓦里宁、卡尔胡宁和奥贾(2001);科恩德林克(1984);林德伯格(1990);史密斯等人(2018))。
胸部X光在肺癌诊断中起着重要作用。根据美国癌症研究学会提供的最新统计数据,肺癌是全球最常见的癌症,预计增长15.5%。
肺癌最常见的筛查方法是使用胸部放射摄影。胸部放射摄影通过将胸部暴露于少量电离辐射来显示内部器官的图像。在技术先进的国家,计算机断层扫描(CT)等更先进的技术已使用了相当长的时间。根据Mazzone, Powell, Arenberg 和 Bach(2014)的观点,在特定情况下,CT 筛查的益处大于风险。然而,传统的胸部放射摄影仍然是欠发达地区大部分地区的默认技术。胸部X光片可通过系统性分析结合识别被称为肺结节的斑点状物体来进行解读(志赖等人,2006)。根据Xu, Doi, Kobayashi, MacMahon 和 Giger(1997)以及Shiraishi 等人(2000)的研究,可能为肺癌的肺结节在约16%的情况下会被医疗检查人员忽略,尽管事后回顾时结节可见。因此,采用计算机辅助检测(CAD)方案作为前端以提高放射科医生的检出准确率已成为一种实践,如麦克林(2004)和Lu 和 Rajapakse(2005)所报道。用于结节分析的计算机辅助诊断(CAD)正使扫描过程变得更加高效且具有成本效益(奇安比等人,2017)。
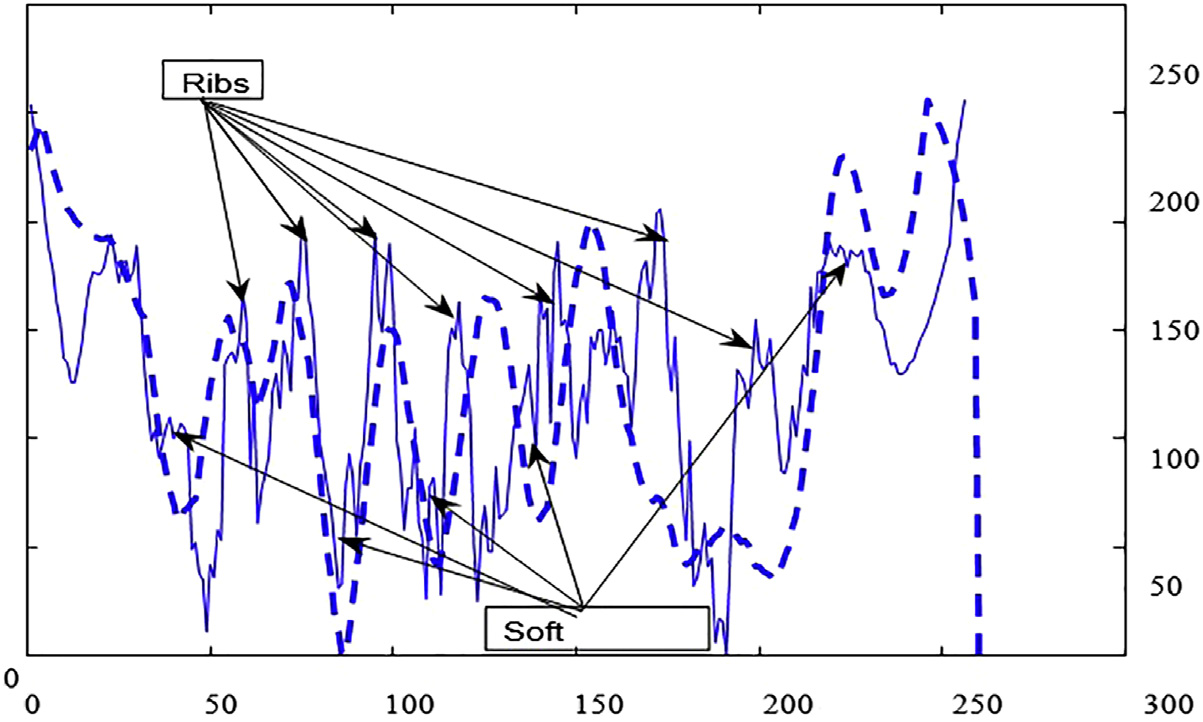
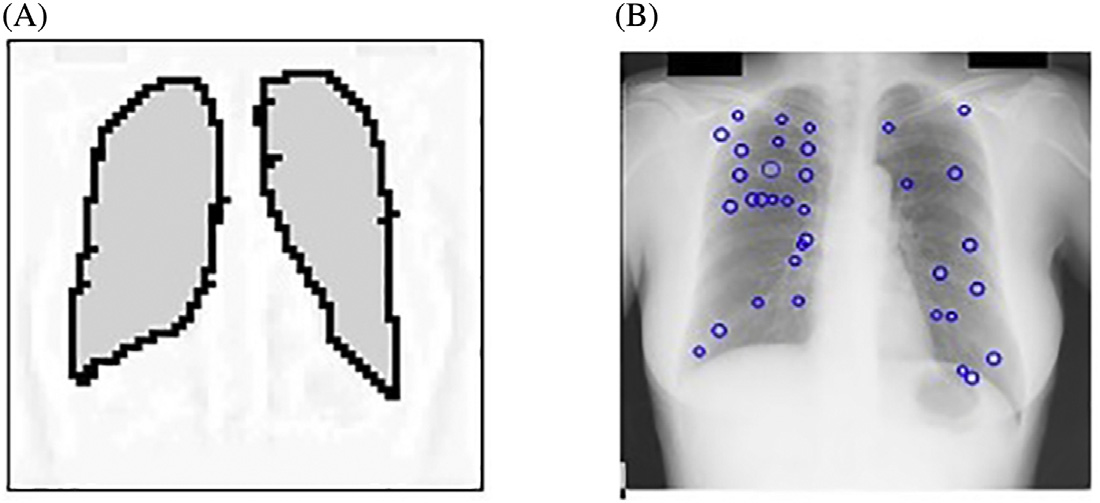
尽管胸部X光在临床日常中提供了重要的诊断检查,但由于相关诊断结构与无关的骨性结构重叠,使得影像较为复杂。因此,当前计算机辅助诊断系统(科皮尼、迪乔蒂、法尔基尼、维拉里和瓦利,2003年;吉格尔、土井、麦克马洪、梅茨和尹,1990年;德科宁等人,2013年;兰格、普拉特和因巴尔,1997年)在胸部X光片中面临的主要挑战是检测与肋骨、肋骨交叉及锁骨重叠的结节,如图14.1所示。这些骨性结构会导致大量的假阳性结果,正如凯瑟尔奇和吉田(2002年)所指出的
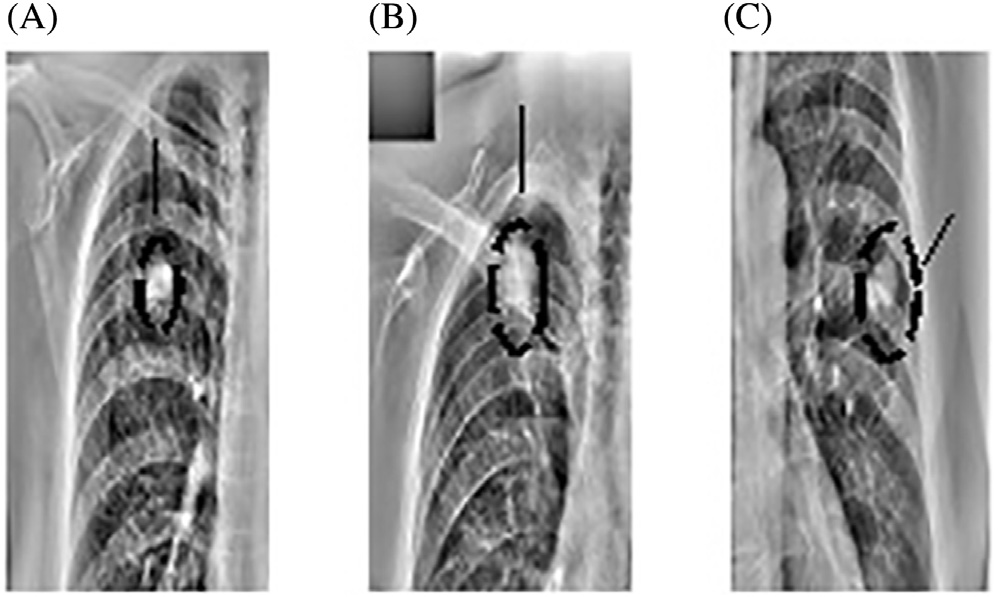
志岸、安倍、恩格尔曼和土井(2003年),以及崔、李、韩和刘(2015年)。就视觉检查而言,结节与肋骨和锁骨重叠的情况被报道为放射科医生最难检测的情形,参见波米耶和勒佩´肖克斯(2010年)以及卡雷拉、卡贝略、佩内多和莫丝奎拉(1998年)。因此可以认为,通过在胸部X光片中抑制肋骨和锁骨,可以使给定的计算机辅助诊断系统更加准确。
在临床实践中,这种分离是通过一种称为双能量成像的技术实现的。双能量成像基于骨骼(含钙)和软组织对X射线能量吸收模式的不同原理进行工作。这是一种双次曝光采集过程。尽管如今已有多种商用X光设备具备双能量成像能力,且额外辐射剂量可忽略不计,但除非特别要求,否则该技术并未常规使用。本文研究旨在探索通过软件方法为常规单次曝光胸部摄影提供上述能力,使患者无需接受高剂量辐射。研究文献中报道了三种不同的方法来处理胸部X光片中的肋骨抑制问题。
处理肋骨的一种可能方法是通过合适模型对其进行数学描述。该方法由朴、金和威尔逊(2003年)以及金、边、李、李和朴(2000年)提出。作者认为,肋骨可以通过一组称为抛物线的几何结构进行适当建模。最初使用霍夫变换将标准抛物线方程拟合到肋骨边界。随后,以迭代方式针对给定的肋骨结构采用这些抛物线,以获得局部优化解。在某些细微情况下,该解可能偏离实际肋骨,因此需要进一步进行后处理,即降低计算出的肋骨与模型蛇形结构之间的能量。此外,最终解还需手动调整,以得到合理的实用模型。
第二种方法是采用基于训练的非线性神经网络技术。支持这种方法的学者包括铃木、安倍、Macm McMahon 和 土井(2006年)以及伊迪特·迪亚蒙特 等人(2017年)。该方法利用多分辨率大规模训练人工神经网络(MTANN)来抑制胸部X光片中肋骨和锁骨的对比度。MTANN 是一种非线性滤波器,其系数通过大量胸部X光片进行训练得到。训练完成后,该非线性神经网络可应用于给定的胸部X光片,以提取仅包含肋骨和锁骨的类骨图像。提取后留下的胸部X光片则包含低对比度肋骨结构。然而,通常对于神经网络而言,很难追踪其内部实际发生的过程,因此大多将其视为具有复杂非线性结构的黑箱。
因此,一旦神经网络收敛,就很难对其进行修改或改进。此外,神经网络需要使用随机权重进行训练,且其收敛性无法保证。通常需要多次运行训练过程,才能确定最终的解决方案。
另一种与我们提出的方法类似的是 Loog 等人的方法。在这项工作中,基于回归技术开发了一种非线性滤波器。该回归技术利用输入图像像素和输出图像像素之间的关系,并从一组双能量图像中学习映射关系。这种数据驱动滤波器的主要问题在于处理高维数据。一旦数据被降至低维,算法便通过迭代来提取某些参数。迭代过程需密切监控其收敛性。作者建议在测试阶段以及训练阶段都引入预测因子,以获得更好的结果。
这些预测因子的需求源于测试样本与训练样本之间的某种不匹配。在此,降维是一个影响系统整体准确性的关键步骤。此外,局部以及全局参数调整也是一个问题。相比之下,我们的工作以一种直接的方式,从给定的输入图像中作为预处理步骤推导出数据驱动滤波器,而无需进行迭代。
第三种方法将胸部X光片中的肋骨抑制视为一个盲源分离(BSS)问题。该方法认为 X射线胸部X光片在解剖学上由两幅图像组成:一幅包含骨骼结构,另一幅为背景组织图像,二者呈线性混合。已采用独立成分分析(ICA)对源信号的线性混合进行盲源分离,以将肋骨图像与其余软组织图像分离开来。这种用于肋骨抑制的统计方法在 Ahmed、Rasheed、Khan、Rashid 和 Ahmed(2007)以及Ahmed、Rasheed、Khan、Cho 等人(2007)中进行了描述。针对给定的胸部X光片推导出的ICA基滤波器,被发现是Gabor滤波器和阶跃函数(表示强度值的急剧变化)的组合。这些基被称为边缘滤波器(Bell 和 Sejnowski,1997)。在最终的图像重建过程中,我们排除了那些包含肋骨及其他骨性结构边缘信息的基滤波器。由此重建的图像提供了肋骨抑制胸部X光片。该方法的主要优点在于,它既不是基于训练,也不依赖于预先假设的模型,而是一种数据驱动的高度自适应技术。
然而,独立成分分析算法(ICA)包含一个对输入数据进行白化的步骤,该步骤会消除某一特征相对于其他特征的方差偏好。在胸部X光片的情况下,可以看出肋骨和锁骨等骨性结构相比软组织具有较大的方差。因此,在ICA方法中分离肋骨的优势将丧失。因此,有研究提出,若能开发出一种数据驱动但对方差内容敏感的技术,则可能会得到更恰当地表征肋骨的滤波器。主成分分析(PCA)正是这样一种数据驱动的算法(Li、Luo、Hu、Li 和 Wang,2015;Lopez‐Alonso 和 Alda,2004),其根据方差等二阶统计量的优势将图像分解为其主成分。本研究探讨了使用主成分分析滤波器(PCA滤波)来抑制肋骨和锁骨,从而提升后续计算机辅助诊断(CAD)性能的能力(Hancock、Roland 和 Smith,1992;Heidemann,2006)。
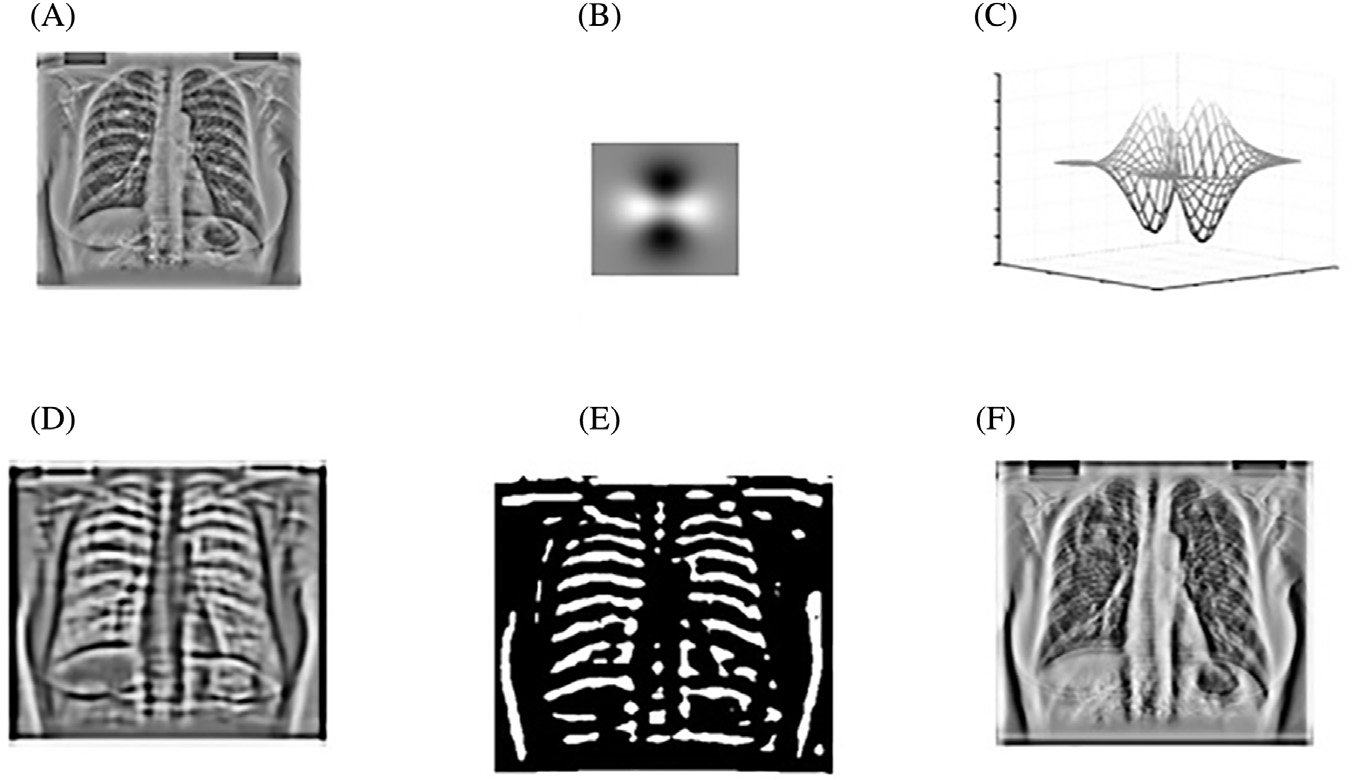
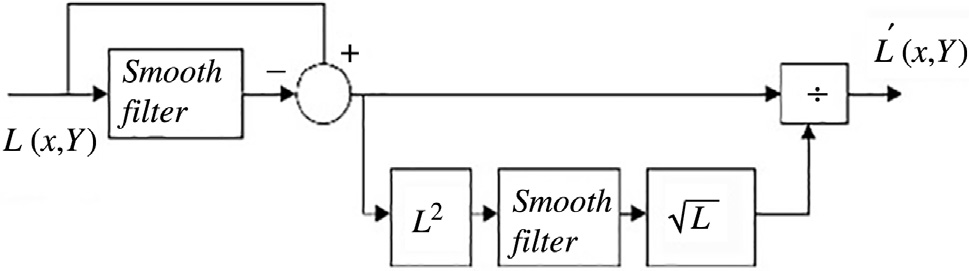
使用主成分分析滤波器进行肋骨抑制的结果如图14.2B所示。采用标准的高斯检测器高斯拉普拉斯掩模(LOG)来寻找可能存在结节的峰值区域。在原始胸部X光图像中应用该掩模导致了大量的假阳性,如图14.2A 所示,其中许多假阳性出现在肋骨上。
然而,在使用主成分分析滤波操作进行肋骨抑制后,该掩模除了检测到真正的结节外,仅产生了极少量的假阳性。人们认为,假阳性数量的减少主要归功于对肋骨的有效抑制。
需要注意的是,主成分分析滤波框架不仅限于肋骨抑制。在推导肋骨敏感滤波器的过程中,还识别出了一些与采集设备热噪声相关的滤波器。由于PCA滤波器可以根据其方差能量进行排序,因此可以通过调用这些噪声关联滤波器,在输出的X光图像中方便地抑制噪声水平。
本章内容安排如下:在第14.2节中讨论了不同的肋骨抑制技术,并阐述了使用PCA滤波器进行肋骨抑制的合理性。在第14.3节中介绍了数据采集以及为本实验选择合适的 X光数据库的相关内容。下一节讨论了用于癌症结节检测的所提出系统。在第14.5节中介绍了实验设置,第14.6节提供了结果,最后一节给出了结论。
14.2 从信号处理角度观察肋骨结构
让我们从信号处理角度来研究肋骨抑制问题。胸部X光是一种二维信号L(x, y),尺寸为256×256像素,具有256个亮度值。从图像中提取了y=71处的一条垂直扫描线。
得到一维信号 L(x) = L(x, 71),如图14.3所示。Fig. 14.3中显示了提取L(x) 的图像位置,该位置在图14.4中以黑线表示。Fig. 14.4。如果将该一维信号图与线周围区域的灰度进行比较,可以观察到图像中的亮区具有较大值(接近255),而暗区具有较低值(接近零)。
从图14.3所示的一维图中可以看出,肋骨表现为以主导空间频率周期性重复的峰值。
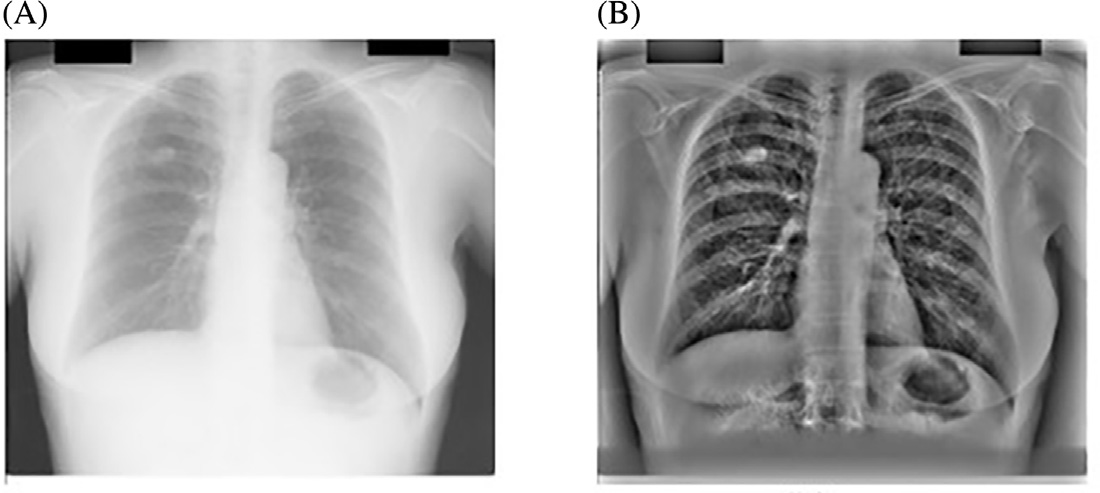
重复间隔估计为11个点长。因此,一个直接的解决方案是应用一个系数预先确定且固定的11点滑动平均FIR滤波器,其处理方式类似,并将结果M(x)用虚线绘制在同一张图上(图14.3)。可以看出,输出M(x)是平滑化版本,肋骨信号被抑制。这种平滑性是由于信号中对应于图像中肋骨边缘的高频成分被相对衰减所致。然而,为了对11点平均滤波器进行视觉评估,该滤波器被应用于图像的所有列上。结果如图14.5所示,其中明显看出,FIR滤波器模糊了胸部图像中存在的软组织,实际上可能模糊潜在结节的形状。如果将此图像输入结节检测机制,会导致检测到的结节具有更大的半径。因此可以安全地认为,固定线性滤波不适合在保留其余数据完整性的同时抑制肋骨。
需要一种FIR滤波器,其空间响应能很好地匹配不断变化的肋骨方向,从而在不扭曲结节的情况下选择性地实现肋骨抑制。过去,这类依赖数据的方向性线性滤波器是通过独立成分分析(ICA)和主成分分析等统计数据分析技术导出的,相关研究由Alonso等人(2004) Alonso等人(2004)、Veelen, Nijhuis, and Spaanenburg(1999)以及Bell和 Sejnowski(1997)完成。
独立成分分析(ICA)先前已被用于自然图像以推导滤波器,如 Hancock et al.(1992)所述。
研究发现,所得的滤波器主要是具有强局部特性的定向边缘滤波器。如果将此类定向边缘滤波器应用于胸部X光图像,则
图像将被分解为一组边缘图像。然而,这些边缘图像均无法为实现肋骨抑制目标的滤波器设计提供基础。
来自JSRT数据库的一组训练图像的前100个基向量,代表X光图像中存在的不同结构。
起始的基向量为低频,中间的基向量代表中频,而从最后的基向量可以明显看出其表示高频内容。
另一方面,通过自然图像获得的主成分分析滤波器是具有方向性的条形检测器,对应于图像中存在的低频结构(Field,1994)。数据驱动的PCA滤波器已被Minh和 Lee(2004)成功应用于语音识别。对于自然图像而言,主成分或通常所说的滤波器类似于高斯算子的导数。然而,已有研究报道的一个重要发现是:尽管自然图像的滤波器不依赖于尺度,但文本图像的滤波器却表现出高度的尺度依赖性。更令人惊讶的是,将文本图像中的一种滤波器与原始图像进行卷积后发现,该滤波器对词间空隙敏感。针对文本图像的研究结果为本文提出的动机提供了依据,即检验那些在空间频率上与给定X射线图像肋间隙距离相匹配的滤波器。
主成分分析(PCA)主要被用作数据分析和预测模型的工具。PCA通常在对给定数据集的每个属性减去均值后,利用其数据协方差矩阵进行特征值分解。从图像分析的角度来看,通常将图像块与整幅图像进行比较分析,这是因为肋骨可以在图像块中得到较好的表示。如果将图像块视为n维向量,则可形成一个n维空间,其中每个点代表一个图像块。一旦对这个n维数据空间应用主成分分析,就会旋转坐标轴,使得每一轴上的方差最大化。新的坐标轴将会产生,并按其方差内容的大小降序排列。这些坐标轴也被称为滤波器,因为使用其中少数几个轴重建数据时,可能会消除或保留某些空间特征。
在我们的方案中,主成分分析滤波步骤被用作每张输入X光图像的预处理步骤。通过在图像内随机选择区域来提取尺寸为 m × m 的方形块。从每个图像块的像素值中减去在所有图像块上估计得到的平均灰度级。然后使用高斯窗口对图像块进行掩膜处理,其标准差的选择方式使得图像块的边界距离中心超过三个标准差,以充分避免边缘效应。随后将图像块归一化到单位长度。
该列向量可被视为随机向量X的一种可能实现,代表生成所有这些图像块的源。通过收集许多这样的实现后,可以构建一个用于开发主成分分析滤波器的训练集。该训练集的平均向量定义为:
$$
\bar{x} = \frac{1}{M} \sum_{i=1}^{M} x^{(i)}
$$
每个X(i)与平均值的差异为向量D(i) = X(i) - $\bar{X}$。
设B = [D(1) D(2) … D(M)]为该训练集的表示。接下来,求出向量 μ 和标量 λ,它们分别是如下方程所示协方差矩阵的特征向量和特征值:
$$
C = B \cdot B^T \quad (14.1)
$$
设 A 是由 C 的特征向量构成的矩阵。A 的第一行对应最大的特征值,最后一行表示按降序排列的最小特征值。通常将 C 的这些特征向量称为基函数。在此情况下,即为主成分分析滤波器。通过对给定的胸部X光图像块进行主成分分析训练过程所得到的矩阵 A 在 图14.6 中进行了可视化展示。
图14.7中显示的前两行图14.7对应于低频,能够捕捉图像中的大尺度结构。这些行在很大程度上类似于一阶和二阶高斯导数算子。中间若干行提供了中频滤波器,而最后几行无疑是高频滤波器,且它们与高阶高斯导数算子的相似性显而易见。可以清楚地看出,这些滤波器按照其频率成分具有一定的顺序。通过对给定的X光图像与这些 FIR滤波器逐一进行卷积,将得到图像的主成分,即所谓的主成分图像,如图14.7所示。通过观察这些主成分图像,可以发现第四个主成分图像以肋骨结构为主要特征。
换句话说,在重建过程中,通过从原始图像中减去与肋骨结构相对应的主成分图像来获得去肋骨图像。在本例中,与肋骨结构相对应的主成分图像是基于第四个 PCA滤波器得到的。上述描述可用以下公式表示:
$$
L_{\text{ribsup}} = L - \alpha L_{\text{ribstruct}} \quad (14.2)
$$
其中,$L_{\text{ribsup}}$ 是去肋骨图像,L是原始图像,$L_{\text{ribstruct}}$ 是由包含显著肋骨结构的第四个基生成的图像。这里 α 是缩放因子,取值范围为 0–1,本研究在给定的实验中通常使用 α = 0.4。

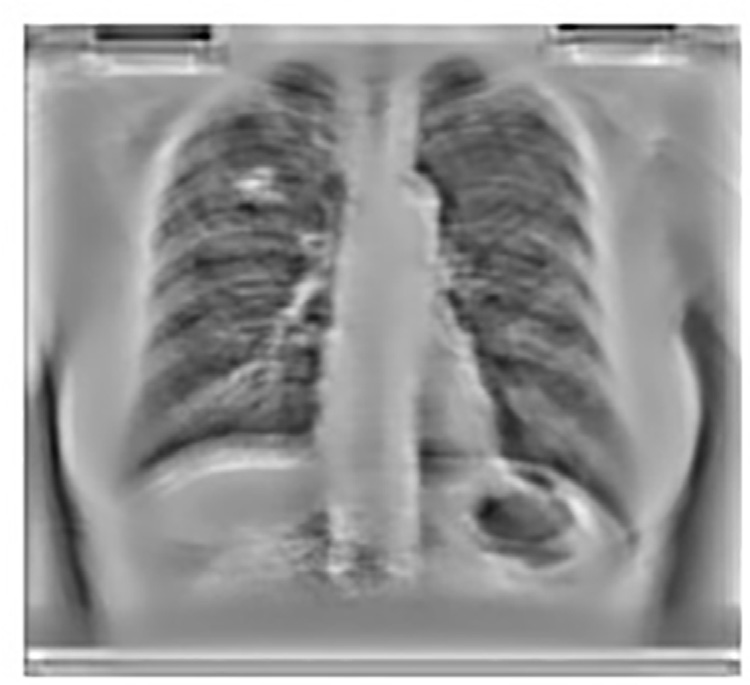
 局部归一化图像,(B) PCA数据驱动滤波器,(C) (B) 的三维图,显示对应于 二阶差分的峰尖和谷底)
局部归一化图像,(B) PCA数据驱动滤波器,(C) (B) 的三维图,显示对应于 二阶差分的峰尖和谷底)
减影处理后获得的图像是期望的去肋骨图像,其中因肋骨重叠而受影响的结节得以更好地显示。
应用PCA滤波后获得的图像如图14.8 所示,该图显示与使用均值滤波器提取的结果(如图14.5所示)相比,软组织受损更少。
为了评估尺度效应对所得到的主成分分析滤波器的影响,使用主成分分析技术从不同尺度的胸部X光图像中提取滤波器。本实验的目的是确定针对给定X射线输入图像(来自JSRT数据库的JPCLN009)应使用的合适图像块大小。对四种不同胸部X光图像进行降序子采样以降低空间分辨率,同时保持图像块大小不变。所提取的图像块如图14.9 左侧所示。结果,

图14.9现在显示出所提取的滤波器具有明显的尺度依赖性。请注意,符号差异并不重要,重要的是其绝对值显著标记了它们的方差。在该图中,第五列滤波器在空间频率上与肋间间距相匹配。特别是这种趋势可以在图14.9的第四行中明显看出。从第四行还可以观察到,第七列获得的滤波器其方向与肋骨上升边缘相匹配。图14.9 还描述了一个事实:相对于肋骨边界的水平边界,对应于一阶高斯导数的水平边界在其方差方面更强。由此实验得出结论:图像块大小(图14.9)对提取的PCA滤波器的影响:每一行包含原始图像块以及前八个PCA滤波器。前两行证实了提取到对肋骨敏感的滤波器,而后两行显示了对肋间隙敏感的滤波器,选择适当的PCA滤波器用于肋骨抑制时,图像块大小至关重要,其尺寸应使得仅有一根肋骨恰好位于图像块中央。
14.3 数据采集
所提出的肋骨抑制方案的改进效果需要进行定量评估。只有在获得这些结果所使用的数据库完全相同的情况下,才能进行评估并随后与早期方案进行比较。目前,大型 X射线数据库尚未公开用于测试计算机辅助诊断系统,但一些较小的X射线数据库是可获取的。只要这些数据库中的数据集具有足够大的变化性以代表不同的现实世界情况,就可以用于测试不同的CAD方案。
斑点尺寸和形状的变化。我们的结果有效性将高度依赖于所选择的数据库。
本实验研究选择了由日本放射线技术学会(JSRT)与日本放射线学会合作开发的 JSRT数据库(志村等人,2003)。此前已有两项计算机辅助诊断方案在该数据库上进行了测试,分别由 Coppini 等人(2003)和 Wei、Hagihara、Shimizu 与 Kobatake( 2002)完成。此外,该数据库具有足够大的变异性,适合作为标准数据库用于对比研究。数据库的具体信息如下:
JSRT数据库包含来自日本的13个医疗中心和美国的一个机构收集的247幅后前位胸部 X光片(14×14英寸)的数字化图像。数字化图像的矩阵尺寸为2048×2048,像素尺寸为0.175毫米像素尺寸,灰度为12位灰度级,对应0.0~3.5的光学密度范围。在 247幅图像中,154幅X光图像包含结节,93张图像无结节。在包含结节的154幅图像中,100幅包含恶性结节,54张包含良性结节。所有结节的位置均由三位胸部放射科医生确认,构成金标准。含多个结节的X光图像已在数据库中被剔除。数据库中的结节尺寸各异,其中31个结节直径为 0–10毫米,52个为11~15毫米,36个为16~20毫米,14个为21~25毫米,17个为26~30毫米,4个为31~60毫米。数据库中所有结节的平均大小为17.3毫米。
14.4 系统设计
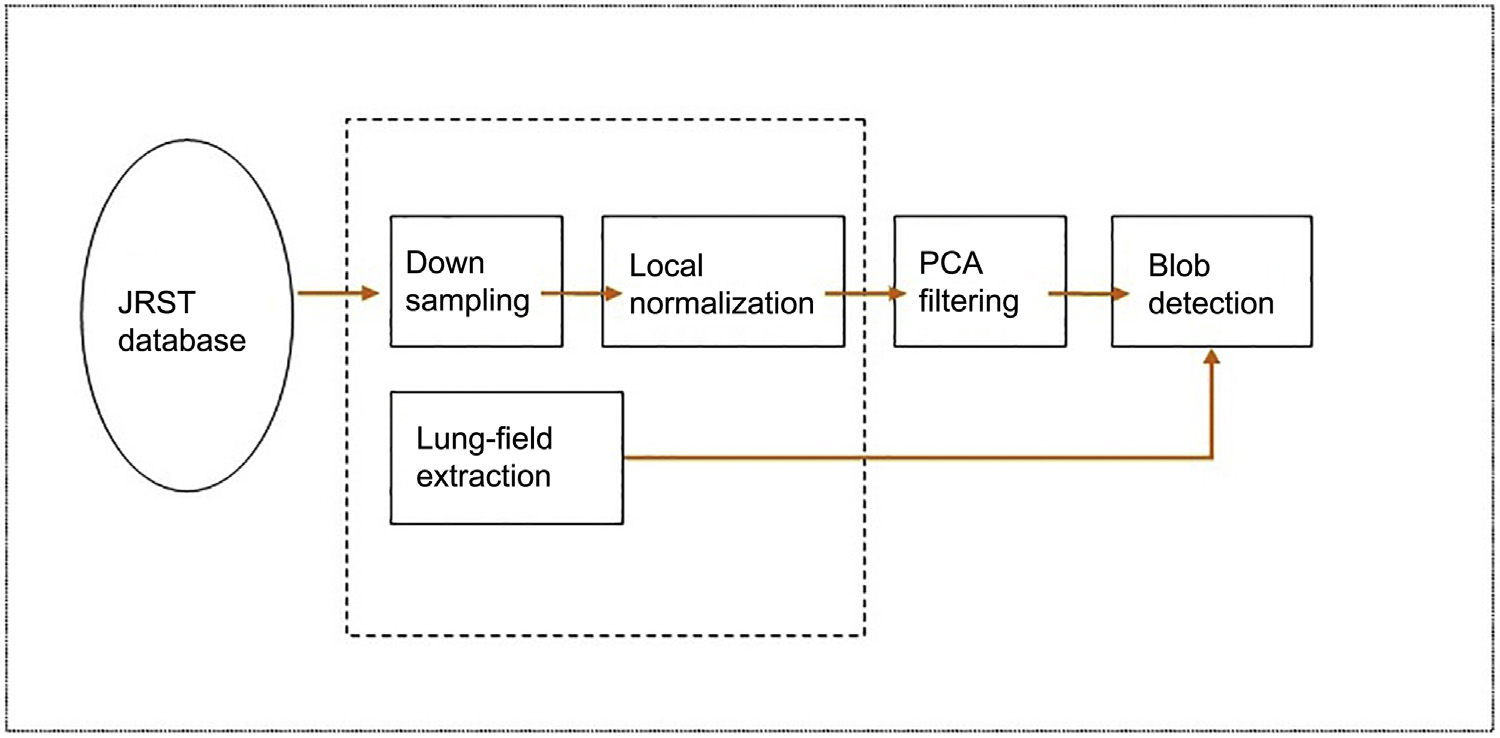
系统架构如图14.10所示。以下是对代表各个处理步骤的模块的说明。第一步是将图像的空间分辨率从2048×2048降采样至512×512。这样做的目的是为了便于实验,因为它可以显著减少计算时间。空间分辨率的降低对所获得的结果没有产生显著影响,且本文开发的方法同样适用于原始数据,正如Loog等人此前所声称的那样。二维图像的降采样过程是通过使用预滤波器来减少高频数据,然后去除所需数量的行和列来实现的。因此,在子采样之前,原始图像会先经过低通滤波处理,从而使降采样后的图像即使在包含高频内容的情况下也能最优地逼近原始图像。然而,最终的判断仍由终端的放射科医生做出。已经验证,从放射科医生的角度以及算法精度来看,斑点检测受此程度的空间分辨率降低的影响最小,这一点由林德伯格(1993)证实。林德伯格(1993)。

14.4.1 局部归一化
由于结节是肺野中体积小且难以区分的物体,因此需要增强结节与其背景之间的对比度,使结节更明显。采用一种称为局部归一化的方法,以在整个X光图像中获得全局均衡对比度。局部归一化图像如图14.11所示。图像的局部归一化处理如图14.12所示。
该过程解释如下。
从原始图像中减去高斯低通滤波图像。高斯低通滤波器提供X光图像的局部均值。
去均值图像随后除以相应的局部标准差。这里σ1和 σ2是用于高斯平滑函数的标准差,用于控制估计过程
局部均值和局部方差。在这种情况下,使用 σ1和 σ2等于10,这大约相当于肋骨的宽度。这将有助于结节的对比度增强,因为肋骨的对比度会在一定程度上减弱。
接下来的任务是肺野分割。
在肺野外检测到的任何结节都将被视为假阳性。如果要将结节检测器输出限制在肺野内,肺野分割是必要的。在此情况下,肺野被定义为未被心脏、纵隔以及膈肌下方结构遮挡的肺部区域。该步骤将显著减少假阳性数量,从而改善我们的结果。另一方面,不符合上述定义的部分肺野将不会被分析,系统会遗漏这些区域中的结节,并且在后续阶段也无法检测到。因此,在减少假阳性的同时,也存在降低真阳性的权衡。本研究中实施肺野分割,以显著减少在先前定义的肺野外检测到的假阳性。由于遗漏真阳性而导致的系统敏感性下降并不显著,这种权衡是可以接受的。为了分割肺野,采用主动形状模型(ASM;Freedman 等,2002)的方法。Lu 和 Rajapakse(2005)的报告提供了我们ASM的参数设置,并使用JSRT数据库的X光图像进行肺野分割训练。
14.4.2 多尺度结节检测
该数据库中的结节在尺寸上表现出显著差异,范围从6到60毫米。因此,结节检测本质上是一个多尺度问题,需要对图像数据进行多尺度表示。多尺度技术已广泛应用于结节检测。尽管存在其他斑点检测器,如高斯差分、Hessian行列式,但我们此处重点讨论使用最广泛的LoG检测器。
该检测器通过获取输入图像 L(x, y) 并使用高斯核进行卷积来工作。
$$
G(x, y; s) = \frac{1}{2\pi s} e^{-(x^2 + y^2)/2s} \quad (14.3)
$$
在某一尺度 s 上提供尺度空间表示。
$$
L(x, y; s) = G(x, y; s) * L(x, y) \quad (14.4)
$$
空间参数和尺度参数之间的分号通常被放置在那里,以明确区分这些参数。
然后是拉普拉斯算子
$$
L_{xx} + L_{yy} \quad (14.5)
$$
针对图像族中的每幅图像进行计算,这会对尺寸为$\sqrt{s}\sigma$的暗斑产生强烈的正响应。
在应用拉普拉斯算子后,需要在整个图像族之间逐像素地比较图像。为了进行更公平的比较,需要考虑使用尺度归一化拉普拉斯算子。
$$
\nabla^2 L(x, y; s) = s(L_{xx} + L_{yy}) \quad (14.6)
$$
然后检测在空间和尺度上同时为$\nabla^2 L$的局部极大值/极小值的像素。因此可以说,在离散情况下,给定一个二维输入图像L(x, y),会构建一个三维离散尺度空间族L(x, y; s),如果某个像素处的值大于其所有26个邻域像素的值,则将该像素标记为斑点。
14.4.3 离散X射线图像中结节的检测
使用主成分分析滤波器进行肋骨抑制后,X光图像中的结节检测通过上述尺度空间框架的离散实现来完成我们的LOG滤波器。总之,上述工作的实现步骤如下:
- 给定一幅离散的局部归一化且抑制了肋骨的X光图像(此处尺寸为512×512像素),选择一个用于分析的尺度范围(此处: $s_{\text{min}} = 1$ 到 $s_{\text{max}} = 16$)。在此范围内,设置一组尺度层级 $s_k$ (k=1, 2, …, 9),其分布使得相邻尺度层级之间的比值近似为常数。
-
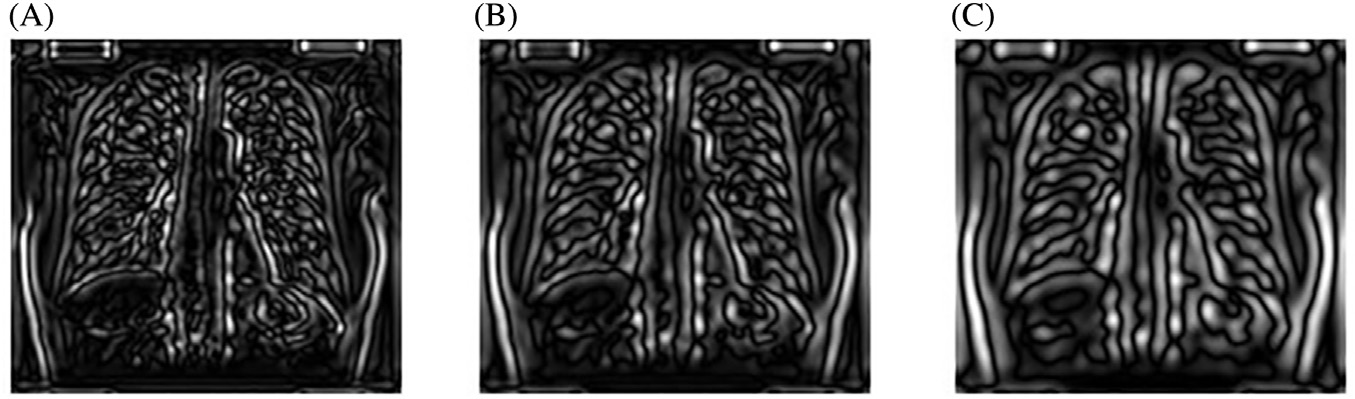
对于每个尺度 $s_k$,使用归一化拉普拉斯算子计算X光图像 L 的尺度空间表示。 图14.13 展示了该步骤的输出结果。可以看出,真实的结节能够在 σ = 4.6661处被正确检测到。
然而,观察到出现了大量假阳性。需要寻找方法来减少假阳性(图14.14)。不同尺度下结节检测结果叠加显示。注意,斑点通常在多个连续尺度上被检测到。对于每幅尺度图像,
 局部 归一化前;(B) 局部归一化后)
局部 归一化前;(B) 局部归一化后)
定义一个阈值,并检测大于该阈值的像素对应的空间位置及其响应。
- 这些位置及其对应的响应被记录在一个数组中。然后,将每个位置处的结节强度与最大半径斑点支持区域内的所有位置进行比较。具有较低强度的重叠斑点被消除。
14.5 实验
我们的实验第一部分包括肋骨抑制,然后进行多尺度斑点检测。下一阶段是适当的特征提取,接着是分类器的开发。
之前讨论的PCA滤波技术在完整的JSRT数据库上得以实现。生成的肋骨抑制图像作为多尺度斑点检测步骤的输入。首先使用多尺度斑点检测器获取X光图像中结节的尺寸和位置。该检测器的尺度范围覆盖 σ = 1–16像素,采用九个指数间距。随后,在建立尺度空间表示后,对斑点检测器的输出应用阈值以确定极值。这些阈值的设定考虑了图像中像素值的均值和标准差。在此阶段应用的阈值应允许最大检测,以确保所有真阳性结节均被检出,因为在本阶段遗漏的任何结节在后续阶段都无法恢复。结节的尺寸可通过其被检测到的尺度进行估计。
归一化迹在拉普拉斯算子中达到最大值的尺度被视为检测尺度。检测到的斑点的半径大约为检测尺度的一半。这些检测到的结节包含大量假阳性,具体数量取决于
 σ = 2.5198, (B) σ = 3.4290,和 (C)σ = 4.6661)
σ = 2.5198, (B) σ = 3.4290,和 (C)σ = 4.6661)
第14章 使用主成分分析滤波器改进胸部X光片中的结节检测
14.5 实验(续)
阈值设置。针对整个JSRT数据库获得检测器输出。这完成了我们实验的第一步。
由于斑点检测器的输出包含大量假阳性,因此实施了假阳性减少过程以减少假阳性的数量。我们的第一步减少措施是注意到其中一些假阳性出现在感兴趣区域之外。在这种情况下,研究人员关注的是肺野区域结节的检测。因此进行肺野分割,并随后移除在肺野之外检测到的所有结节。这在图14.15中进行了说明。
下一步是提取可用于分类器的适当特征。这些特征应经过仔细选择,以提高结节与非结节结构之间的可分性。斑点结构通常由嵌入在暗区中的明亮圆形区域组成。对比度框策略已成功用于检测斑点。该策略被推广以包含多尺度分析,从而根据给定的结节大小增加或减小框的尺寸。通过描述斑点在此框内和外的均值和标准差,可以获得合适的特征集。对比度框由两个区域组成。内部圆形区域可通过在感兴趣区域周围进行多尺度分析时检测到的半径为 σ 的圆标记。类似地,外部区域可通过另一个围绕内部区域、半径为 1.5×σ 的同心圆描述。在检测到的尺度上,计算检测点周围区域内及外部条带中的像素值的均值和标准差。这些均值和标准差通过应用区域生长算法获得正确的边界后计算得出。这些特征从更高分辨率(1024 × 1024)的X光图像中提取,以减少特征计算中的误差。
训练特征取自特征提取步骤。JSRT数据库包含154幅图像。对于每个检测到的结节,收集四个特征,即m1(内部区域的平均灰度级)、v1(内部区域灰度值的标准差)。
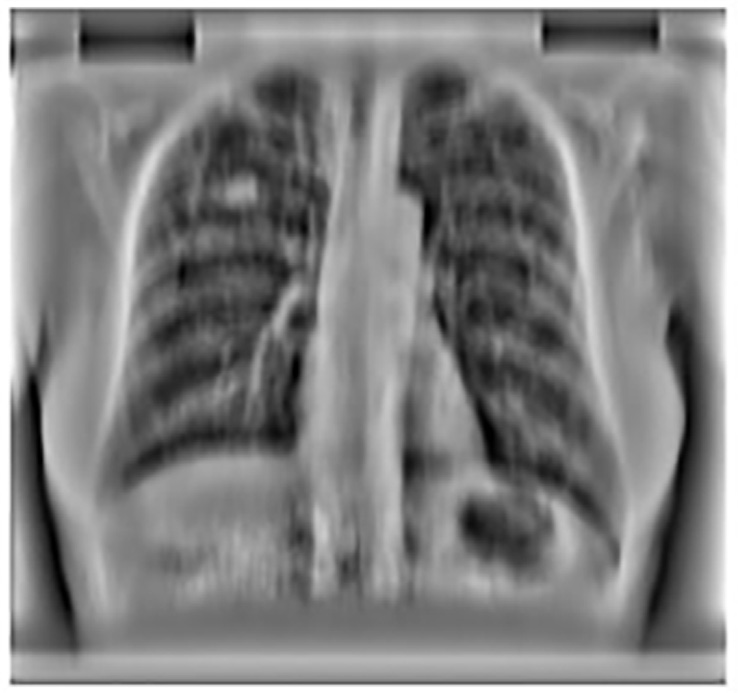
 通过主动形状分割获得的分割后的肺野。(B) 肺野分割后CAD方案的斑点 检测结果)
通过主动形状分割获得的分割后的肺野。(B) 肺野分割后CAD方案的斑点 检测结果)
m2(外部区域的平均灰度级),以及v2(外部区域灰度值的标准差)。为了提高类别可分性,即结节与非结节之间的区分度,采用线性判别分析(LDA)。LDA能够很好地处理类内频率不相等的情况,该方法通过最大化任意特定数据集中类间方差与类内方差的比值,从而保证最大的可分性。将类别可分性矩阵应用于四个提取的特征,并将其降维为两个高区分度特征。通过LDA获得的特征是m1−m2和v1−v2。所得的二维特征空间如图14.16所示。
实现了一个简单的k‐最近邻(kNN)分类器来对检测到的结节进行分类。在实验后,kNN分类器的后验概率为我们提供了检测到的结节的概率估计。后验概率是在考虑相关证据后分配的条件概率。kNN分类器在n维特征空间中搜索以找到k个最近邻。该分类器的后验概率为n/k,其中n是k个最近邻中实际结节的数量。可以通过设置kNN分类器后验概率的阈值来减少检测到的结节数量。针对斑点检测器的不同敏感性绘制了ROC曲线。通过调整kNN分类器的后验概率,可以调节斑点检测器的敏感性。
14.6 结果
多尺度斑点检测系统已被用作基本的结节检测方案。随后实施了不同的后处理和预处理步骤,以减少假阳性数量并提高计算机辅助诊断系统敏感性。
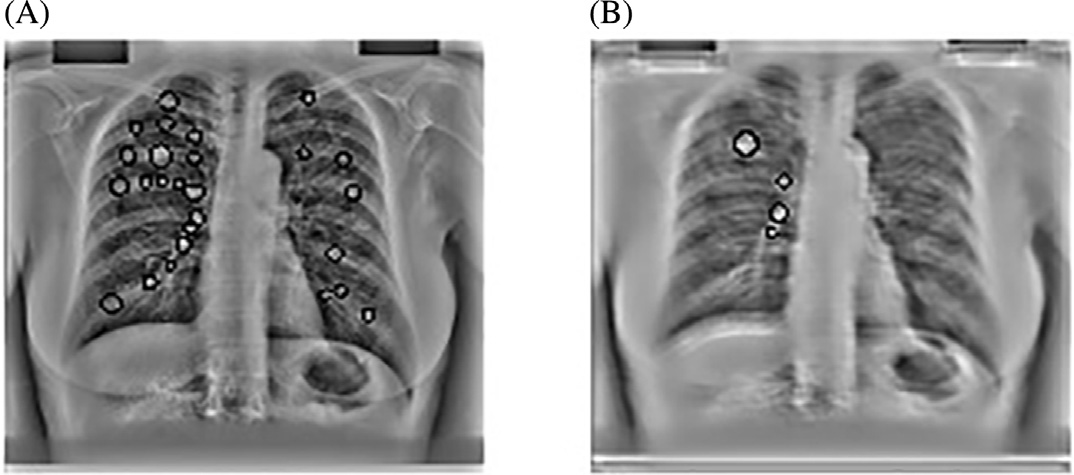
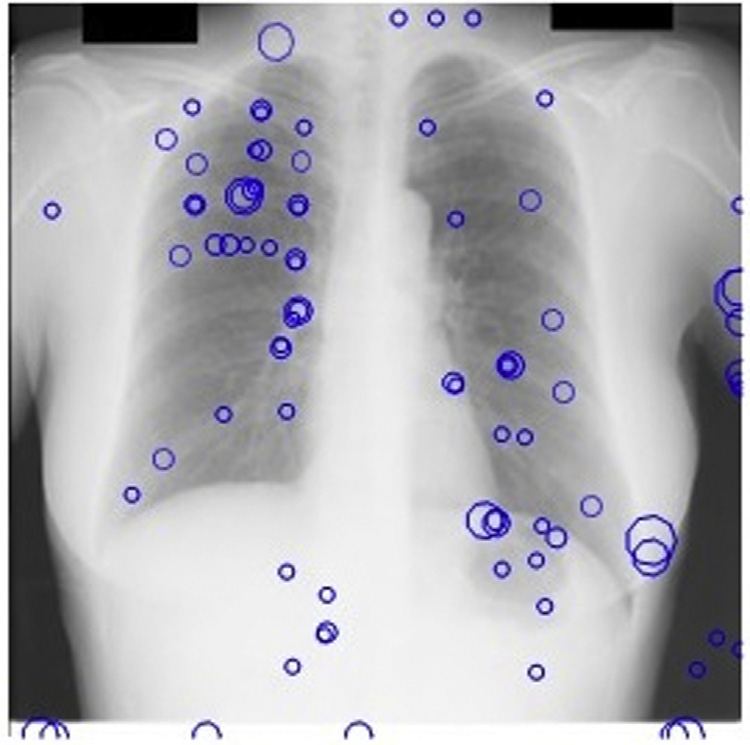
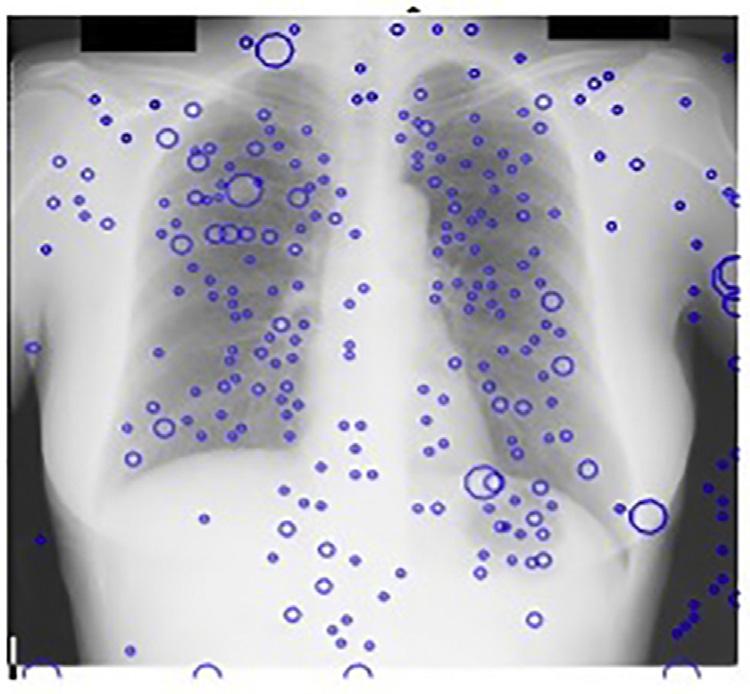
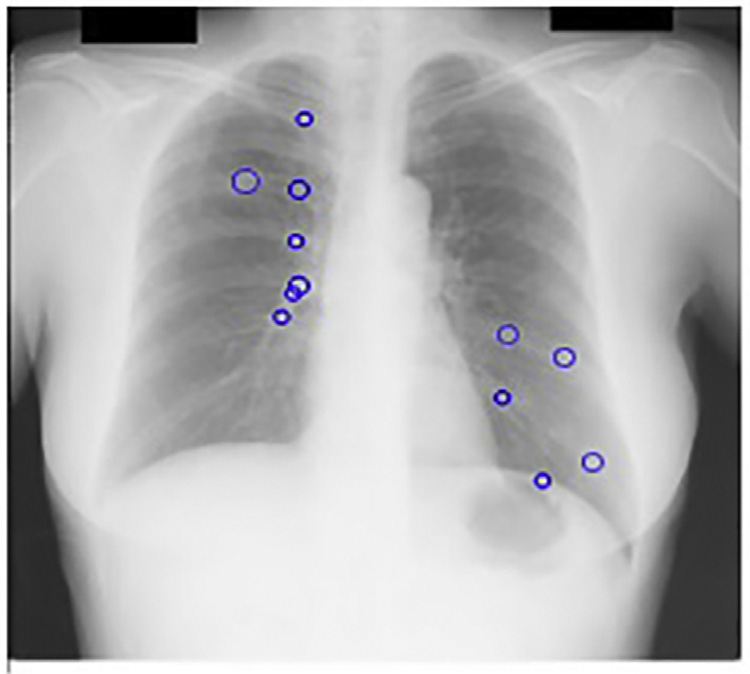
斑点检测器以JSRT数据库的X光图像作为输入。我们的多尺度斑点检测系统每幅图像平均检测到218个结节。由于在此阶段遗漏的任何真阳性在后续阶段都无法恢复,因此在获取多尺度LOG滤波器输出中的局部最大值时设置了较低的阈值。图14.17显示了基本CAD方案中我们的斑点检测器的输出。
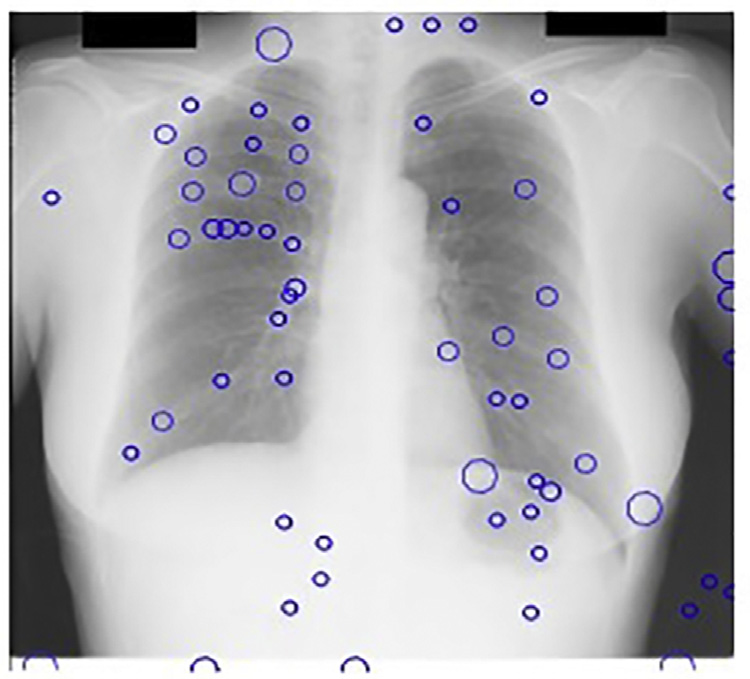
观察到,在我们的尺度空间图像中,68%的这些假阳性出现在前几个精细尺度上。
这些尺度存在大量高频噪声;因此,在从检测到的多尺度输出中选取最佳拉普拉斯‐高斯滤波响应时,可以安全地忽略这些尺度。这些响应作为kNN分类的种子点,如图14.15所示。仅保留最强的候选点。
采用PCA滤波作为预处理步骤的CAD方案输出(图14.19)。PCA滤波抑制了肋骨,从而消除了发生在肋骨上的假阳性。PCA滤波还增强了被肋骨遮挡的结节。
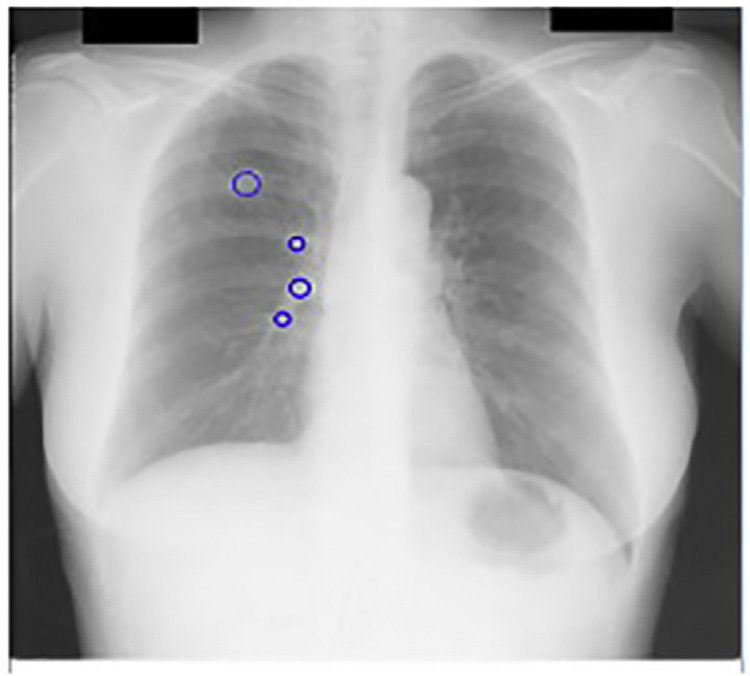
作为我们CAD方案的第一后处理步骤,移除了142个假阳性。在JSRT数据库中这些尺度下没有候选结节,因此真阳性未减少。图14.18显示了我们的CAD方案的输出,其中前几个精细尺度的输出被忽略。
肺野分割通过去除肺野外检测到的局部最大值,进一步减少假阳性。肺野是指未被心脏、纵隔和膈肌下方结构遮挡的肺部区域。154个候选结节中有13个位于被遮挡或隐藏的肺部区域。丢失这13个真阳性导致计算机辅助诊断系统敏感性下降。这些真阳性在后续后处理步骤中无法恢复。肺野分割后,计算机辅助诊断系统敏感性下降8.4%。
每幅图像中位于肺野外的25个候选结节因此被去除。图14.15显示了肺野分割后的计算机辅助诊断系统输出。
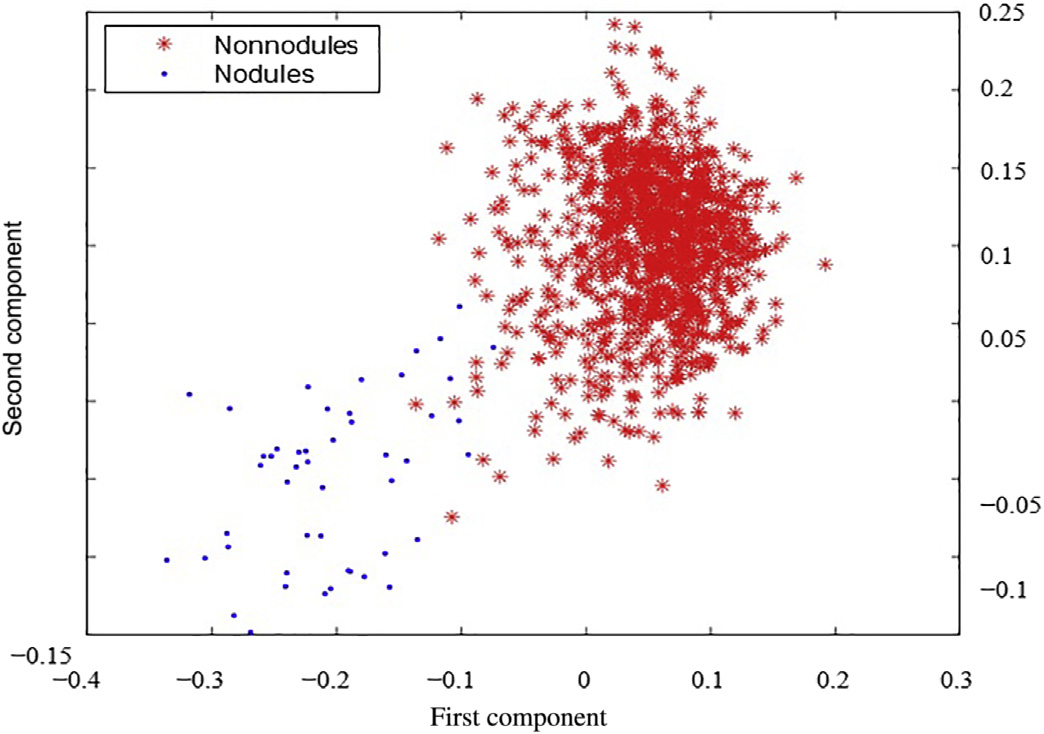
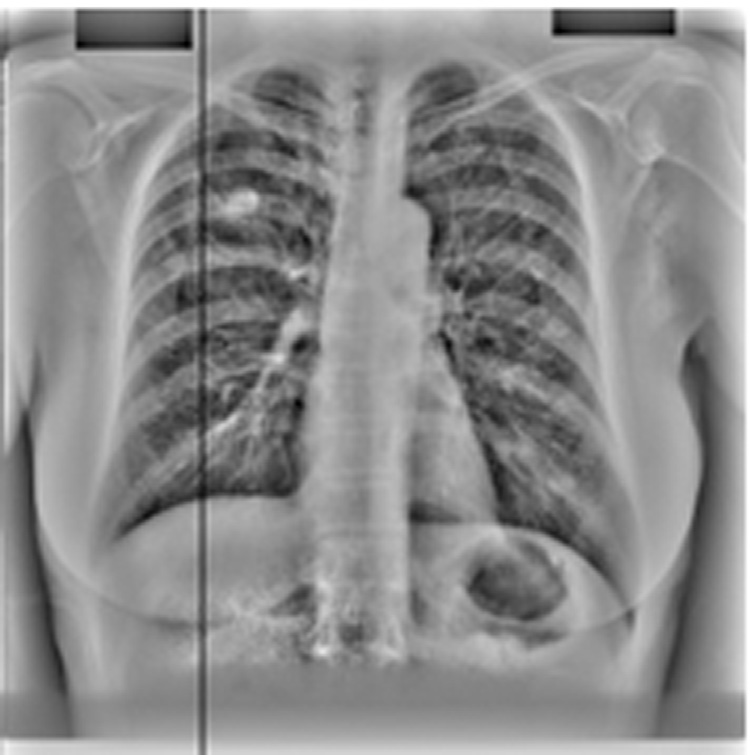
kNN分类被添加为第三个后处理步骤,进一步将每幅图像检测到的结节数量减少至13个。图14.16展示了为JSRT数据库构建的特征空间,其中特征是之前定义的选定特征。图14.19展示了我们的计算机辅助诊断系统在kNN分类后的输出结果。
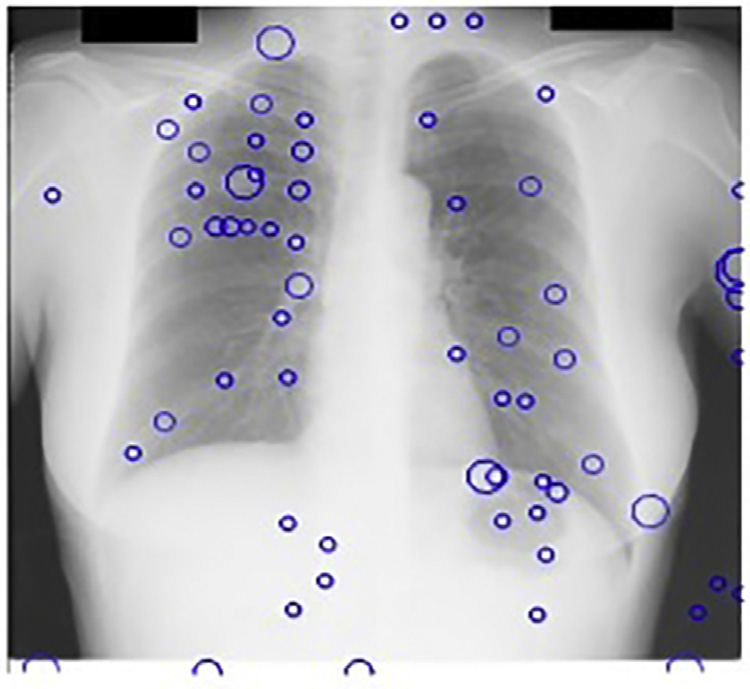
我们的最终第四种策略是将主成分分析滤波后的肋骨抑制图像作为计算机辅助诊断系统的输入。图14.20中可明显看到肋骨抑制的效果。采用主成分分析滤波后,每幅图像保留的候选结节平均数量降至三个。在肋骨边缘会检测到大量假阳性,而当输入为肋骨抑制图像时,这些假阳性被有效去除。此外,主成分分析滤波还提高了计算机辅助诊断系统的敏感性,因为被肋骨遮挡的癌结节变得更加显著。
通过调整kNN分类器的后验概率来调节我们斑点检测系统的敏感性。本系统的敏感性定义为分类步骤后检测到的真阳性数量与检测到的结节候选对象总数之比。图14.21 是通过绘制每幅图像检测到的假阳性数量对应的敏感性水平而构建的。
14.7 自动化肺结节检测对下一代医疗系统的影响
胸部X光采集技术的最新进展提高了小结节的检出率,其中包括周围型肺癌(Ko, Rusinek,&Naidich, 2003)。然而,尽管新制造的X光机具有更高的空间和对比度分辨率,放射科医生在检查胸部X光时仍会遗漏结节病变。导致结节检测困难的主要因素之一是其直径小于5毫米的小尺寸,以及这些小结节大多部分被肋骨和其他骨性结构遮挡的事实。直径小于5毫米的结节由于颜色变化多样而最具挑战性,如果它们隐藏在主要肋骨之下,则增加了额外的复杂性。多项研究表明,计算机辅助诊断系统的敏感性与放射科医生相比并无显著差异。研究发现,放射科医生在检测附着于肋骨的结节方面更为敏感,而计算机辅助诊断系统则更擅长发现孤立的小结节(Lee等,2004)。
计算机辅助诊断系统的敏感性评分低于放射科医生的原因在于计算机模型无法有效抑制肋骨。检测小结节尤其是被肋骨遮挡的结节非常重要,因为它们的体积倍增时间是
恶性肿瘤的预测因子。通过本章所述的明确讨论在X光图像中抑制肋骨的方法,必将提高计算机辅助系统的敏感性,并使其超越放射科医生的检测能力。因此,肋骨抑制附加组件将提升计算机辅助系统水平,从而为X光扫描提供第二视角。
14.8 讨论和结论
在应用多尺度CAD方案之前使用PCA滤波器所获得的输出非常高效且前景良好。本研究使用了Shiraishi等人(2000年)提供的国际公开JSRT数据库对所提出的算法进行评估。JSRT数据库中肺癌结节的尺寸和位置与现实世界情况非常相似。这些癌结节的尺寸范围为6到60毫米。Shiraishi等人(2000年)指出,放射科医生在JSRT数据库中检测细微结节非常困难。仅有50%的明确检测率,其中放射科医生平均检测出85%的可处理病例和44%的困难病例。在平均每幅图像三个假阳性的情况下,我们的方案正确标记了46%的困难病例和84%的可处理病例,如图14.21所示。这表明我们的方法在临床评估中具有重要价值。将我们的CAD方案与其他同样使用相同JSRT数据库的研究相比,显示出我们的工作更为有效。Freedman等人(2002年)在相同数据库上测试了RS‐2000系统,该系统在每幅图像平均五个假阳性的条件下检测出66%的结节。然而,RS‐2000已在超过10,000例病例中证明其价值并获得FDA批准。为了达到 Wei等人(2002年)的性能,使用了202个不相关特征;这引起了一些担忧,因为这意味着系统使用的特征数量超过了数据库中假阳性样本的数量,从而导致系统过拟合的风险较高。在每幅图像5.4个假阳性的情况下,我们的CAD方案达到了73%的敏感性,并且使用的特征少于20个。Coppini等人(2003年)也使用了JRST数据库,其计算机辅助诊断系统在每幅图像4.3个假阳性的情况下仅达到60%的敏感性。Loog 等人同样使用JRST数据库,在每幅图像四个假阳性的情况下发现敏感性仅为41%。据称,提出的结果优于Wei和Loog报告的结果。
所提出方案的主要缺点是无法检测到某些微小的结节。未来,研究人员正致力于开发一种多尺度增强技术,该技术将与本文所使用的多尺度检测方法协同工作。为此,目前团队正在开发一种多尺度IRIS滤波器(英史等人,1996),旨在在多尺度检测环境中能够检测到最微小的结节。
随着技术的进步,智能医疗领域的创新为医疗系统带来了诸多改进,使人类生活更加舒适。在学术界、政策制定者、技术人员和医疗保健专家等多方利益相关者的推动下,该领域正在快速发展。
如今,我们生活在信息时代,健康信息学需要尽可能地吸收和利用技术领域的先进发展成果。目前有多个领域亟需开展研究,将健康与网络与通信技术、智能高效的决策支持系统、深入高效的数据分析以及整体的安全范式进行融合。本文所展示的研究即是一个典型示例,明确体现了计算机技术在改进诊断系统的同时,显著降低了患者所受的辐射风险。
14.9 教学任务
- 说明为何在胸部X光分析中肋骨抑制是必要的。
- 描述各种肺结节检测技术。
- 描述各种基于软件的肋骨抑制方法。
- 详细描述一种肋骨抑制技术如何有助于提高计算机辅助设计在胸部X光筛查过程中的敏感性(图14.22)。





















 1095
1095

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








