本文内容速览:
有的小伙伴向小远反馈,在进行基因编辑后,发现部分植株出现生长异常、无法结籽,甚至得不到纯合的编辑植株。其实,这是因为植物的生长发育依赖于复杂而精密的遗传调控网络,有些基因在生命活动中发挥着不可替代的作用,当这些基因的功能发生异常时,往往会打破调控平衡,导致配子体缺陷、胚胎发育受阻或个体死亡,即出现所谓的致死突变表型。植物致死突变主要分为两类:功能丧失突变和功能获得突变。功能丧失突变是大家相对熟悉的类型,即植物体内的必需基因因突变而失去正常功能,导致基础代谢、细胞结构或生长发育受到破坏。功能获得突变致死的情况同样值得关注,这类突变并非基因功能的缺失,而是由于基因突变后产生新功能,或是在错误的时空条件下被异常激活,从而打破了植物的调控网络平衡。研究人员已鉴定出一些与配子体发育、叶绿体形成、激素调控和免疫稳态等相关的致死基因,今天就跟着伯小远一起了解这些基因在植物致死突变中的关键调控功能吧。
1、配子体致死基因(ROS1)
2020年5月,江苏省农业科学院粮食作物研究所杨杰课题组联合澳大利亚联邦科学与工业研究组织朱乾浩课题组在Plant Biotechnology Journal杂志上发表了一篇题为“CRISPR/Cas9-targeted mutagenesis of the OsROS1 gene induces pollen and embryo sac defects in rice”的研究论文,作者利用基因编辑技术获得了OsROS1基因的多个等位突变体,明确了该基因调控水稻雌雄配子体发育的功能。
作者以OsROS1的第1和第15外显子中的特异序列作为靶序列,构建了2个基因编辑载体pOsCas9-TS1和pOsCas9-TS2,并分别通过农杆菌介导法转入水稻镇糯19中,获得了14个T0代突变体(图1a-c)。其中12个为移码突变体,这些移码突变导致OsROS1产生提前终止的异常蛋白,最终使T0代突变体完全不育,无法产生种子,其突变等位基因也无法传递到T1代(图1d)。进一步观察到,与野生型相比,移码突变体株系的小花结构无异常,但是花粉和胚囊发育存在缺陷(图1f-j)。通过移码突变体和野生型之间的杂交实验,作者发现OsROS1移码突变体的不育表型是由于雄配子体和雌配子体的缺陷共同造成的(图1e)。另外2个T0代突变体为双等位基因杂合突变体(株系1-3-3和2-4-7),其两条染色体分别携带移码突变和框内突变(突变未导致基因编码区阅读框移位,仅导致少量氨基酸缺失,且缺失的碱基数目为3的倍数),这两个突变体可产生种子,且结实率较低(分别为7.3±2.2%和5.8±2.9%),其T1代均为纯合框内突变,且结实率恢复至与野生型相当水平,表明框内突变的等位基因可高效传递给子代,并且未对配子体发育造成致命影响(图1d)。
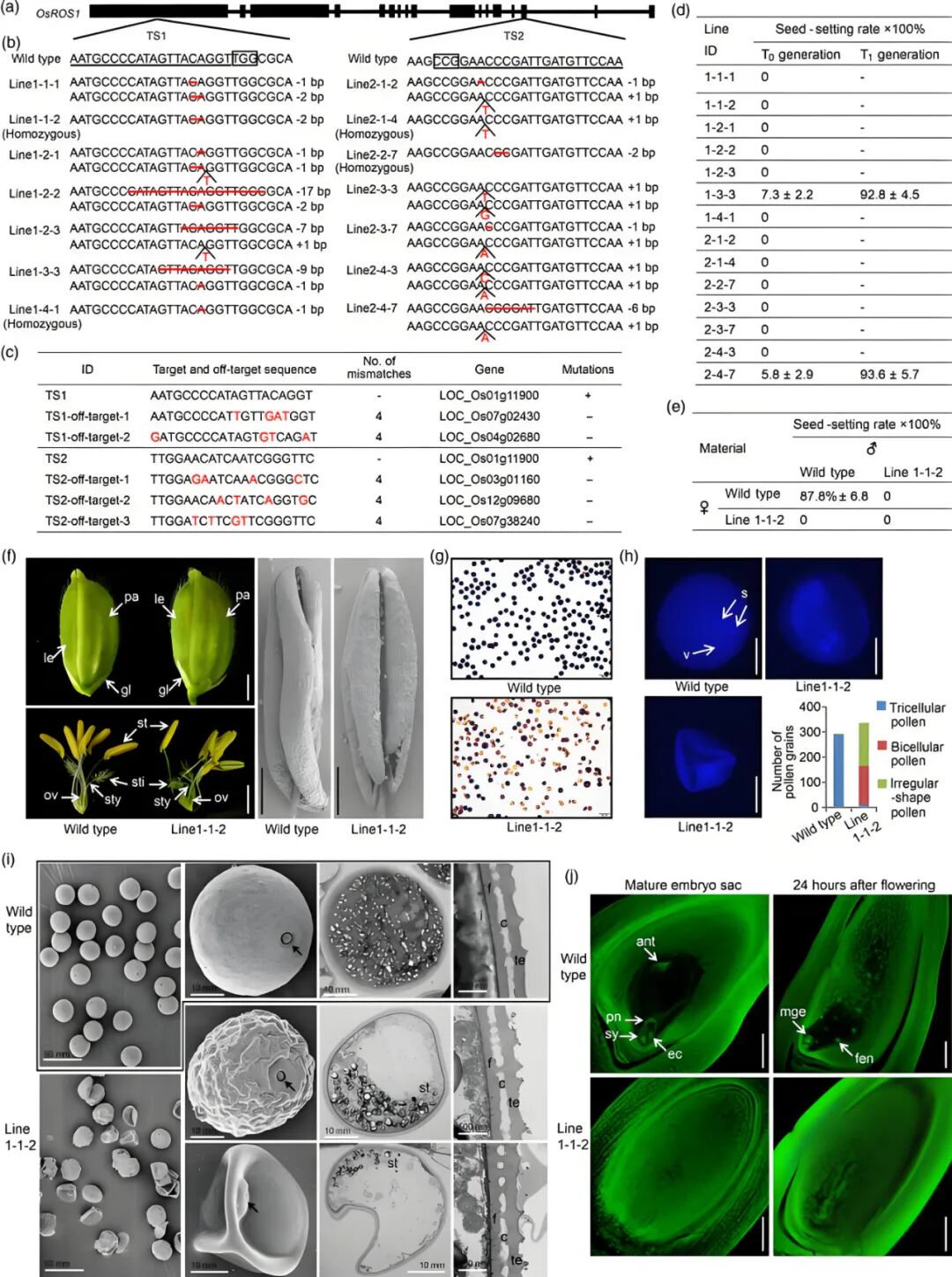
图1 利用CRISPR/Cas9技术对水稻OsROS1基因进行靶向突变,可诱导花粉和胚囊缺陷(Xu et al., 2020)。(a)靶基因OsROS1的示意图;(b)敲除株系突变情况;(c)脱靶效应检测。+,检测到突变;−,未检测到突变;(d)OsROS1敲除株系的结实率;(e)正反交的结实率;(f)小穗外观对比(左上图)、去除外稃和内稃后的小穗(左下图)以及花药的扫描电镜图像(右图);(g)成熟花粉粒的碘化钾染色;(h)DAPI染色结果以及三细胞、双细胞和不规则形状花粉粒的统计。s,精子核;v,营养细胞核;(i)花粉粒的扫描电镜(左两图)和透射电镜(右两图)观察。箭头指示萌发孔。st,淀粉粒;i,内稃层;f,基部;c,中柱层;te,外稃层;(j)成熟胚囊与开花后24小时胚囊的比较。ant,反足细胞;ec,卵细胞;pn,极核;sy,助细胞。mge,多细胞球状胚;fen,游离胚乳核。
2、胚胎致死基因(SEC、SPY)
拟南芥中两种O-糖基转移酶SECRET AGENT (SEC)和SPINDLY (SPY)的双突变会导致胚胎在不同发育阶段死亡,无法获得存活的双突变体幼苗,而单一突变体可正常存活,表明这两种酶在植物发育中发挥协同且关键的作用(Hartweck et al., 2002;Hartweck et al., 2006)。由于SEC和SPY双突变引发的胚胎致死效应限制了对二者协同作用的研究,2024年1月,英国John Innes Centre细胞与发育生物学系Laila Moubayidin课题组在Nature Plants杂志上发表了一篇题为“O-glycosylation of the transcription factor SPATULA promotes style development in Arabidopsis”的研究论文,作者构建了地塞米松(DEX)诱导型SEC RNAi载体,以降低spy-3背景中的SEC mRNA水平,模拟SEC与SPY双酶活性缺失的胚后状态。作者设计了两个SEC基因特异性靶标序列(a1SEC、a2SEC)以降低脱靶概率,随后通过qRT-PCR技术检测转基因株系,发现仅含a2SEC靶标序列的株系在DEX处理后显著降低SEC转录水平(图2b)。DEX诱导后,SEC RNAi spy-3株系花柱长度显著缩短,花柱细胞伸长受阻,细胞分化标记(蜡质/褶皱结构)缺失(图2a、d);除花柱外,该株系的果实长度也出现缩短(图2e),幼苗的根变短(图2f),并且经过13天DEX处理后,幼苗生长停滞(图2g)。这一结果再次印证了SEC与SPY在植物不同发育阶段的协同调控作用。
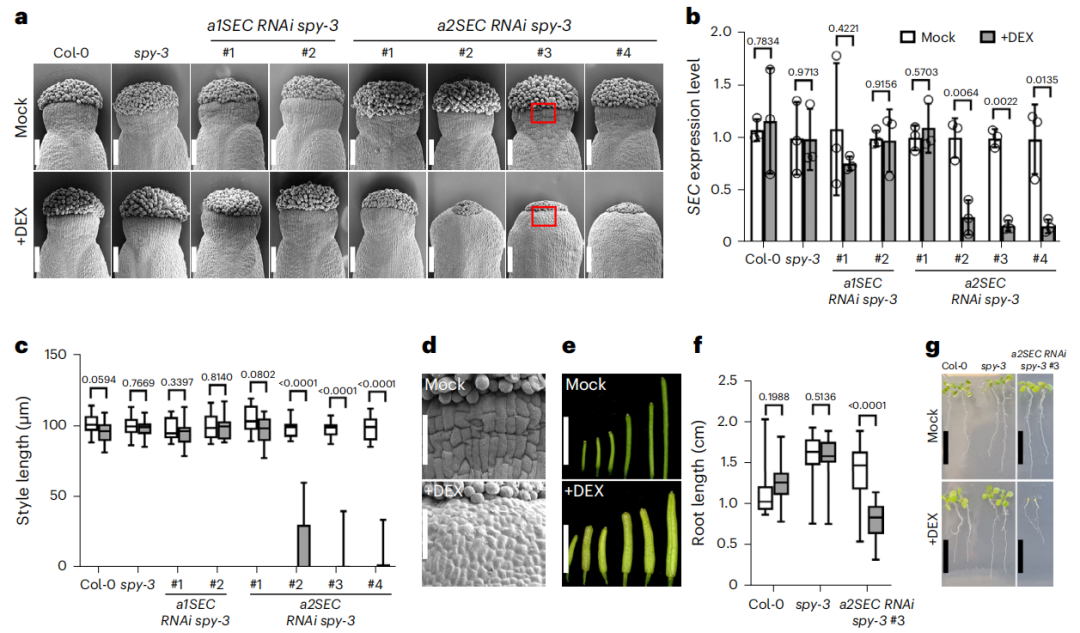
图2 在spy突变体背景下,SEC功能缺失会对植物的营养生长和生殖生长均产生影响(Jiang et al., 2024)。(a)用扫描电子显微镜(SEM)对野生型拟南芥(Col-0)、spy-3突变体以及SEC RNAi spy-3转基因株系的12时期雌蕊进行观察,分别采用模拟处理和DEX诱导处理;(b)qRT-PCR检测经模拟处理(白色柱形)和DEX诱导处理(灰色柱形)后,SEC RNAi spy-3转基因株系及对照株系花序中SEC基因的表达水平;(c)花柱长度测量结果;(d)a中的红色方框放大图;(e-g)野生型拟南芥(Col-0)和SEC RNAi spy-3的花序经模拟处理和DEX诱导处理后,不同发育阶段果实的形态(e)、根长(f)、幼苗生长状态(g)。
3、叶绿体发育与白化致死基因(ALS1)
2023年11月,广西大学覃宝祥课题组在Plant Science杂志上发表了一篇题为“Disruption of the rice ALS1 localized in chloroplast causes seedling-lethal albino phenotype”的研究论文,作者鉴定并表征了一种具有幼苗白化致死性表型的水稻突变体als1,该突变体在芽期出现白化表型,在单叶至三叶期表现出显著的白化特征并逐渐停止生长最终死亡(图3A-F)。与野生型相比,als1突变体中总叶绿素、叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素的含量均较低(图3J)。此外,als1突变体的冠根数、第二叶和第三叶宽度均显著减少(图3G-I),并且als1突变体叶片变窄主要是由于小维管束数量减少所致(图3K-V)。
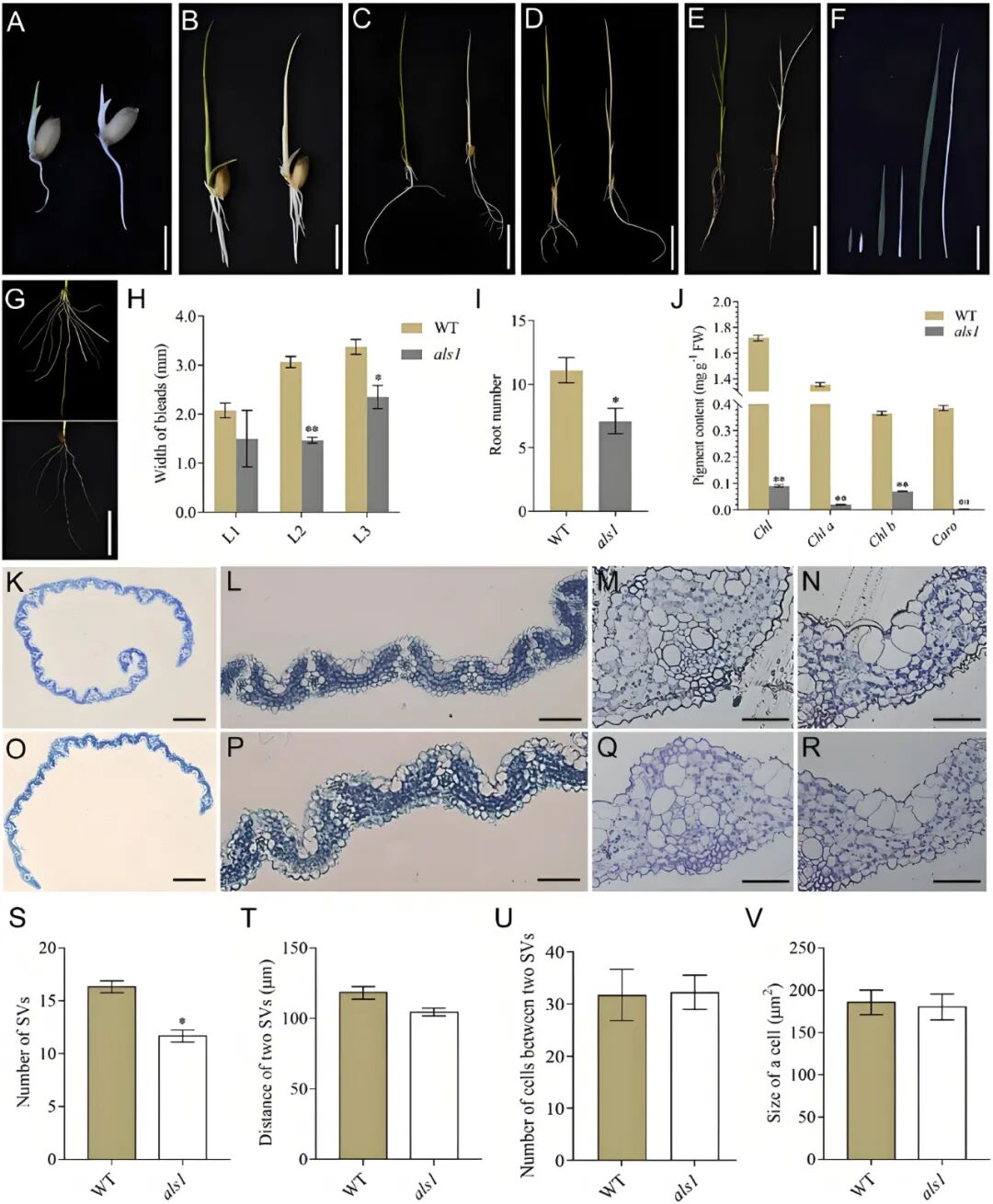
图3 als1幼苗的表型分析(Xu et al., 2024)。(A-E)野生型(左)和als1突变体(右)幼苗在发芽后2天(A)、4天(B)、6天(C)、10天(D)和15天(E)的表型;(F)野生型(左)和als1突变体(右)的叶片;(G)土壤培养条件下,幼苗期野生型(上)和als1突变体(下)根系的比较;(H-J)幼苗期野生型和als1突变体叶片宽度比较(H)、根数比较(I)、色素含量比较(J);(K-N)野生型第三片叶片的横切面;(O-R)als1突变体第三片叶片的横切面;(S-V)野生型和als1突变体的小维管束数量(S)、两个小维管束之间的距离(T)、两个小维管束之间的细胞数量(U)、两个小维管束之间的细胞大小(V)。
als1突变体的光能捕获和转化受到严重抑制,导致光合效率下降(图4A-D)。als1突变体叶片中叶绿体数量较少,且叶绿体结构发生显著改变,无法形成类囊体片层结构(图4H-J)。
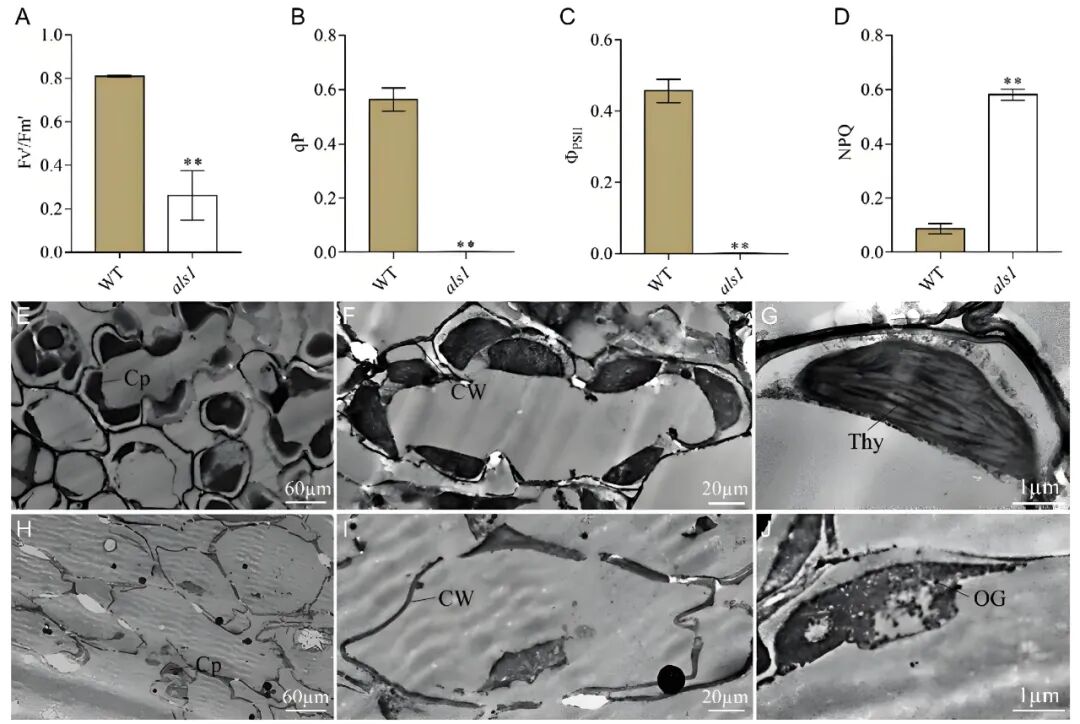
图4 野生型和als1突变体叶片的叶绿素荧光参数及透射电镜(TEM)观察结果(Xu et al., 2024)。(A-D)比较野生型和als1突变体中叶绿素荧光参数的Fv'/Fm'、qP、ΦPSII和NPQ值;(E-G)野生型叶片的细胞结构;(H-J)als1突变体叶片的细胞结构;Cp为叶绿体;CW为细胞壁;OG为嗜锇颗粒;Thy为类囊体。
由于als1突变体幼苗致死,突变体种子只能通过杂合植株保存。为了分析ALS1的遗传特性,作者将杂合植株(ALS1/als1)与野生型籼稻品种9311杂交。发现所有F1代杂交植株均为绿色,且在杂合F1代植株的子代F2中,野生型与als1突变体的比例约为3:1。这些结果表明,als1突变体的表型受一个隐性基因调控。从F2群体中选取表现出白化表型的隐性个体进行连锁分析,发现als1突变体的ORF4(Os02g0595700)在起始密码子上游258bp处插入了一个碱基T,导致移码突变和终止密码子的提前出现。通过遗传互补实验证明,向als1纯合突变体中转入野生型ALS1基因可完全恢复其叶片白化表型,进一步验证了ALS1基因的功能(图5)。
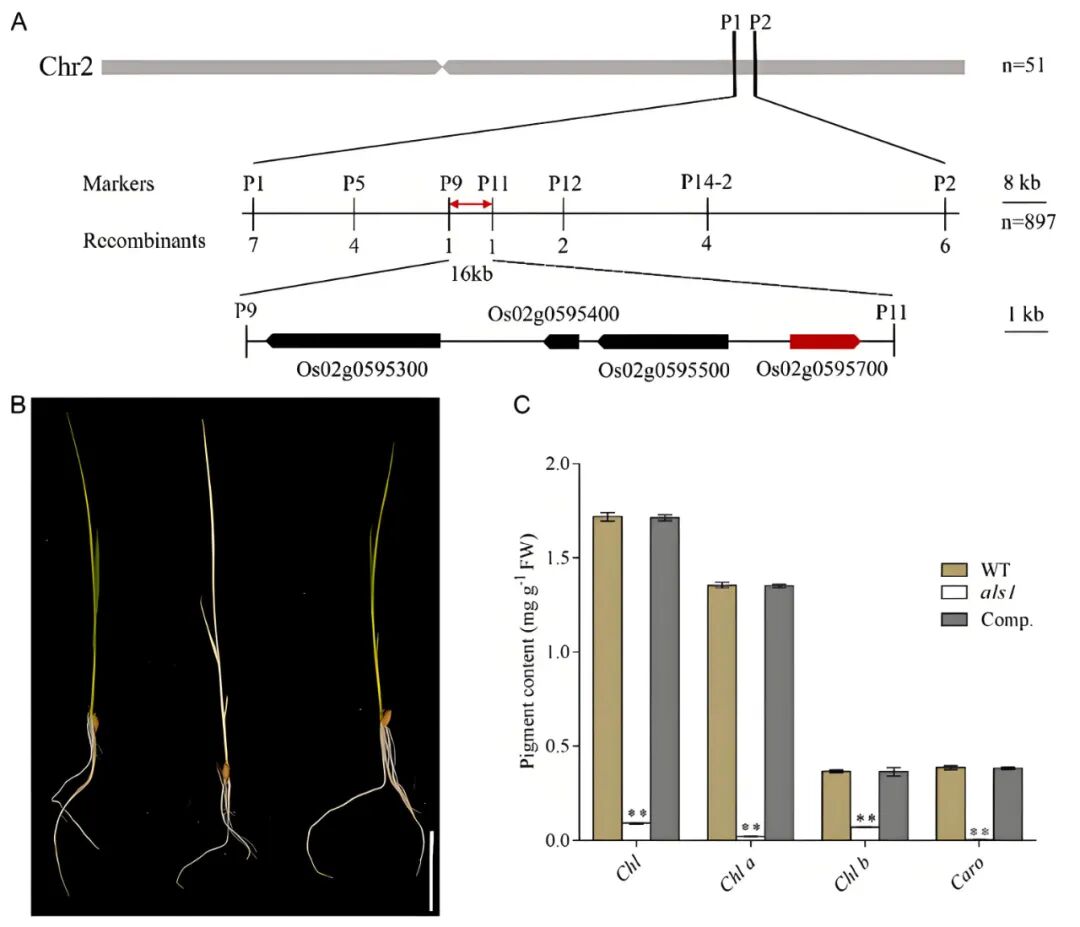
图5 ALS1的分子克隆(Xu et al., 2024)。(A)ALS1基因的图位克隆;(B、C)野生型(左)、als1突变体(中)和互补系(右)的幼苗表型(B)、叶绿素含量(C)。
4、自发坏死基因/免疫型致死基因(mDES1、RBL1)
2021年2月,美国俄克拉荷马州立大学严六零课题组在Plant Physiology杂志上发表一篇题为“A semi-dominant NLR allele causes whole-seedling necrosis in wheat”的研究论文。该研究在小麦中鉴定出一个半显性突变等位基因mDES1,其在无病原菌或外部刺激下可导致幼苗全株坏死,该表型由核苷酸结合亮氨酸重复序列(NLR)蛋白的点突变导致,揭示了植物坏死、凋亡与自身免疫的关联机制。
作者在研究E3基因的RNAi转基因小麦后代中,偶然发现了一株在幼苗阶段自发坏死的突变体,其表型与E3-RNAi无关,推测是转化或组培过程中产生的新突变。遗传分析表明,该坏死表型由半显性基因控制,杂合子表现为半致死性(个体在生长发育过程中,仅有部分个体存活,部分个体死亡的表型),纯合子在10-14天内死亡,符合1:2:1的分离比(图6a)。通过图位克隆技术,将目的基因定位在3DL染色体59.24kb区域,最终确定候选基因为TraesCS3D01G474300(命名为DES1)。序列分析显示,mDES1相较于野生型DES1发生G→A单核苷酸突变,导致441位氨基酸由天冬氨酸(Asp)突变为天冬酰胺(Asn)(图6b-h)。
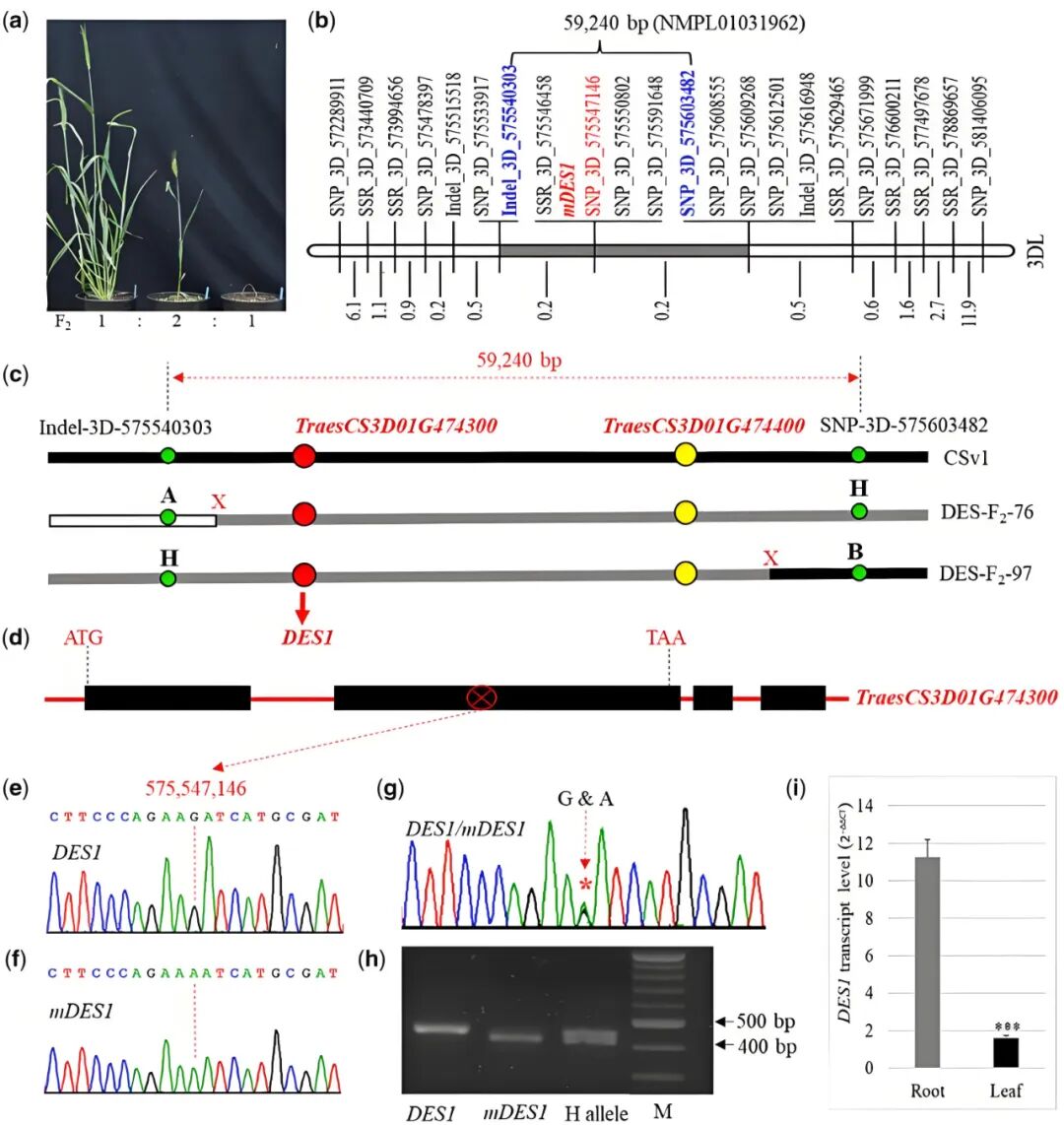
图6 mDES1的定位和克隆(Jia et al., 2021)。(a)Sumai3 mDES1×白小麦群体F2代植株的表型;(b)mDES1在3DL染色体上的遗传图谱;(c)mDES1两侧最近的两个标记Indel_3D_575540303和SNP_3D_575603482的物理距离,在两个侧翼标记之间的靶区域中鉴定出两个候选基因TraesCS3D01G474300和TraesCS3D01G474400;(d)TraesCS3D01G474300的基因结构;(e)纯合DES1等位基因的部分序列;(f)纯合mDES1等位基因的部分序列;(g)杂合DES1/mDES1等位基因的部分序列;(h)用于检测DES1和mDES1等位基因变异的诊断性PCR标记;(i)野生型Sumai3幼苗期根和叶中DES1的表达。
将mDES1转入野生型小麦,T0代植株表现为半致死性,T1代中含mDES1的纯合植株全部坏死,证实该基因直接引发幼苗死亡(图7a、b)。在本氏烟草叶片和原生质体中表达mDES1,在mDES1侵染区域出现类似超敏反应的细胞死亡,并在侵染后2天自发激活细胞程序性死亡(图7c)。表达mDES1的原生质体会死亡并聚集在一起,呈现绿色块状,而大多数表达DES1的原生质体仍然存活(图7d)。这些结果表明,小麦mDES1能够诱导本氏烟草叶片侵染区域和原生质体的细胞死亡。

图7 DES1/mDES1在转基因小麦中的功能验证(Jia et al., 2021)。(a)在培养管中表达mDES1的转基因T0代小麦植株(mDES1-OE20);右侧为阳性转基因植株(+),左侧为非转基因植株(−);(b)在MS培养基中表达mDES1的转基因T1代小麦植株,左侧为野生型(−−),中间为杂合转基因植株(−+),右侧为纯合转基因植株(++);(c)使用表达DES1和mDES1的农杆菌侵染烟草叶片,分别在侵染后2、3和4天对代表性叶片进行拍照;(d)将DES1和mDES1构建体转化到烟草原生质体中,将原生质体悬浮于孔板中,在黑暗条件下培养24小时后进行成像。
通过CRISPR/Cas9技术获得含DES1截短蛋白的转基因小麦,发现植株发育正常(图8),表明幼苗坏死是mDES1功能获得性突变导致,而非DES1功能缺失导致。
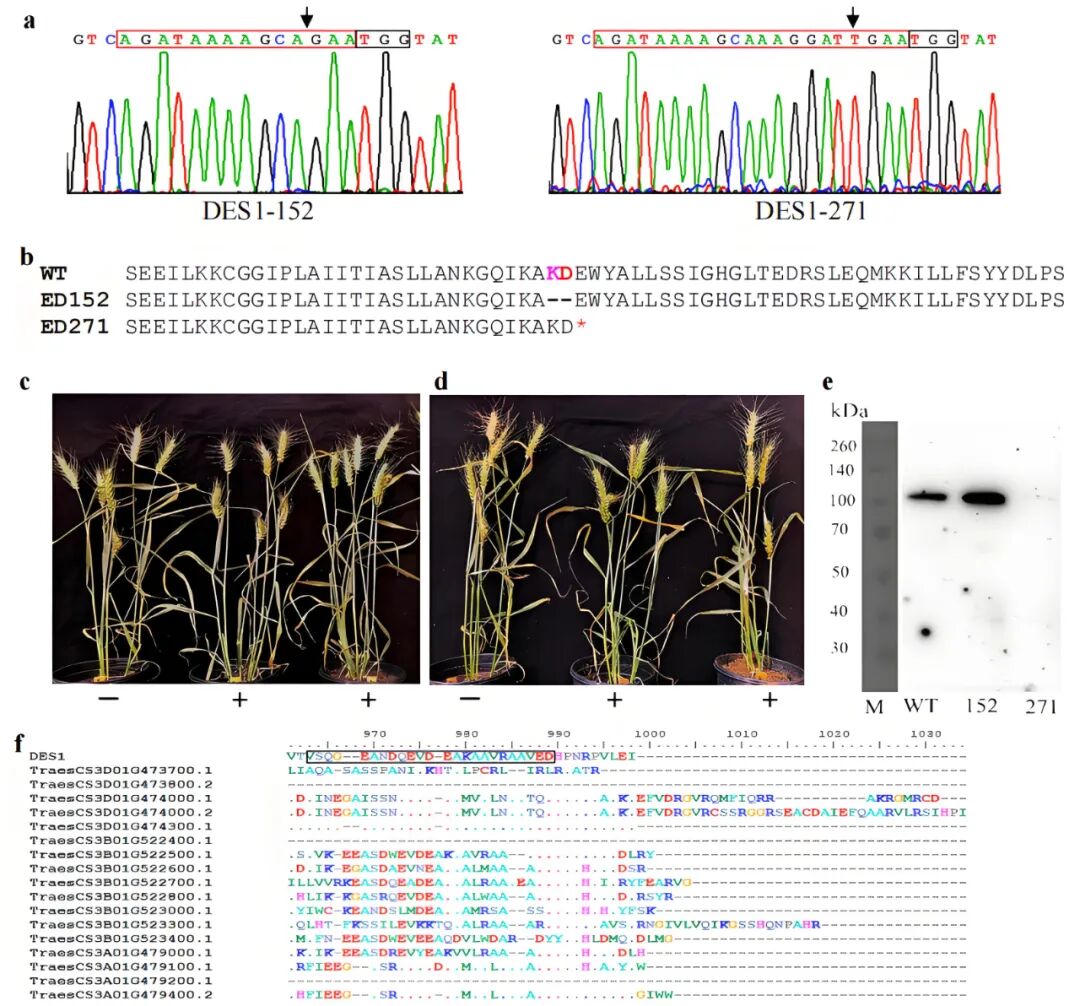
图8 DES1基因编辑后对植物生长发育的影响(Jia et al., 2021)。(a)基因编辑的靶序列;(b)基因编辑植株DES1-ED152和DES1-ED271中,DES1基因编辑后的推导蛋白序列;(c、d)DES1-ED152、DES1-ED271转基因T1代植株;“−”表示未编辑小麦,“+”表示DES1基因已被编辑;编辑后植株与未编辑植株在可见表型上无显著差异;(e)基因编辑植株中DES1蛋白的鉴定结果。
2023年6月,华中农业大学李国田课题组在Nature杂志上发表了一篇题为“Genome editing of a rice CDP-DAG synthase confers multipathogen resistance”的研究论文,作者精准设计水稻RBL1基因的12bp框内缺失突变,可定向调控该基因编码的CDP-二酰甘油合酶功能,在显著提升水稻对稻瘟病菌、白叶枯病菌、稻曲病菌等多种病原菌的广谱抗病性基础上,有效规避自然诱变产生的29bp大片段缺失所引发的配子体发育缺陷、结实率骤降等负面表型,实现抗病性与产量性状的协同优化。这篇文章的具体内容小远在这里就不详细讲解啦,强烈建议大家下载原文阅读学习噢。
5、光照敏感致死基因(OsFd1)
2024年1月,云南农业大学王莫课题组在Plant Biotechnology Journal杂志上发表了一篇题为“CRISPR/Cas9-mediated OsFd1 editing enhances rice broad-spectrum resistance without growth and yield penalty”的研究论文,揭示了主要光合型铁氧还蛋白OsFd1抑制水稻叶绿体内活性氧积累,进而负调控水稻抗病性的分子机制。
作者利用CRISPR/Cas9技术对水稻ZH11的OsFd1基因进行编辑,成功获得Osfd1-1和Osfd1-2两个功能缺失等位突变体,其编码区分别存在5bp缺失与1bp插入(图9a)。在12h光照/黑暗循环条件下,这两个完全敲除突变体均表现出幼苗致死表型(图9b);对10日龄幼苗离体叶片进行H2DCFDA(活性氧荧光探针)染色发现,Osfd1-1叶绿体中出现明显荧光信号,而野生型无此现象,表明OsFd1缺失会导致叶绿体中ROS组成型积累(图9c);同时,这两个突变体的茉莉酸(JA)及茉莉酸-异亮氨酸结合物(JA-Ile)基础水平也显著高于ZH11(图9d)。然而,在持续黑暗条件下,Osfd1-1和Osfd1-2的黄化幼苗生长情况与ZH11相似(图9b)。表明Osfd1的致死性是依赖光照的。
为解决完全敲除突变体的致死问题,作者通过进一步筛选CRISPR/Cas9编辑后代,获得Osfd1-3和Osfd1-4两个纯合弱等位突变体,其编码区分别存在3bp和15bp的缺失(图9e)。表型观察显示,这两个突变体均表现出与野生型类似的生长状态,且农艺性状无明显缺陷(图9f);抗病性检测发现,与ZH11和Osfd1-3相比,Osfd1-4对稻瘟病菌和白叶枯病菌的抗性显著增强,且几丁质和flg22诱导的ROS爆发也明显增强(图9g-l)。酵母双杂交实验显示,OsFd1具有较强的自结合能力,而OsFd1的5个氨基酸缺失会显著降低这种自结合能力(图9m),推测该缺失可能影响OsFd1的二聚化及电子传递效率。H2DCFDA染色结果也显示,Osfd1-4叶绿体中存在适量ROS积累,而Osfd1-3无此现象,表明这种适量ROS积累可能是Osfd1-4增强抗病性的关键因素之一(图9n)。
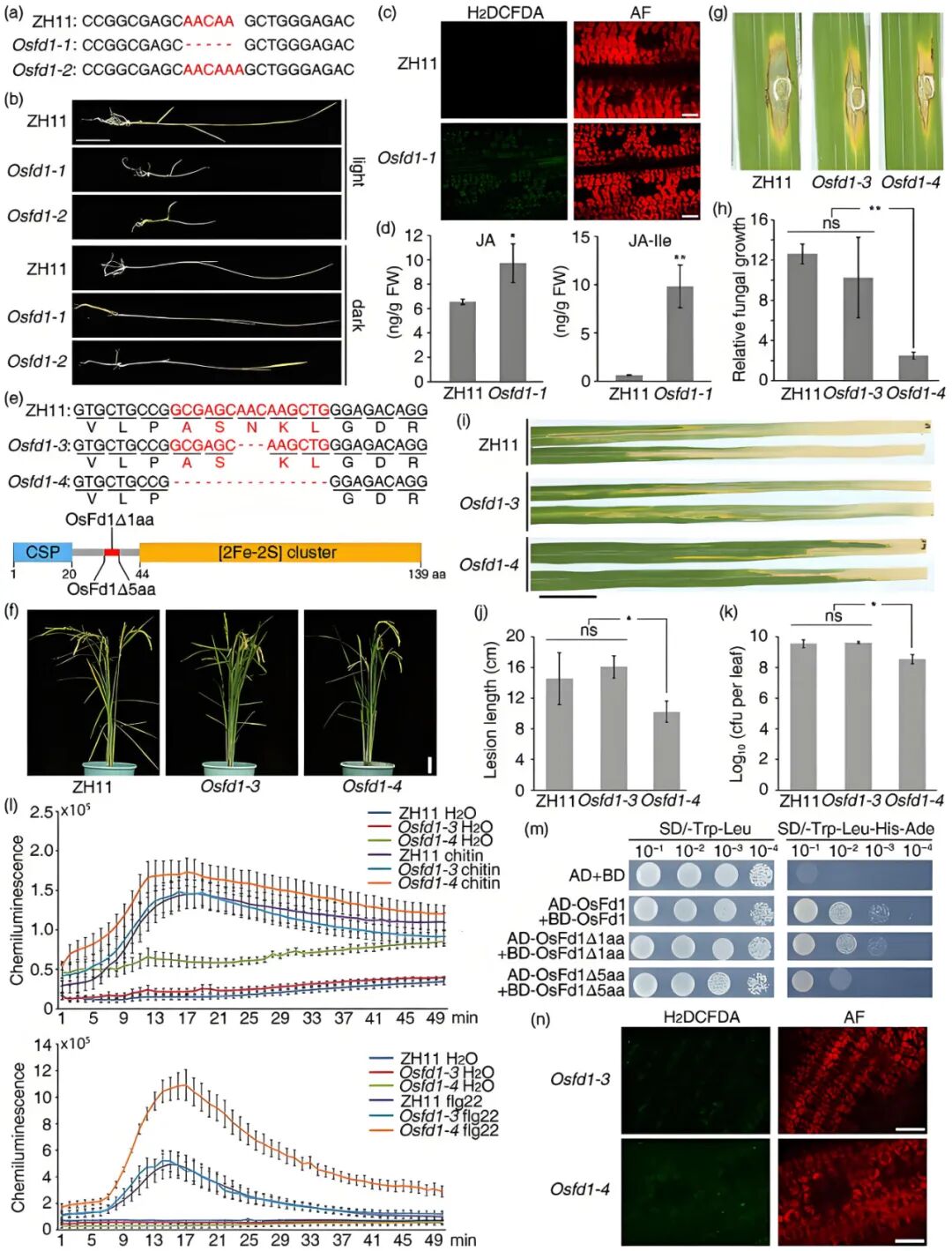
图9 OsFd1基因的特定编辑形式可增强水稻广谱抗性且不影响产量(Shi et al., 2024)。(a)Osfd1-1和Osfd1-2中OsFd1的突变位点;(b)Osfd1-1和Osfd1-2幼苗的致死性具有光照依赖性;(c)H2DCFDA染色结果;(d)WT、Osfd1-1中JA和JA-Ile的水平;(e)Osfd1-3和Osfd1-4中OsFd1的突变位点;(f)Osfd1-3和Osfd1-4突变体表现出与野生型相似的生长状态;(g、h)ZH11、Osfd1-3和Osfd1-4水稻经稻瘟病菌菌株Guy11的分生孢子打孔接种后的病叶表型(g)与稻瘟病菌的生长量(h);(i-l)ZH11、Osfd1-3和Osfd1-4经白叶枯病菌菌株Pxo86接种后的病叶表型、病斑长度(j)、白叶枯病菌的生长量(k)、几丁质和flg22诱导的ROS爆发(l);(m)酵母双杂交实验结果;(n)H2DCFDA染色结果。2025年6月,四川农业大学李仕贵课题组在The Plant Journal杂志上发表了一篇题为“OsPPR8, a pentatricopeptide repeat protein, regulates splicing of mitochondrial nad2 intron 3 to affect grain quality and high-temperature tolerance in rice”的研究论文,为了探究PPR基因在高温胁迫响应和耐受性中的作用,作者首先检测了OsPPR8在高温诱导下的表达情况,发现高温处理6小时后OsPPR8的表达显著上调(图10a),表明OsPPR8可能参与水稻对高温胁迫的响应。为了验证这一假设,作者比较了野生型和OsPPR8-KO突变体幼苗期的高温耐受性。结果显示,在高温处理下,OsPPR8-KO突变体几乎全部死亡,温度恢复后,野生型存活率为62.5%。高温下,突变体叶片积累更多ROS(NBT染色深蓝斑点更多)、细胞死亡更严重(台盼蓝染色深蓝区域更广),且MDA含量和电解质渗漏率显著高于野生型,表明细胞膜受损严重。正常温度与高温条件下,OsPPR8-KO突变体的ATP含量低于野生型,外源施加ATP可恢复其ATP水平及高温存活率,表明ATP缺乏可能是导致其高温耐受性降低的原因。同时作者发现,高温胁迫下,突变体的结实率下降幅度(-35.41%~-43.32%)远大于野生型(-17.63%),灌浆期高温处理导致突变体所有籽粒均出现垩白,垩白度接近90%,而野生型为50.6%(图10)。
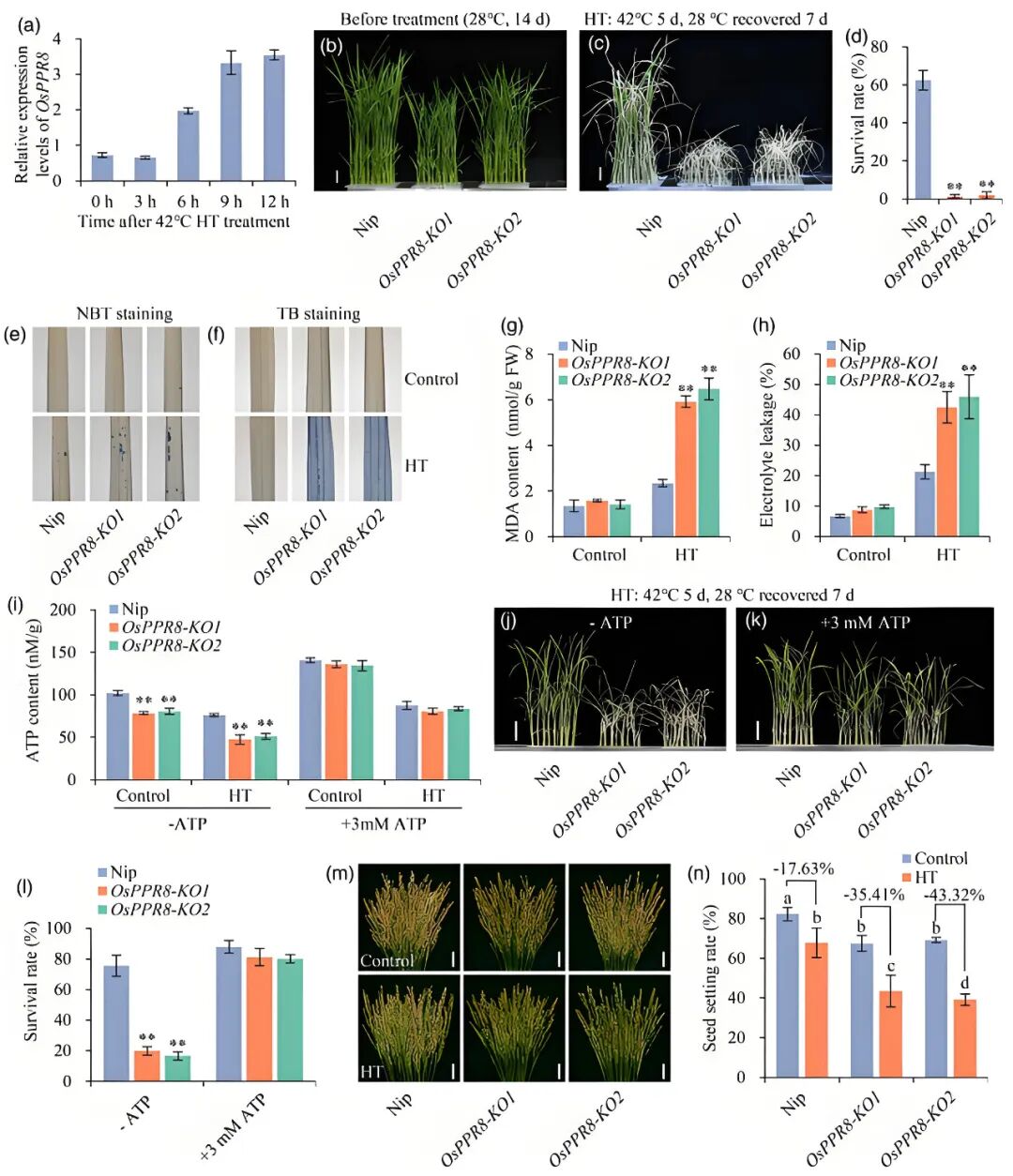
图10 OsPPR8在高温耐受性中起着重要作用(Yuan et al., 2025)。(a)高温诱导下OsPPR8的表达水平;(b-h)高温处理前后,对Nip和OsPPR8-KO幼苗的表型(b、c)、幼苗的存活率(d)、NBT染色(e)、TB染色(f)、MDA含量(g)、电解质渗漏(h)进行分析;(i-l)对照和高温处理下,有无外源ATP处理,Nip和OsPPR8-KO幼苗的ATP含量(i)、幼苗表型(j、k)、幼苗的存活率(l);(m、n)高温处理前后Nip和OsPPR8-KO穗的表型(m)、结实率(n)。
小远叨叨
在本期推文中,小远主要给大家介绍了一些植物致死突变的类型及其关键调控基因,由于篇幅所限,还有很多有关植物突变致死的研究成果并未在本次推文中为大家呈现,感兴趣的小伙伴可以查阅相关资料进一步深度学习哦!
小远还想给大家总结的是,我们在面对基因编辑中出现的致死问题时,应该怎么解决:
一、可以通过精准设计突变类型,实现对特定基因功能的定向调控,有效规避移码突变引发的致死表型。如案例1中,水稻OsROS1基因的移码突变会导致雌雄配子体发育缺陷、植株完全不育,而框内突变仅使结实率暂时降低,T1代可恢复育性且能稳定遗传突变位点;案例5中,水稻OsFd1基因完全敲除(移码突变)会导致光照依赖型幼苗致死,而筛选获得的3bp或15bp框内缺失弱等位突变体,既能正常生长且农艺性状无缺陷,还能增强广谱抗病性。此外,通过精准设计RBL1基因的框内缺失突变,可定向调控其功能,在赋予水稻广谱抗病性的同时,规避移码突变或大片段缺失引发的产量下降等负面表型。
二、可以考虑通过RNAi技术针对性降低目的基因的表达量,为顺利解析该基因的生物学功能提供解决方案。如案例2中,拟南芥SEC与SPY双突变会导致胚胎致死,无法直接研究二者的协同作用,构建DEX诱导型SEC RNAi载体后,在spy-3突变体背景下降低SEC表达,成功观察到二者在花柱发育、果实生长及幼苗生长中的协同调控作用。
三、若基因纯合突变致死,可保留杂合突变体,通过与野生型回交的方式延续突变位点,保障后续研究开展。如案例3中,水稻als1白化突变体为隐性纯合致死,突变体种子需通过杂合植株(ALS1/als1)保存,将杂合植株与野生型杂交后,可获得含突变位点的后代群体用于研究。
四、采用“诱导型启动子或组织特异性启动子驱动基因编辑工具”的策略,可在特定处理下、特定发育阶段或特定组织中激活基因编辑,避免全身性、持续性突变引发的植株致死风险。至于诱导型启动子或组织特异性启动子驱动基因编辑工具的策略大家可以参考“An inducible genome editing system for plants”这篇论文,该论文首次在模式植物拟南芥中建立了基于雌激素诱导、具有组织特异性的诱导基因编辑体系,其设计思路与技术方案可为规避基因突变导致的植株死亡问题提供重要参考。
小远未总结到的策略,欢迎大家进行补充噢~
References:
Hartweck L M, Genger R K, Grey W M, et al. SECRET AGENT and SPINDLY have overlapping roles in the development of Arabidopsis thaliana L. Heyn[J]. Journal of experimental botany, 2006, 57(4): 865-875.
Hartweck L M, Scott C L, Olszewski N E. Two O-linked N-acetylglucosamine transferase genes of Arabidopsis thaliana L. Heynh. have overlapping functions necessary for gamete and seed development[J]. Genetics, 2002, 161(3): 1279-1291.
Jia H, Xue S, Lei L, et al. A semi-dominant NLR allele causes whole-seedling necrosis in wheat[J]. Plant physiology, 2021, 186(1): 483-496.
Jiang Y, Curran-French S, Koh S W H, et al. O-glycosylation of the transcription factor SPATULA promotes style development in Arabidopsis[J]. Nature Plants, 2024, 10(2): 283-299.
Sha G, Sun P, Kong X, et al. Genome editing of a rice CDP-DAG synthase confers multipathogen resistance[J]. Nature, 2023, 618(7967): 1017-1023.
Shi H, Chen J, Lu M, et al. CRISPR/Cas9‐mediated OsFd1 editing enhances rice broad‐spectrum resistance without growth and yield penalty[J]. Plant Biotechnology Journal, 2024, 23(2): 489.
Wang X, Ye L, Lyu M, et al. An inducible genome editing system for plants. Nature Plants, 2020, 6(7):766-772.
Xu Y, Wang F, Chen Z, et al. CRISPR/Cas9‐targeted mutagenesis of the OsROS1 gene induces pollen and embryo sac defects in rice[J]. Plant Biotechnology Journal, 2020, 18(10): 1999.
Xu Y, Wu Z, Shen W, et al. Disruption of the rice ALS1 localized in chloroplast causes seedling-lethal albino phenotype[J]. Plant Science, 2024, 338: 111925.
Yuan H, Zeng J, Xu Z, et al. OsPPR8, a pentatricopeptide repeat protein, regulates splicing of mitochondrial nad2 intron 3 to affect grain quality and high‐temperature tolerance in rice[J]. The Plant Journal, 2025, 122(5): e70246.




















 1064
1064

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








