本文内容速览:
固着生长的特点促使植物形成了更为复杂的温度感知体系,以应对多变的环境。解析这些温度感应机制将加深我们对植物环境适应性的理解,并为作物改良提供理论依据。在先前的推文“植物中的温度感受器-知热篇”中,小远给大家介绍了植物是通过膜相关蛋白的释放、光感受器的热逆转、相分离、改变RNA二级结构、蛋白泛素化降解等机制来感知高温的,那么在低温条件下,植物又是通过什么分子机制感知低温信号的?带着这个问题和小远一起去文中寻找答案吧~
01
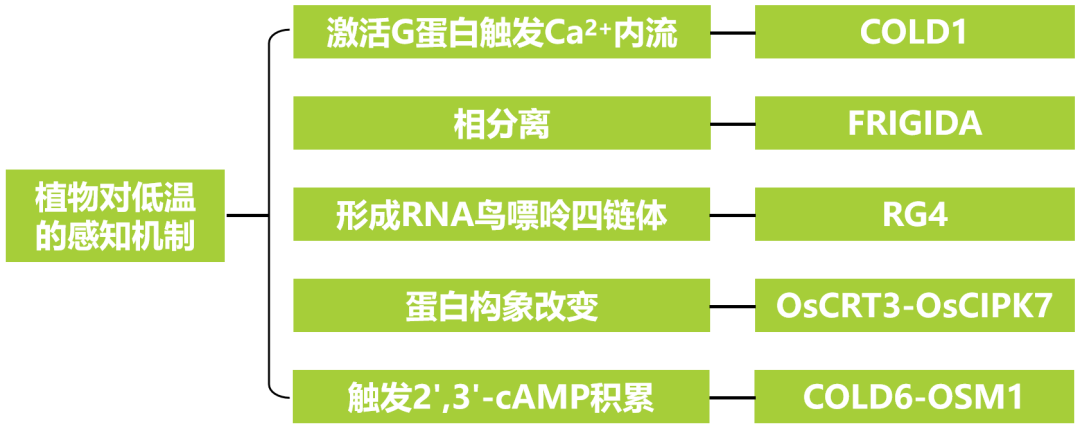
激活G蛋白触发Ca2+内流
2015年3月,中国科学院植物研究所种康院士课题组在Cell杂志上发表了一篇题为“COLD1 Confers Chilling Tolerance in Rice”的研究论文。在该论文中,作者通过正向遗传学手段,从水稻中克隆到低温感受器COLD1。COLD1蛋白通过与G蛋白α亚基RGA相互作用,诱导低温环境下胞质钙离子流,从而感知低温信号。
在该研究中,作者首先通过构建耐寒粳稻品种日本晴和不耐寒籼稻品种93-11的重组自交系群体,定位到一个稳定影响幼苗耐寒性的QTL位点,并最终克隆出功能基因COLD1。遗传学证据显示:包含粳稻COLD1基因的籼稻近等基因系以及超表达该基因的粳稻材料都表现出显著增强的耐寒性,而功能缺失突变体cold1-1和反义转基因株系却对冷非常敏感。这些结果表明,COLD1调控水稻的耐寒性(图1)。
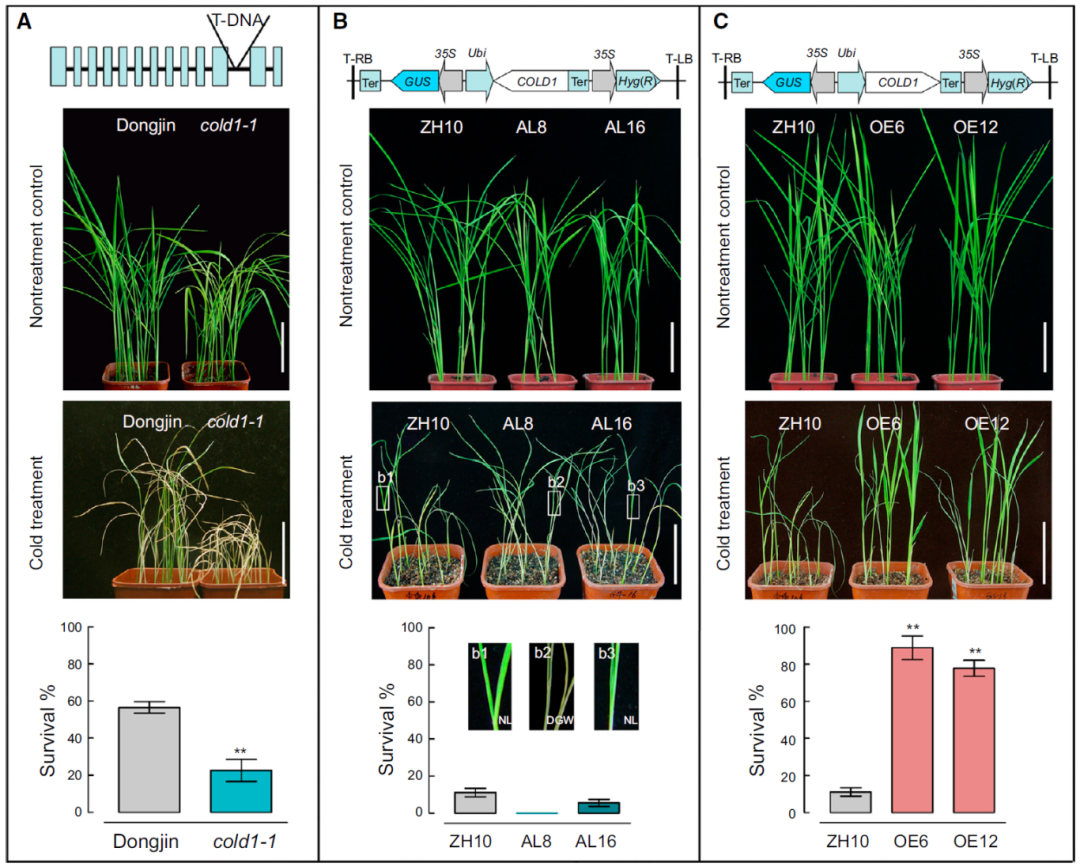
图1 COLD1对水稻耐寒性至关重要(Ma et al., 2015)。(A)cold1-1突变体表现出对低温的敏感性,在4℃下处理96h后,于30℃下恢复7d,测定其存活率;(B)反义转基因水稻株系(AL8和AL16)表现出对低温的敏感性,在2℃-3℃下处理96h后,于30℃下恢复4d,测定其存活率;(C)过表达转基因株系(OE6和OE12)表现出耐寒性,在2℃-3℃下处理96h后,于30℃下恢复4d,测定其存活率。
进一步的研究表明,COLD1编码一个G蛋白信号调节因子,定位于细胞质膜和内质网。低温条件下,COLD1与G蛋白α亚基RGA互作(图2),激活Ca2+通道,触发下游耐寒防御反应,而后加速G蛋白GTP酶活性以平衡G蛋白动态活性。另外,作者通过分析不同水稻品种和野生稻中COLD1的基因序列,发现了7个SNP位点,其中,在人工驯化选择栽培稻的耐寒过程中获得了来自于中国野生稻的SNP2位点,该位点决定了粳稻和籼稻对低温感知的灵敏性差别,这进一步证实了COLD1在植物适应性中的重要性(图3)。
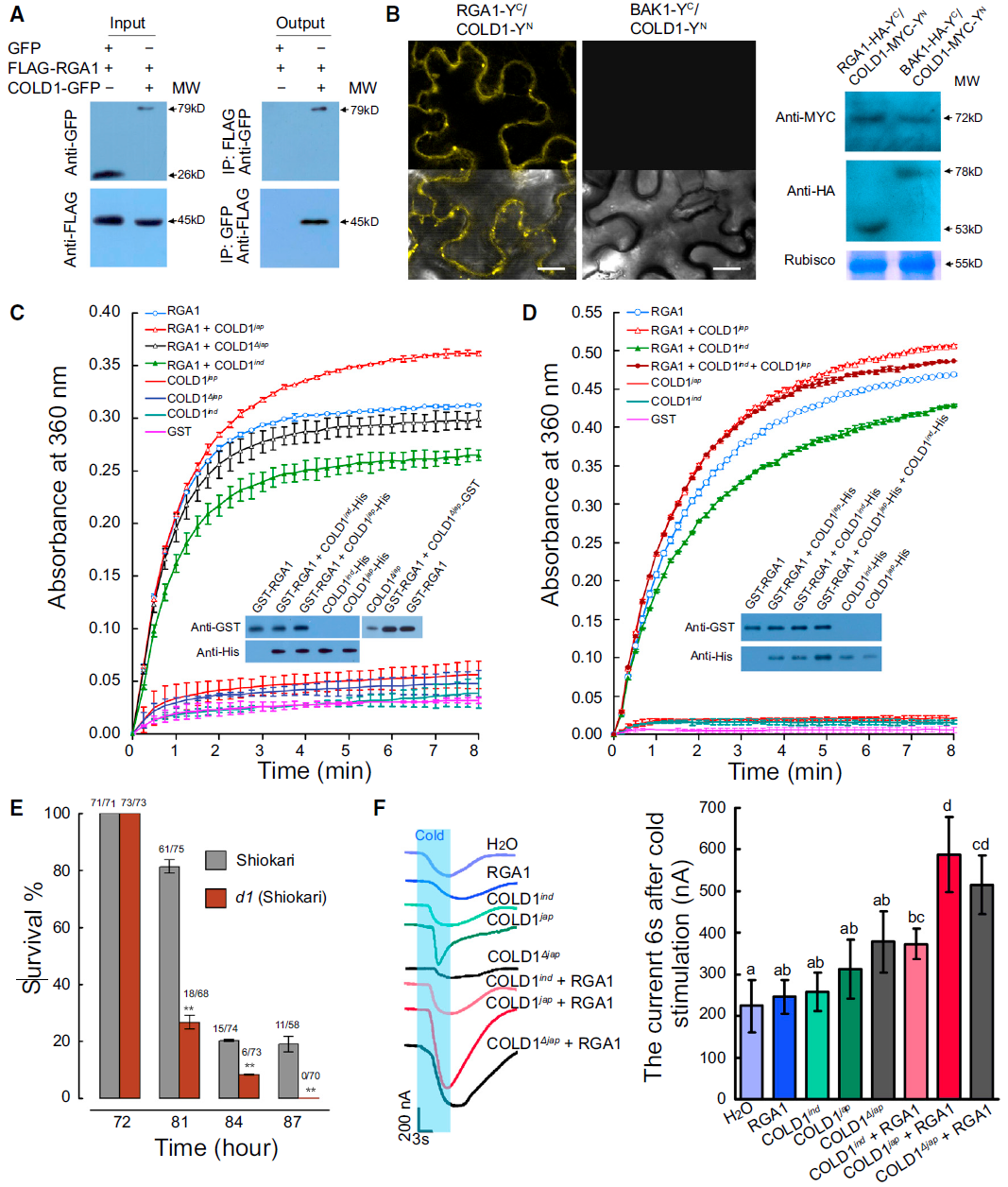
图2 COLD1与RGA1相互作用(Ma et al., 2015)。(A)Co-IP结果证明COLD1与RGA1存在互作关系;(B)BiFC检测结果表明COLD1与RGA1能够发生互作;(C)RGA1的内源性GTPase活性可以被COLD1jap增强;(D)体外实验表明,加入COLD1ind可抑制COLD1jap对RGA1的GTPase活性的促进作用;(E)耐寒性的时间进程表明,d1突变体对低温处理敏感;(F)对表达COLD1与RGA1或仅表达RGA1的非洲爪蟾卵母细胞进行电生理分析。
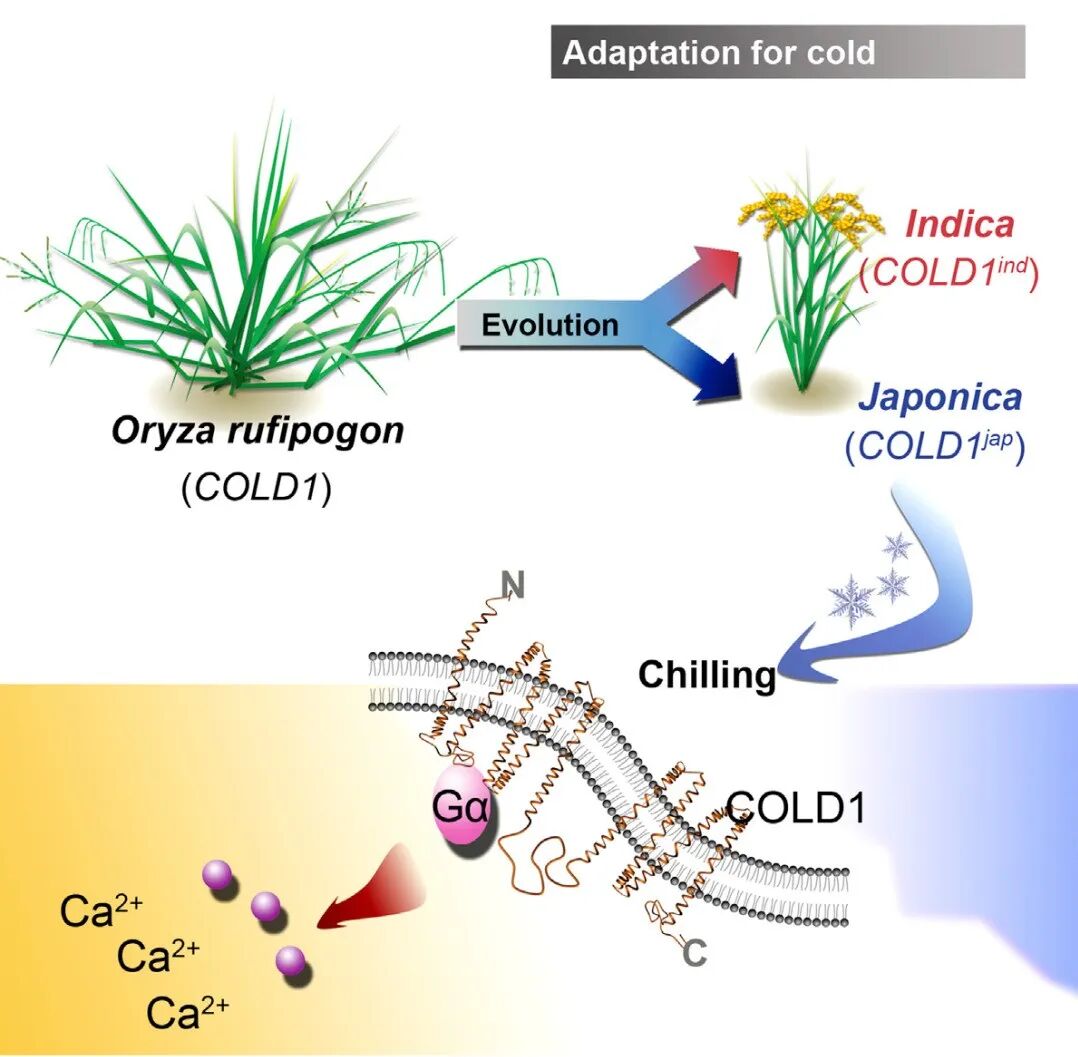
图3 水稻人工驯化选择COLD1基因感知低温的机制模式图(Ma et al., 2015)。
02
相分离
2021年11月,英国约翰英纳斯中心Caroline Dean课题组在Nature杂志上发表了一篇题为“Cold-induced Arabidopsis FRIGIDA nuclear condensates for FLC repression”的研究论文,该研究揭示了植物如何感知温度变化,并如何在秋季温度多变的情况下开始春化的分子机制,即在低温条件下,FRIGIDA(FRI)容易在植物细胞核内形成凝聚体,凝聚体的形成阻止了FRI对FLOWERING LOCUS C(FLC)的激活,FLC表达下调。FRI凝聚体的形成使植物能够根据环境温度变化调节FLC的表达水平,帮助植物感知季节进程。
在该论文中,作者首先创制了携带FRI-GFP融合蛋白的拟南芥转基因株系,用于观察FRI在体内的定位。通过共聚焦显微镜观察发现,在低温条件下FRI形成点状,表现出缓慢的扩散动力学,表明形成了凝聚体。进一步研究发现,FRI的C端无序结构域(DD)和两个卷曲螺旋结构域(CC)对于FRI形成凝聚体是必需的,并且FRI在低温下更稳定。利用荧光标记的RNA杂交探针来定位新生的FLC转录本,发现FRI凝聚体和新生FLC转录本之间没有共定位,说明凝聚体的形成阻止了FRI对FLC的转录激活(图4)。
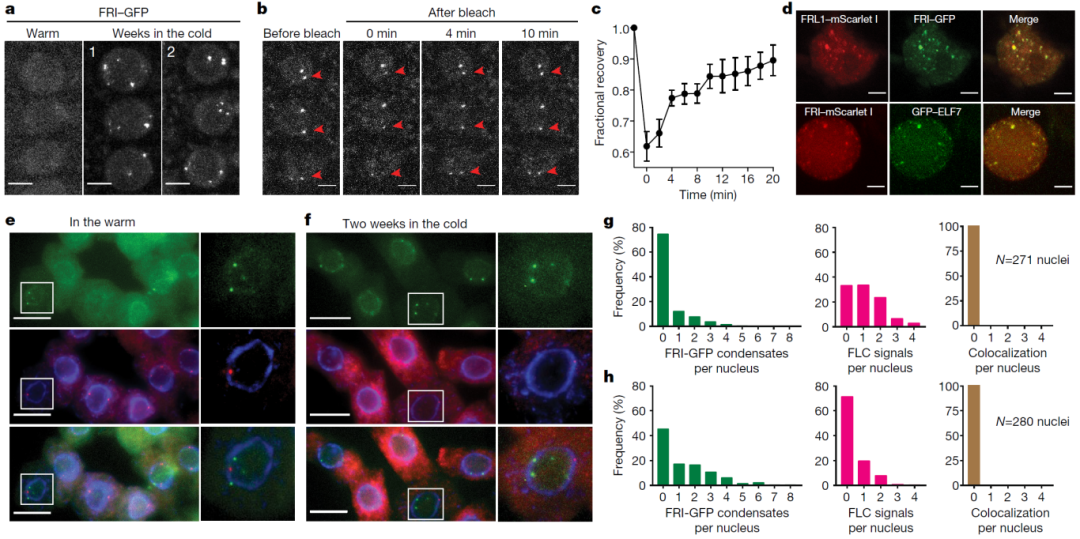
图4 低温促进的FRI凝聚体与FLC转录关闭相关(Zhu et al., 2021)。(a)在不同条件下根细胞中FRI-GFP凝聚体的共聚焦显微镜图像;(b、c)FRI-GFP凝聚体的FRAP(荧光漂白后恢复技术)图像(b)及定量分析(c),红色箭头指示被漂白的凝聚体;(d)烟草叶片细胞核中共表达蛋白与FRI亚核共定位的共聚焦分析;(e、f)在高温(e)和低温(f)条件下,表达FRI-GFP(绿色)的细胞核与FLC内含子smFISH探针(红色)顺序杂交的代表性图像;(g、h)在高温(g)和低温(h)条件下根细胞核中FRI-GFP凝聚体(左图)、未剪接FLC转录本信号(中图)及其共定位频率(右图)的分布统计。
作者进一步探究了COOLAIR在FRI凝聚体形成中的作用。受低温诱导的COOLAIR是FLC基因座的反义长链非编码RNA,它和特定的共转录调控因子也促进FRI凝聚体的积累,从而将FRI从FLC启动子上移除(图5)。综上所述,低温条件下FRI通过相分离被隔离,并由此导致FLC表达受到抑制,从而使植物能够感知季节变化。
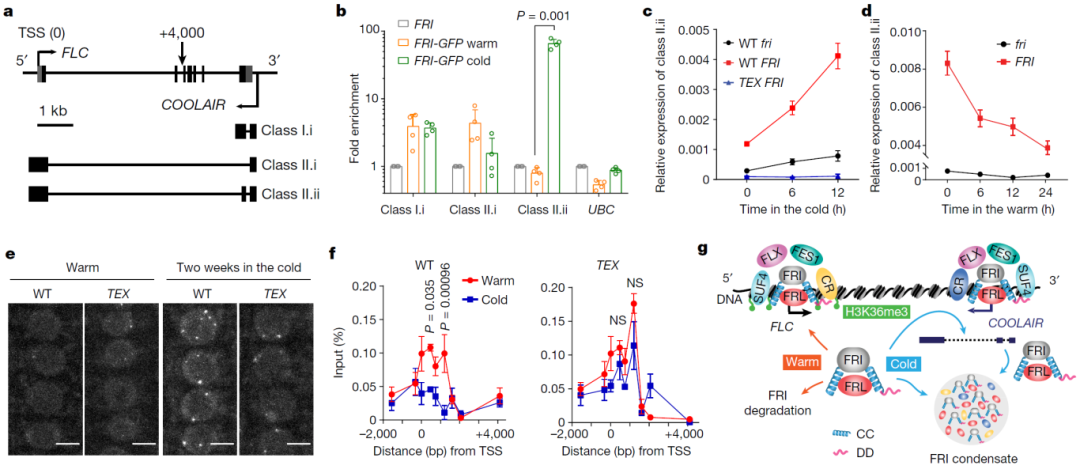
图5 COOLAIR促进低温诱导FRI-GFP凝聚体的形成及FRI从FLC启动子的隔离(Zhu et al., 2021)。(a)FLC基因位点中FLC与COOLAIR转录本的结构示意图;(a)FLC和COOLAIR转录本在FLC基因座的示意图;(b)以UBC为对照,通过RNA-IP分析FRI-GFP对剪接的COOLAIR的富集;(c、d)通过RT-qPCR检测指定植株内COOLAIR II.ii类转录本的相对表达水平;(e)表达FRI-GFP的野生型和TEX根尖细胞核的共聚焦图像;(f)通过染色质免疫沉淀(ChIP)检测野生型和TEX植物中FRI-GFP在FLC启动子区域的结合情况;(g)温度调控的FRI核凝聚在FLC转录调控中的工作模型。CC,卷曲螺旋结构域;CR,共转录调控因子;DD,无序结构域。
03
形成RNA鸟嘌呤四链体
生物大分子(如RNA、蛋白质等)常通过温度依赖性的结构变化来承担“细胞温度计”的功能。然而,由于缺乏活体测定植物RNA结构的方法,RNA是否能够真正作为温度感受器一直缺乏系统性的验证。2022年10月,英国约翰英纳斯中心丁一倞课题组和东北师范大学张铧坤课题组合作在Nature Communications杂志上发表了一篇题为“RNA G-quadruplex structure contributes to cold adaptation in plants”的研究论文,该研究揭示了RNA鸟嘌呤四链体(RNA G-quadruplex, RG4)结构在低温感知和驱动植物的冷适应进化中的关键作用,且RG4结构是植物中发现的第一个RNA低温感受器。
在该论文中,作者为了寻找与温度感知有关的RNA结构域特征,对1000种植物转录组项目(1KP)的RNA序列进行了分析。结果显示,生长在低温地区的植物普遍富含鸟嘌呤(G)。鉴于G-rich序列可以折叠为RG4结构,因此作者假设,在寒冷气候下常见的植物中,富含G的转录组可能含有RG4基序,通过计算证实了RG4在生长于较冷气候的植物物种中富集程度更高(图6)。
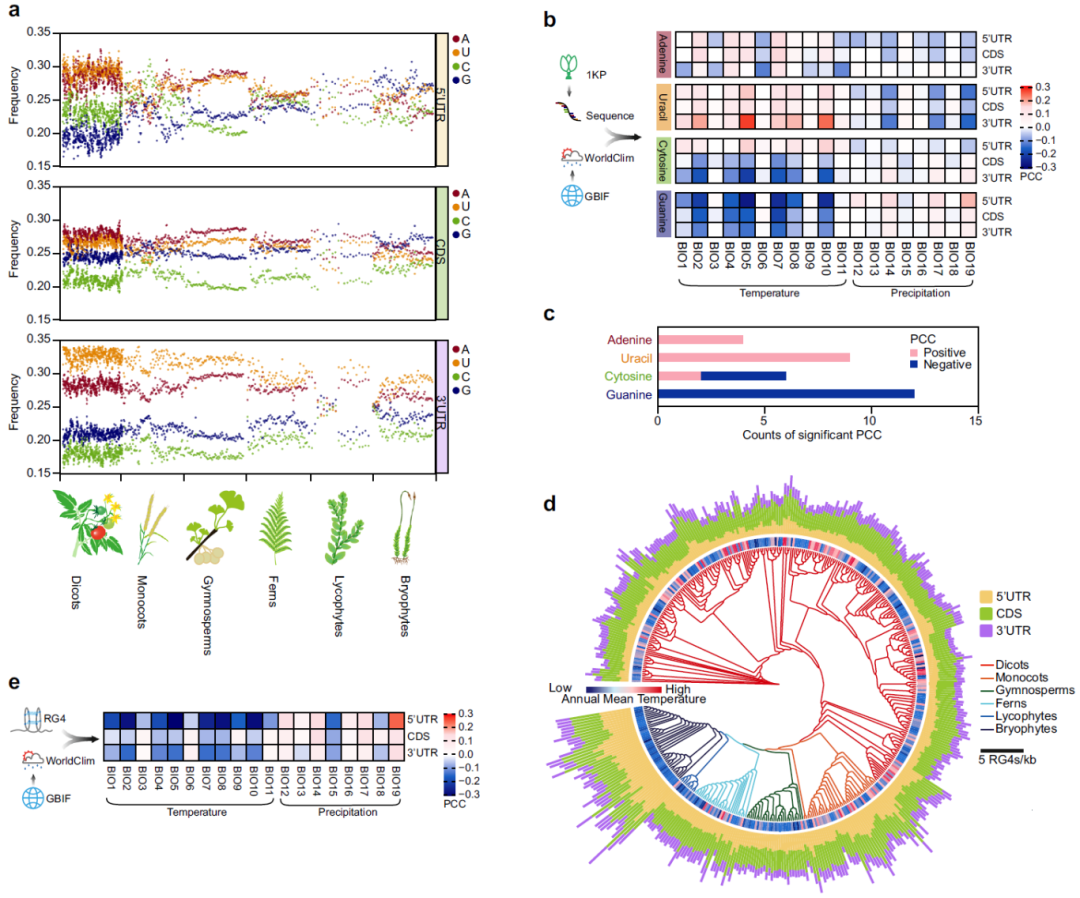
图6 转录组鸟嘌呤(G)频率与RNA G-四链体频率的比较揭示了植物适应气候的特征(Yang et al., 2022)。(a)散点图显示了来自1000种植物(1KP Initiative)的906种陆生植物转录组中每种核苷酸(A:腺嘌呤,U:尿嘧啶,C:胞嘧啶,G:鸟嘌呤)的频率,其中,双子 叶植物、单子叶植物、裸子植物、蕨类植物、石松类植物和苔藓植物的样本量分别为n=556、107、80、71、21和71;(b)热图显示了转录组核苷酸频率与植物生境生物气候变量之间的皮尔逊相关系数(PCC);(c)条形图展示了转录组核苷酸频率与温度生物气候变量之间显著相关性(PCC)的计数;(d)陆生植物主要分支中RNA G-四链体(RG4)的频率;(e)热图显示了植物转录组中RG4频率与植物生境相关生物气候变量之间的皮尔逊相关系数(PCC)。
接着,为了探究RG4折叠与冷响应之间的关系,作者利用BG4抗体对拟南芥细胞中的RG4进行了可视化,低温(4°C)处理显著增强了细胞质中RG4信号,且回温后可恢复至常温水平。进一步通过SHALiPE-seq对拟南芥体内RG4折叠进行定量检测,结果显示,低温处理显著诱导植物体内RG4结构的折叠,证明植物RG4具有感知低温的能力。通过分析拟南芥的mRNA降解组数据,发现包含有冷诱导RG4的mRNA降解速率明显降低,提示RG4可能抑制了mRNA的降解。为了验证RG4是否参与低温下mRNA的稳定,作者挑选了一个受低温显著诱导的RG4基因,将其命名为CORG1。通过测量mRNA的稳定性,发现RG4突变(mutRG4)会导致低温下mRNA加速降解,并且低温对mutRG4-CORG1转基因植株的生长抑制也明显弱于wtRG4-CORG1植株,表明RG4结构突变降低了植物对低温响应的敏感性,以上结果证实了RG4在维持mRNA稳定性和调控冷适应反应中的作用(图7)。
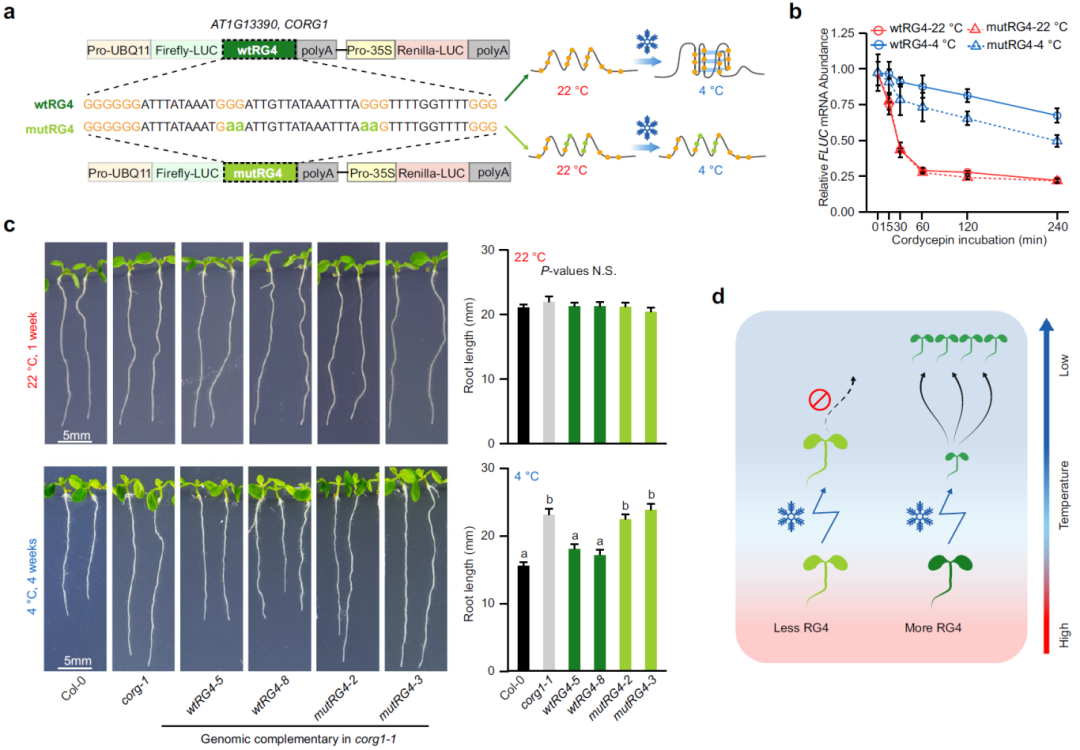
图7 RG4调控植物的冷响应生长(Yang et al., 2022)。(a)22°C和4°C条件下,CORG1 3′-UTR上野生型RG4(wtRG4)和突变型RG4(mutRG4)的折叠状态示意图,wtRG4的折叠能力得以维持,而mutRG4的折叠能力则因G到A的替换而减弱;(b)萤火虫荧光素酶(FLUC)转录本在22°C和4°C下的RNA衰减曲线,其中wtRG4或mutRG4的表达模式与(a)中所示相同;(c)不同基因型植株在22°C或4°C下的表型,wtRG4或mutRG4分别表示携带wtRG4或mutRG4的CORG1基因组DNA互补的corg1-1突变体;(d)模型显示RG4的选择性富集驱动植物适应寒冷气候,植物转录组中更多的RG4能够增强植物在冷感知方面的表型可塑性,从而促进植物适应寒冷气候。
04
蛋白构象改变
23年1月,中国科学院植物研究所种康院士课题组在The EMBO Journal杂志上发表了一篇题为“Cold-induced calreticulin OsCRT3 conformational changes promote OsCIPK7 binding and temperature sensing in rice”的研究论文,该研究发现水稻细胞中钙网蛋白OsCRT3可以与OsCIPK7形成复合体,通过蛋白构象的改变感知低温信号,使其转换成细胞内的生化网络信号。
在植物细胞中,钙网蛋白(CRT)的过表达会导致内质网释放更多的钙离子,这是由于CRT在内质网中钙离子结合能力增强所致(Persson et al., 2001),然而,尚不清楚其如何在低温信号转导中的协同作用。在该论文中,作者首先探究了CRT是否参与水稻的低温信号传导,与同源基因OsCRT1或OsCRT2相比,低温处理可以特异性的诱导OsCRT3的表达。为了从遗传学角度分析OsCRT3的功能,作者创制了OsCRT3的T-DNA插入功能缺失突变体材料oscrt3-1、OsCRT3的过表达材料和oscrt3-1的回补材料,通过观察植株表型确定了OsCRT3正调控水稻的低温耐受性(图8)。进一步的研究发现,OsCRT3定位于内质网,可以调控低温下细胞质的钙离子信号,在oscrt3-1中,常温条件下的胞质钙离子浓度低于野生型,冷处理后钙离子浓度的上升幅度也低于野生型。
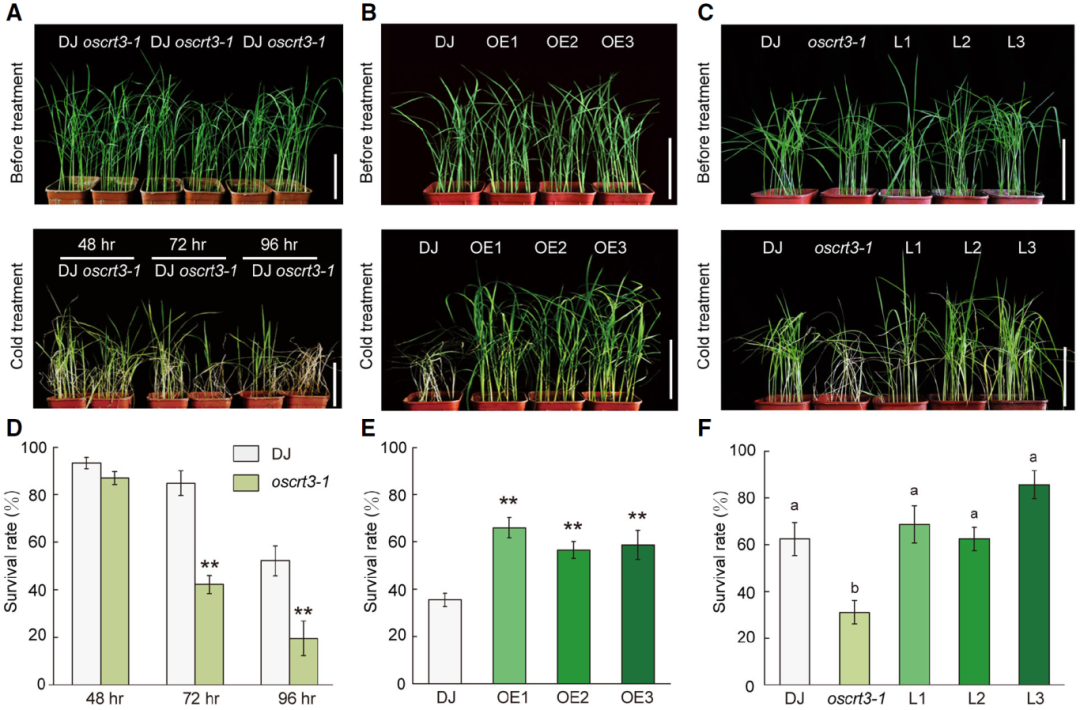
图8 OsCRT3提高了水稻幼苗的耐寒性(Guo et al., 2023)。(A)野生型(DJ)和oscrt3-1突变体幼苗在4°C下分别培养48h、72h和96h后的表型;(B)野生型和OsCRT3过表达株系(OE1、OE2和OE3)幼苗在4°C下培养100h后的表型;(C)野生型、oscrt3-1突变体和OsCRT3回补转基因株系(L1、L2和L3)幼苗在4°C下培养96h后的表型;(D-F)经低温处理的幼苗存活率。
接着,作者以OsCRT3为诱饵进行酵母双杂交筛库确定了15个潜在的互作蛋白,其中包括OsCIPK7,其在水稻低温胁迫响应中发挥作用(Zhang et al, 2019)。通过酵母双杂,Pull-down进一步证实了OsCRT3和OsCIPK7之间的互作。并且,作者还发现OsCIPK7与质膜上的OsCBL7和OsCBL8也存在相互作用。傅里叶变换红外光谱(FTIR)和表面等离子共振(SPR)实验显示,低温下OsCRT3的二级结构发生改变,促进其与OsCIPK7相互作用(图9)。OsCRT3与OsCIPK7的相互作用,进而增强了OsCIPK7在水稻低温胁迫下的激酶活性。此外,低温胁迫下OsCRT3调控细胞质钙离子浓度上升,细胞膜上的钙离子受体OsCBL7/8感知钙离子信号,特异地在细胞膜上与OsCIPK7互作,激活下游的信号。综上所述,该研究报道了一种新的温度感知机制,即通过蛋白的构象变化来感知温度信号,并将信号传递到下游以产生相应的反应(图10)。
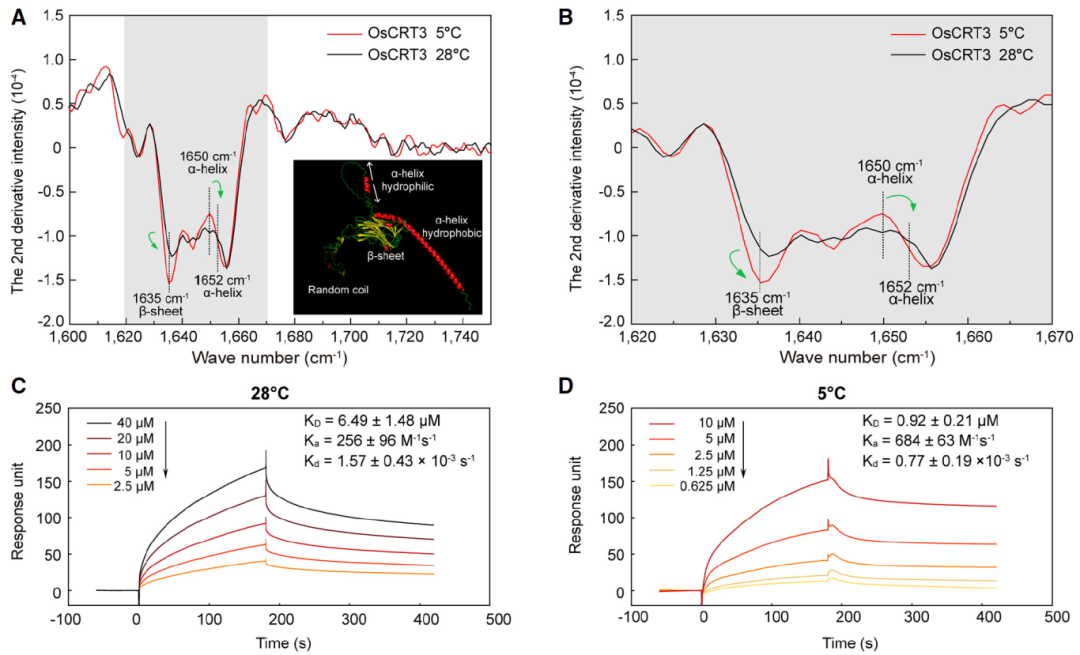
图9 OsCRT3在低温下表现出构象变化,并与OsCIPK7的结合亲和力增强(Guo et al., 2023)。(A)OsCRT3在5°C(红色)和28°C(黑色)下的二阶导数红外光谱图,右下角展示了Alphafold2预测的OsCRT3三维结构;(B)图A中灰色高亮区域的放大图;(C、D)SPR实验展示了OsCRT3与OsCIPK7-C在不同温度下的相互作用,将OsCRT3蛋白捕获在固定有抗MBP抗体的CM5芯片上,并测试其与不同浓度梯度的OsCIPK7-C的结合情况。
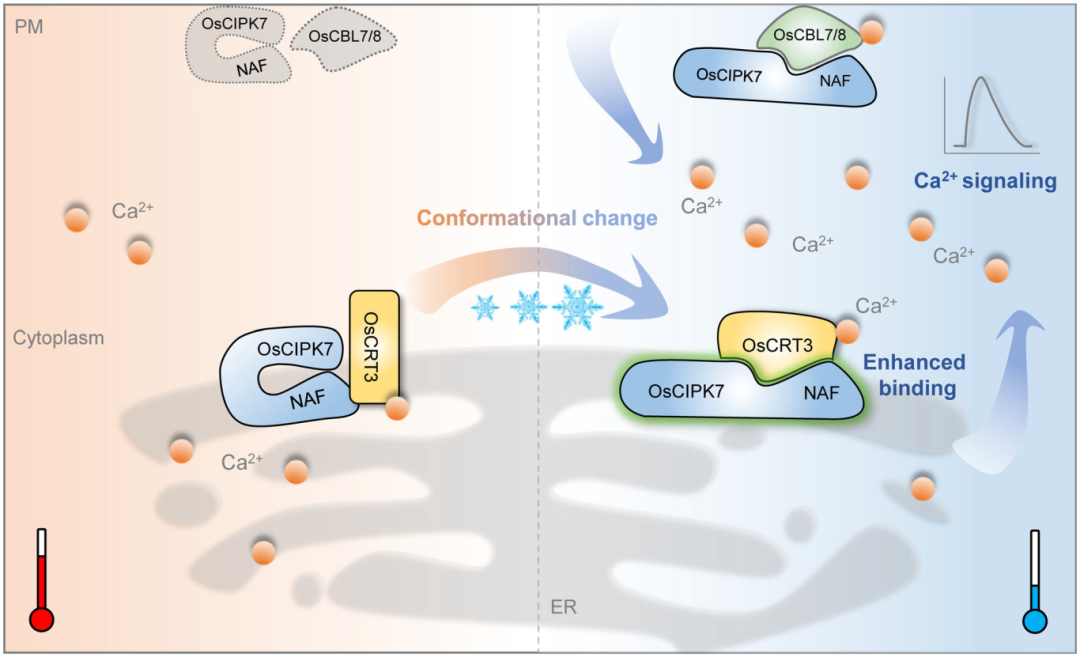
图10 水稻OsCRT3-OsCIPK7-OsCBL7/8感知低温信号的模式图(Guo et al., 2023)。
05
触发2',3'-cAMP积累
已有的研究表明,低温感受器大多触发钙离子作为第二信使的信号途径,而其它分子作为第二信使信号途径却罕有报导。2024年10月,中国科学院植物研究所种康院士课题组在Molecular Cell杂志上发表了一篇题为“COLD6-OSM1 module senses chilling for cold tolerance via 2',3'-cAMP signaling in rice”的研究论文,该研究发现COLD6在低温胁迫时与冷诱导的OSM1形成细胞膜定位的蛋白复合体,感知细胞外低温信号,触发新的第二信使2',3'-cAMP积累,进而激活低温防御反应。
在该论文中,作者利用粳稻和籼稻的重组自交系,鉴定到了一个负调控水稻耐寒性的QTL主效基因COLD6。敲除COLD6能增强水稻耐冷性,而过表达则降低耐冷性,其作用机制与已知的OsDREB耐冷通路相关。通过对不同水稻种质的COLD6基因进行测序分析发现,在COLD6的外显子中有两种类型的CTC密码子重复,含有7次CTC重复的COLD6jap等位基因(主要存在于粳稻中)比含有6次CTC重复的COLD6ind等位基因(主要存在于籼稻中)对耐冷性的抑制作用更弱,因此携带前者的品种耐冷性更强。群体遗传学和进化分析显示,携带粳稻COLD6等位基因的品种能够适应较低的环境温度,该基因是起源于印度和尼泊尔地区的低频等位基因,在温带粳稻中受到人工选择(图11)。
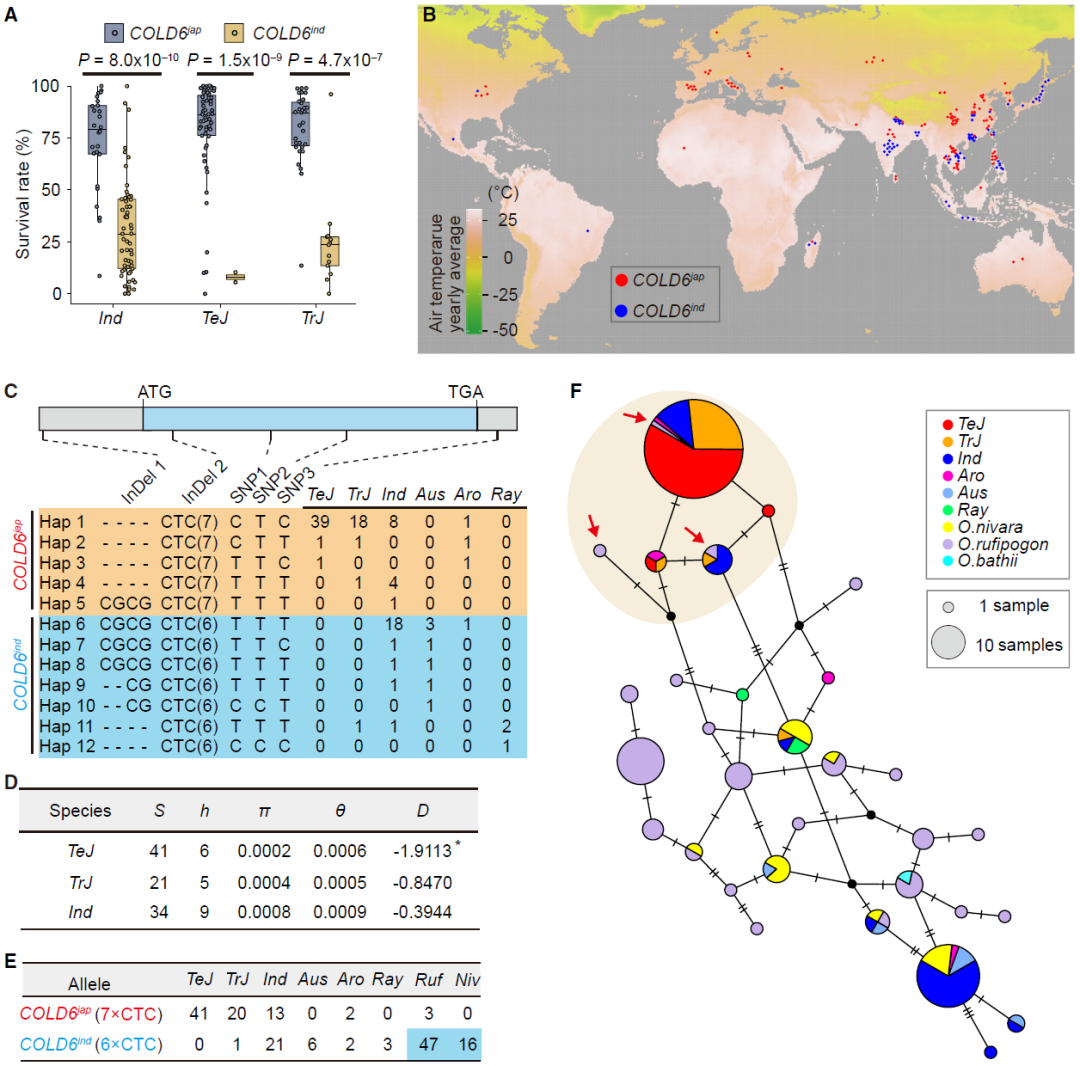
图11 COLD6有助于环境适应和选择(Luo et al., 2024)。(A)COLD6等位基因与水稻耐冷性相关,小提琴图展示了水稻品种的平均存活率,该数据基于至少三次生物学重复计算得出(每次重复n≥25);(B)187份种质的地理分布,携带COLD6jap或COLD6ind基因型的种质分别用红点或蓝点表示;(C)使用109个水稻地方品种基因组进行的COLD6单倍型分析。(D)COLD6的核苷酸多样性(π)和中性检验;(E)COLD6基因型在不同水稻亚群中的分布;(F)COLD6的单倍型网络图。
进一步研究发现,COLD6定位于质膜并与RGA1相互作用,COLD6ind比COLD6jap在质膜积累更多,且与RGA1互作更强,导致更强的冷敏感表型。低温诱导的膜蛋白OSM1正调控水稻的耐冷性,它会竞争性抑制COLD6-RGA1的互作,在冷胁迫时取代RGA1,与COLD6结合形成复合物感知低温,引发细胞内第二信使2',3'-cAMP水平升高,增强水稻的耐冷性(图12)。外源施加2',3'-cAMP类似物8-Br-2',3'-cAMP (Chodasiewicz et al., 2022),同样可以提高植株的耐冷性,进一步说明2',3'-cAMP可以作为信号分子在水稻耐冷性中发挥作用。
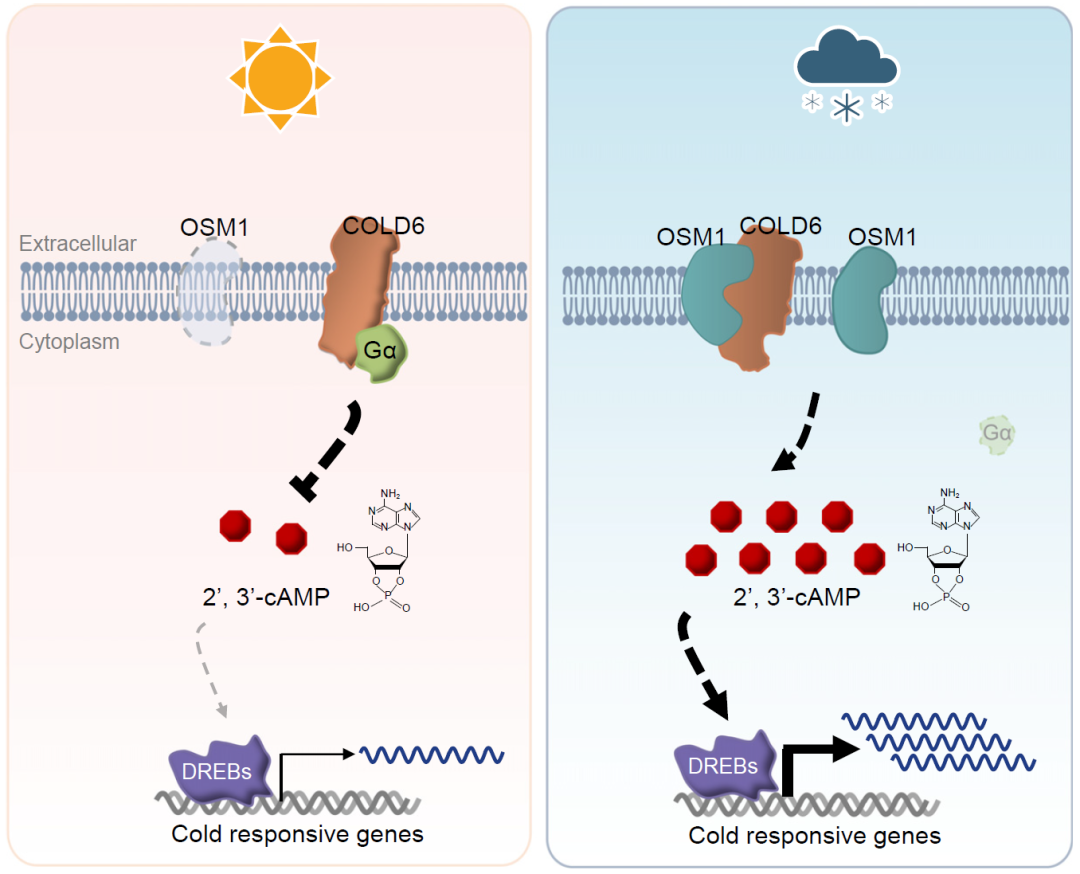
图12 COLD6在水稻中的作用模型(Luo et al., 2024)。
低温胁迫是影响植物生长、发育及作物产量的重要环境胁迫因素之一。植物通过感知低温信号并快速启动低温应答,可以降低低温胁迫对其造成的损伤。在本期的推文中小远主要是给大家介绍了科学家们发现的一些植物低温感受器,涉及的机制包括:激活G蛋白触发Ca2+内流、相分离、形成RNA鸟嘌呤四链体、蛋白构象改变以及触发2',3'-cAMP积累等,由于篇幅所限,还有很多有关植物低温感受器的研究成果并未在本次推文中为大家呈现,感兴趣的小伙伴可以查阅相关资料进一步深度学习哦!随着科研的不断深入,相信科学家们还会挖掘出更多的低温感受器,并且将这些成果有效的应用到分子育种中。
References:
Chodasiewicz M, Kerber O, Gorka M, et al. 2',3'-cAMP treatment mimics the stress molecular response in Arabidopsis thaliana[J]. Plant Physiol. 2022, 188(4): 1966-1978.
Guo X, Zhang D, Wang Z, et al. Cold-induced calreticulin OsCRT3 conformational changes promote OsCIPK7 binding and temperature sensing in rice[J]. EMBO J. 2023, 42(1): e110518.
Luo W, Xu Y, Cao J, et al. COLD6-OSM1 module senses chilling for cold tolerance via 2',3'-cAMP signaling in rice[J]. Mol Cell. 2024, 84(21): 4224-4238.e9.
Ma Y, Dai X, Xu Y, et al. COLD1 confers chilling tolerance in rice[J]. Cell. 2015, 160(6): 1209-21.
Persson S, Wyatt SE, Love J, et al. The Ca2+ status of the endoplasmic reticulum is altered by induction of calreticulin expression in transgenic plants[J]. Plant Physiol. 2001, 126(3): 1092-104.
Yang X, Yu H, Duncan S, et al. RNA G-quadruplex structure contributes to cold adaptation in plants[J]. Nat Commun. 2022, 13(1): 6224.
Zhang D, Guo X, Xu Y, et al. OsCIPK7 point-mutation leads to conformation and kinase-activity change for sensing cold response[J]. J Integr Plant Biol. 2019, 61(12): 1194-1200.
Zhu P, Lister C, Dean C. Cold-induced Arabidopsis FRIGIDA nuclear condensates for FLC repression[J]. Nature. 2021, 599(7886): 657-661.




















 408
408

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








