本文内容速览:
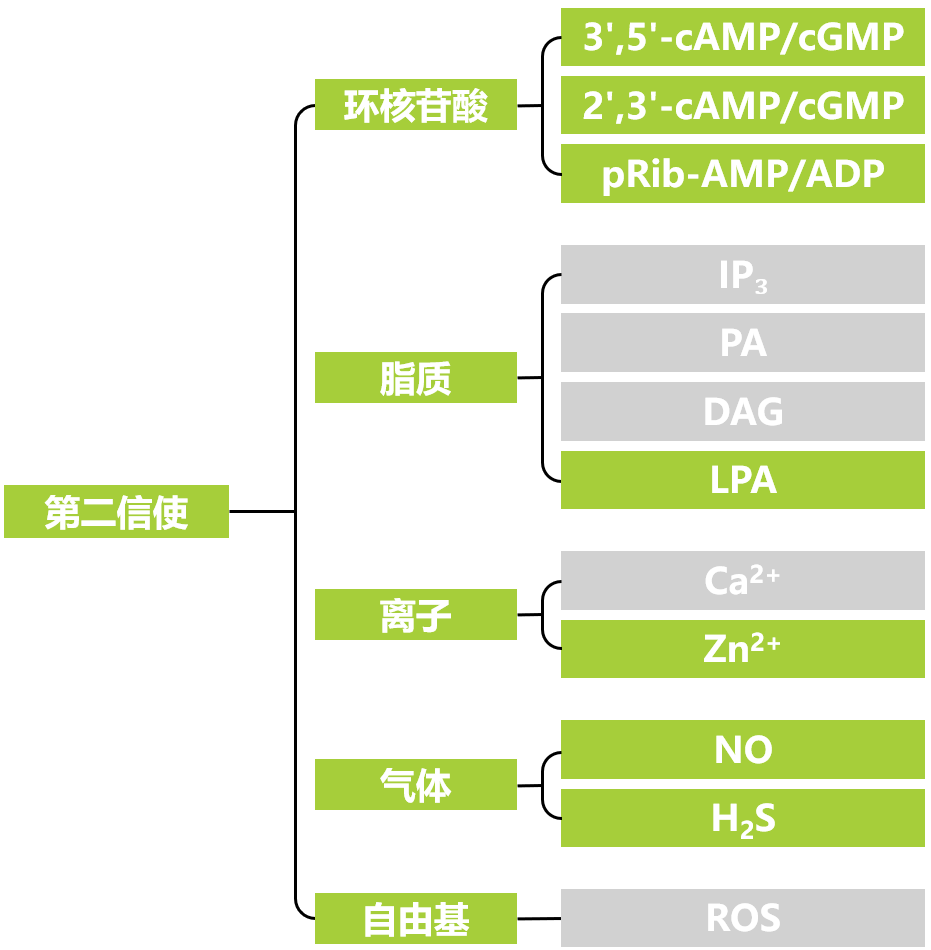
在植物信号转导网络中,第二信使(Second messengers)可以将细胞表面受体接收到的信号中转给效应蛋白,因此第二信使扮演着将外部刺激转化为细胞内反应的核心枢纽角色。根据不同类型,可将第二信使分为五类,分别是环核苷酸、脂质、离子、气体和自由基。目前,我们经常接触的第二信使有环核苷酸类的环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP);脂质类的肌醇三磷酸(IP3)、磷脂酸(PA)和甘油二酯(DAG);离子类的钙离子;自由基类的活性氧等。
植物第二信使的特性
虽然第二信使种类各异,但还是有一些共同的特性:其一,动态响应迅速且可逆,能在外界刺激后迅速生成并在信号终止后被快速清除;其二,具备信号放大与传递功能,不仅能将初级信号放大为显著的细胞内响应,还可激活特定的下游效应物(如激酶、转录因子或离子通道),并参与多条信号通路的交叉调控,实现信息的整合与协调;其三,表现出高度的时空特异性与广谱生理参与性,第二信使在细胞内的活性受刺激类型、强度和时程的精细调控,广泛介入植物的发育、免疫与逆境应答等核心生命过程。
在定义一个分子或离子是第二信使的时候还是需要谨慎的,因为认定一个分子或离子是第二信使需同时满足上述多个标准,而非仅依据其信息传递功能。例如,植物中的cAMP从被认作是第二信使到被广泛接受就经过了很长的时间。随着越来越多的研究的出现,cAMP被发现在诸多信号通路中扮演着第二信使的角色。2025年3月,奥地利科学技术研究所Jiří Friml课题组在Nature杂志上发表了一篇题为“TIR1-produced cAMP as a second messenger in transcriptional auxin signalling”的研究论文,该论文修订了生长素信号转导的经典模型(该模型核心通路为TIR1-Aux/IAA-ARF通路,相关内容可见往期推文“向光而行,向上生长——生长素”)。在这以往看似完美也被广泛接受的生长素信号转导过程中,作者发现TIR1蛋白的腺苷酸环化酶(AC)活性及其产物cAMP起着不可或缺的作用,并通过遗传学实验进一步证实了cAMP是植物细胞的第二信使(图1)。由此可见,有些我们目前认为是完美的结论,实际上还是需要更多的实验来进行验证和说明,这充分体现了科学的严谨性。
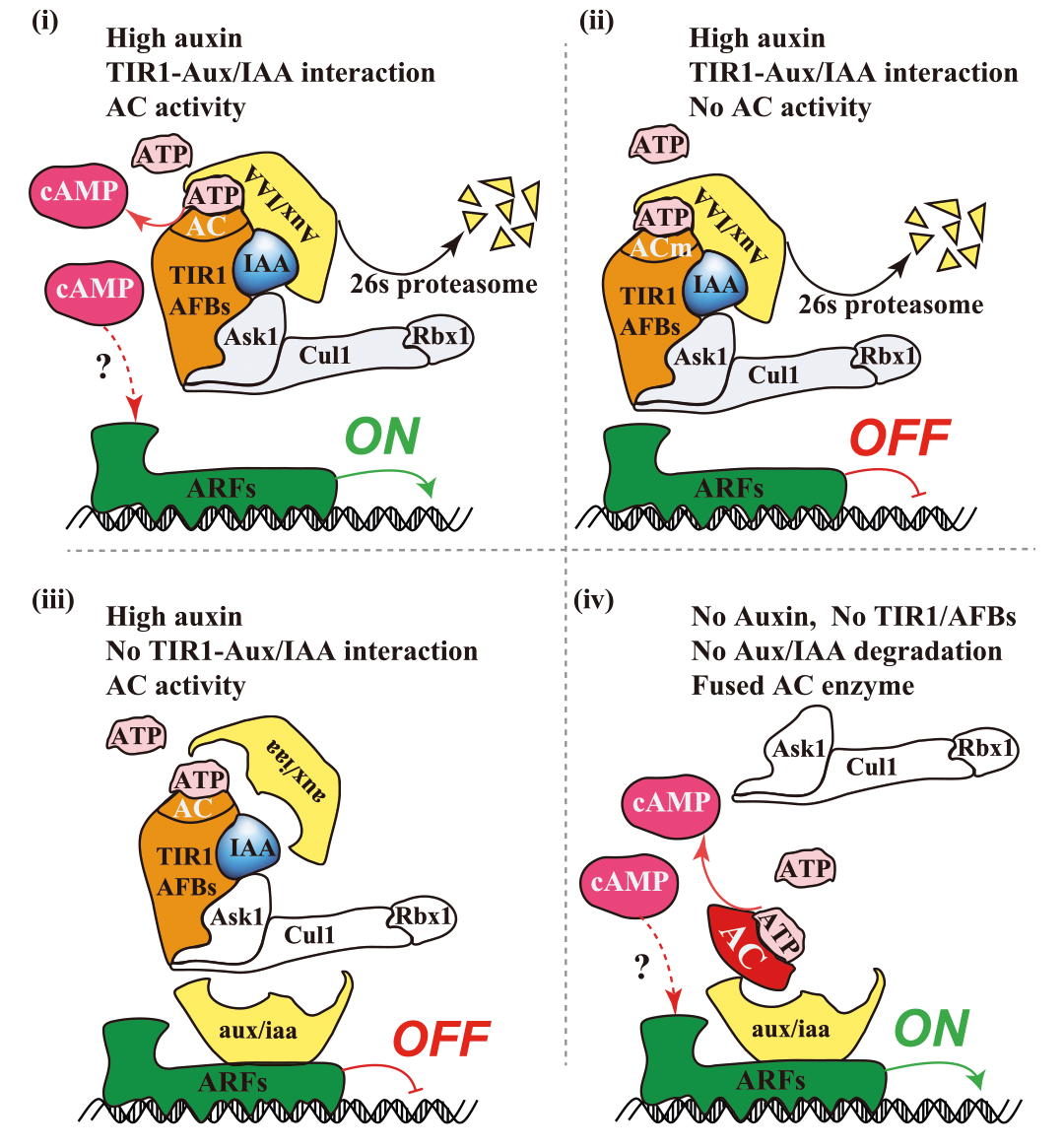
图1 修订后的生长素信号转导模型(Chen et al., 2025)。
在伯远生物写的往期推文“第二信使——钙离子(一)”、“第二信使——钙离子(二)”及“植物的‘双刃剑'——活性氧”中,已经对一些常见的第二信使有了比较详细的介绍,因此这期推文小远主要给大家介绍一些不太常见的第二信使,以丰富大家对第二信使的认识。
01
pRib-AMP/ADP&ADPr-ATP/di-ADPR
植物抵御微生物的侵染有两层免疫防御体系,分别是病原相关分子模式触发的免疫 (Pattern-Triggered Immunity,PTI)和效应因子触发的免疫(Effector-Triggered Immunity,ETI)。在ETI过程中,核苷酸结合的富含亮氨酸重复序列(NLR)受体发挥着识别效应因子的重要作用。而NLR受体中有一类是N端含有TIR结构域(Toll-Interleukin-1 receptor)的TNL受体,当TNL识别到特定病原效应蛋白后,其下游信号需通过EDS1复合体+helper NLR来传导,这一过程的两条经典通路分别是TNL-EDS1-PAD4-ADR1通路和TNL-EDS1-SAG101-NRG1通路(Dongus and Parker, 2021)。然而,EDS1接收TNL传递了哪些信号物质还不清楚。
2022年7月,清华大学柴继杰课题组联合清华大学韩志富课题组、郑州大学和河南师范大学常俊标课题组、德国马克斯-普朗克植物育种研究所Jane E. Parker课题组在Nature杂志上背靠背发表了两篇题为“Identification and receptor mechanism of TIR-catalyzed small molecules in plant immunity”和“TIR-catalyzed ADP-ribosylation reactions produce signaling molecules for plant immunity”的研究论文,两篇文章互为印证和补充。作者为了弄清楚TNL传递了哪些小分子,通过昆虫细胞重组了TNL免疫通路,结合结构生物学和生物化学等方法,最终找到了TNL合成的四种小分子pRib-AMP/ADP和ADPr-ATP/di-ADPR,前两种小分子可以结合并激活EDS1-PAD4复合体,激活后的复合体可以结合下游ADR1从而向下传递信号;后两种小分子可以结合并激活EDS1-SAG101复合体,激活后的复合体可以结合下游NRG1从而向下传递信号(图2)。在讨论部分,作者表示pRib-AMP/ADP能在生物应激信号转导中发挥广泛作用,与钙离子信号存在密切联系以及能够快速被降解等第二信使所具备的典型特征(ADPr-ATP/di-ADPR虽未明确说但与之情况类似),着重讨论pRib-AMP/ADP的各项特性表明作者在第二信使的定义上同样谨慎。
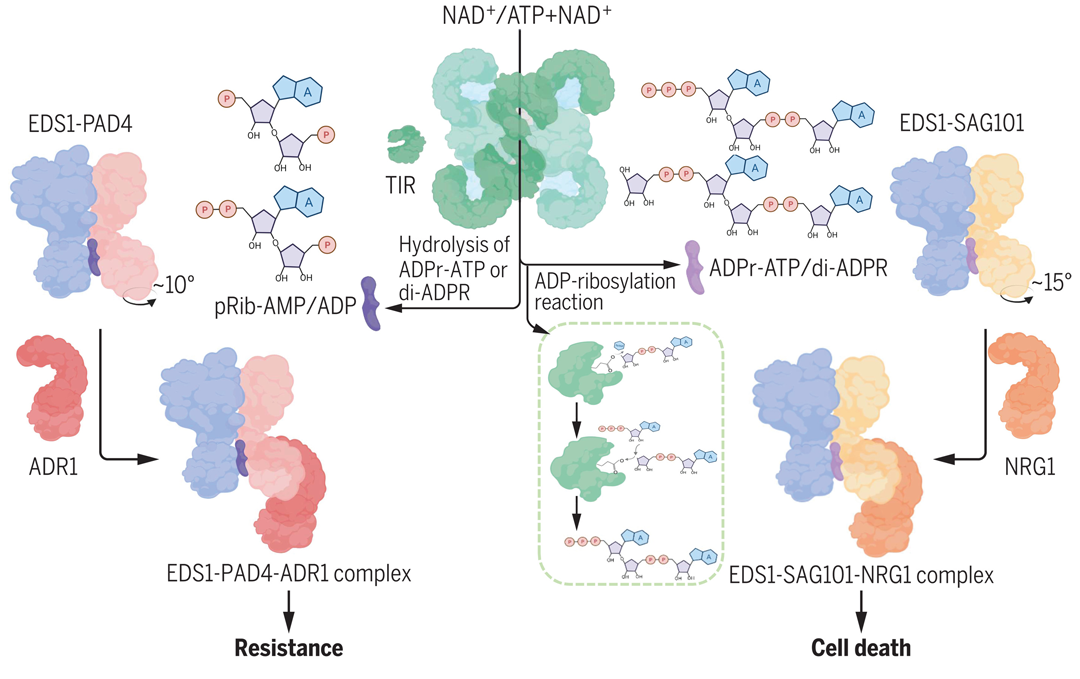
图2 第二信使pRib-AMP/ADP&ADPr-ATP/di-ADPR参与调控植物免疫模式图(Huang et al., 2022; Jia et al., 2022)。
02
2',3'-cAMP/cGMP
通常,我们见到的cAMP/cGMP都是3',5'-cAMP/cGMP,因为3',5'-cAMP/cGMP是细胞中cAMP/cGMP的主导异构体且催化其生成的酶也比较清楚。相比之下,作为3',5'-cAMP/cGMP异构体的2',3'-cAMP/cGMP研究并不多,以前也并未发现其合成酶,所以其功能也不甚明确。
2022年5月,清华大学柴继杰课题组联合马克斯普朗克植物育种研究所Paul Schulze-Lefert课题组以及新加坡南洋理工大学吴彬课题组在Cell杂志上发表了一篇题为“TIR domains of plant immune receptors are 2',3'-cAMP/cGMP synthetases mediating cell death”的研究论文,该研究发现了合成2',3'-cAMP/cGMP的酶TIR以及水解2',3'-cAMP/cGMP的酶NUDT7(图3),这为进一步研究2',3'-cAMP/cGMP是否作为第二信使发挥作用奠定了基础。
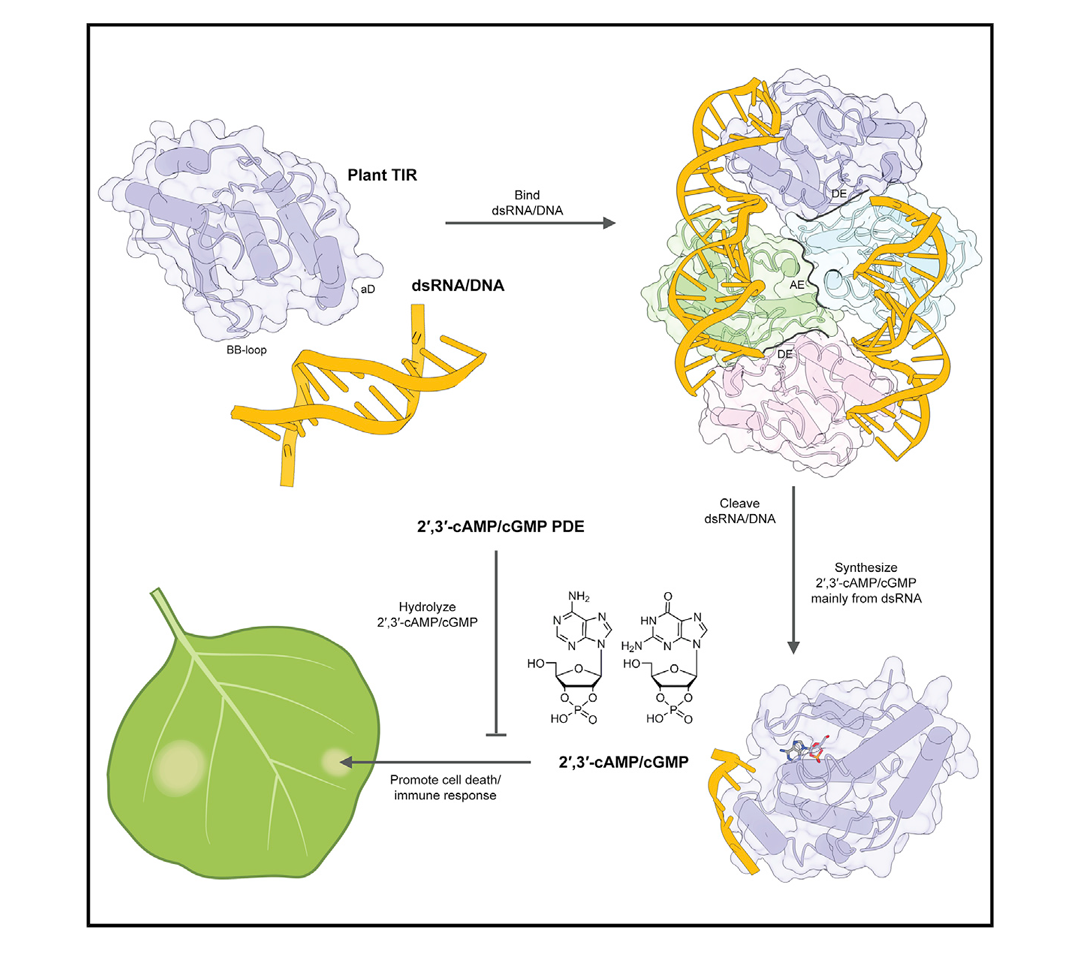
图3 2',3'-cAMP/cGMP的合成和水解过程(Yu et al., 2022)。
2024年10月,中国科学院植物研究所种康院士课题组在Molecular Cell杂志上发表了一篇题为“COLD6-OSM1 module senses chilling for cold tolerance via 2',3'-cAMP signaling in rice”的研究论文,该研究发现低温诱导下,OSM1与COLD6蛋白形成复合物感受低温,进一步引发细胞内2',3'-cAMP水平升高,最后高水平的2',3'-cAMP能提高植株的耐寒能力(图4)。除了在耐寒方面的作用,有研究发现2',3'-cAMP/cGMP在植物受到机械损伤、高温以及暗胁迫后也都会上调表达(Kosmacz et al., 2018;Van Damme et al., 2014),这说明2',3'-cAMP/cGMP可能在这些过程中扮演了“传令兵”的角色。
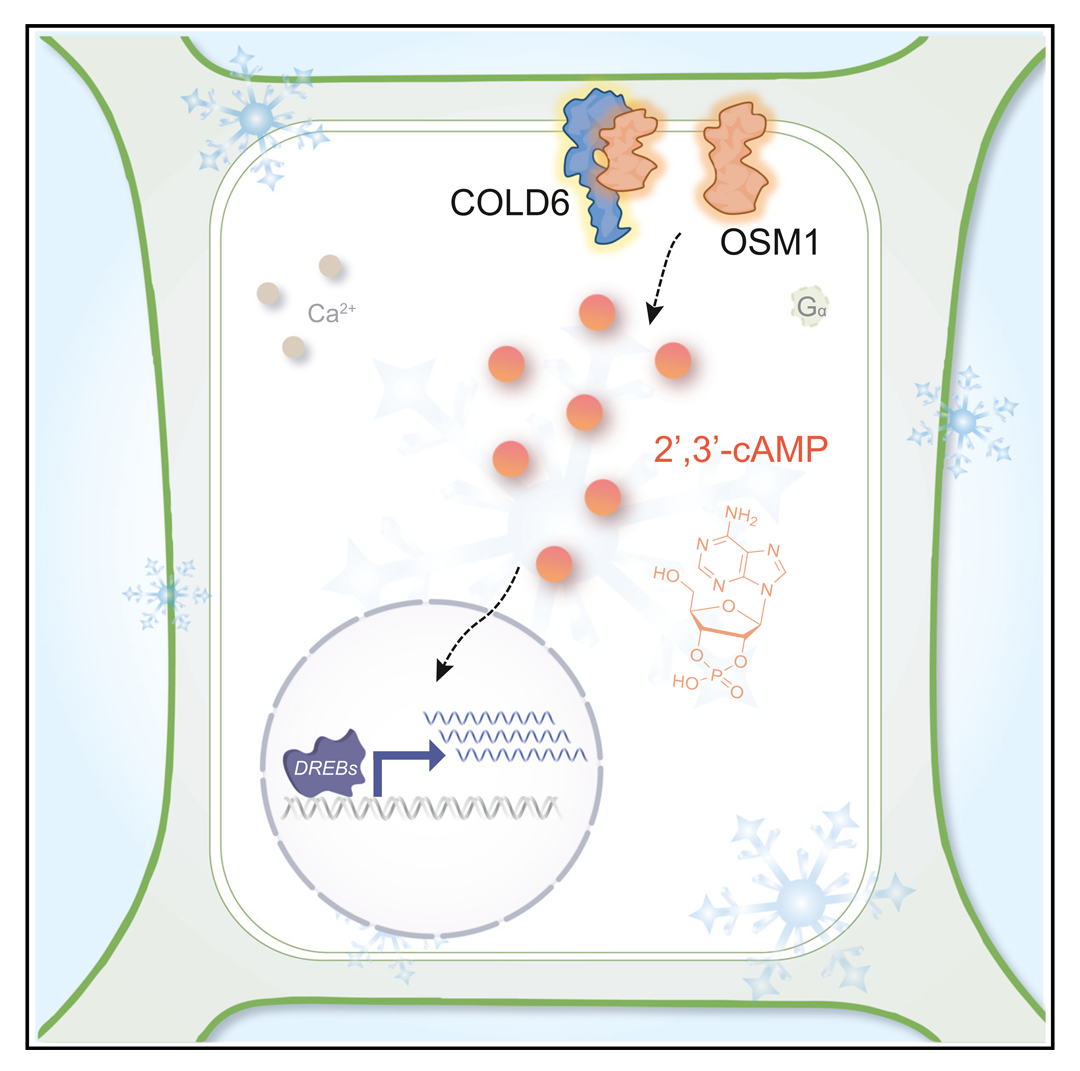
图4 2',3'-cAMP参与低温信号传导(Luo et al., 2024)。
从以上的研究中我们可以发现,2',3'-cAMP/cGMP基本上具备了作为第二信使的特性,然而2',3'-cAMP/cGMP的受体是什么,其如何传递信息以及是否与其他信号存在crosstalk还需要更多的研究来进一步说明。
03
LPA
在动物中,溶血磷脂酸(LPA)是一种重要的第二信使,可以通过G蛋白偶联受体向下传递多种信号,调节细胞的各种生命活动。而在植物中,LPA在信号传导过程中的研究还不多,是否作为第二信使发挥作用也还不明确。
2022年12月,南京农业大学张群课题组在PNAS杂志上发表了一篇题为“Mitochondrial GPAT-derived LPA controls auxin-dependent embryonic and postembryonic development”的研究论文,该研究发现,在拟南芥胚胎发育过程中,线粒体中的甘油-3-磷酸酰基转移酶GPAT1和GPAT2可以催化脂肪酰基转移形成LPA。进一步研究发现,LPA可以结合生长素外排载体PIN1并通过调节PIN1的囊泡运输从而参与生长素信号传导过程(图5)。这个过程中,LPA通过调控生长素运输参与了初始信号的放大。
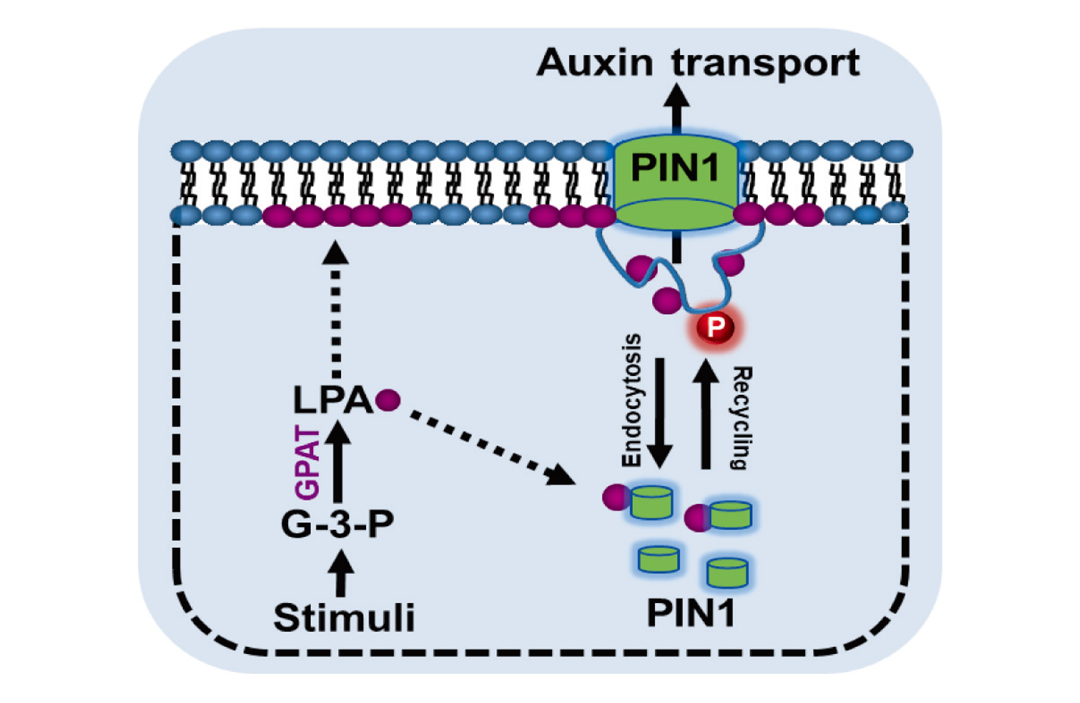
图5 LPA调节生长素信号传导示意图(Jia et al., 2022)。
上面这篇研究中,作者虽然没有以第二信使的角度来说明LPA在信号传递过程中的作用,但是根据已有的结果可以发现,LPA具备了一些第二信使的特征。因此小远认为LPA可能是植物中一种新的第二信使,只不过局限于有限的研究,部分机制仍未完全阐明,例如LPA的上游信号是什么,如何被降解以及是否与其他信号存在crosstalk,这些还值得深究。
锌离子
钙离子以往作为第二信使中的唯一离子,在各种生理活动中发挥着重要的信息传递功能。那么大家是否想过有没有其他类型的离子也能发挥第二信使的作用呢?对于豆科植物来说,除了从土壤中吸收氮素还可以通过根瘤来固定氮素。然而,在充足氮素条件下,根瘤的形成被抑制,这说明根瘤中可能存在调控这一现象的相关通路。
2024年6月,丹麦奥胡斯大学林杰顺课题组联合其他单位在Nature杂志上发表了一篇题为“Zinc mediates control of nitrogen fixation via transcription factor flamentation”的研究论文,作者发现bZIP家族转录因子FUN突变体在高氮条件下根瘤正常形成并能正常固氮。进一步研究发现,FUN基因的表达不受氮含量调节,这说明可能在蛋白层面上FUN的活性受到调控。分析FUN的结构域发现,除了bZIP的结构域,FUN上还含有一个sensor结构域,这说明FUN的功能可能通过sensor结构域受到某些配体的调控。与猜想一致,作者最终找到了FUN sensor结构域的配体——锌。有意思的是,锌离子可以结合FUN影响其活性状态。高氮条件下,根瘤中的锌含量较低,FUN处于活性状态,从而调控下游根瘤衰老基因及固氮相关基因的表达,最终导致根瘤衰老和固氮能力下降;而低氮条件下,根瘤中锌含量较高,FUN处于抑制状态,根瘤生长及固氮能力正常(图6)。以上结果说明,锌可以将外界氮信号传递给FUN,从而调控根瘤的生长及固氮能力。
回顾以上研究,可以发现锌确实具备第二信使的相关特性,但是也存在一些尚未明确的地方,比如,根瘤中的锌含量是否受到某些转运体的调控,是否与其他信号存在crosstalk以及是否在其他的生理活动中发挥作用。
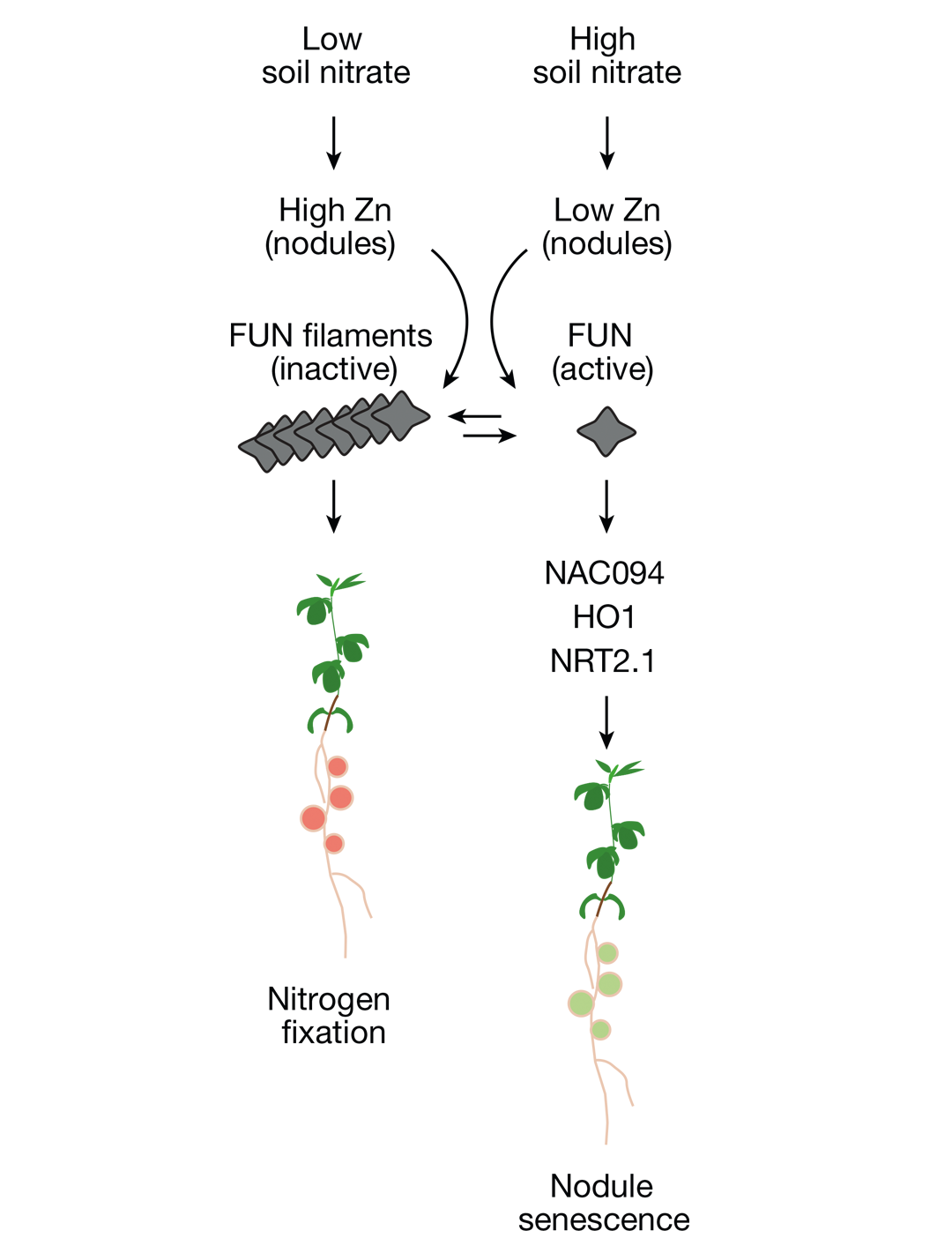
图6 锌参与FUN调节根瘤功能的机制模型(Lin et al., 2024)。
05
一氧化氮(NO)与ROS类似,都属于含氧小分子物质,都可以通过氧化还原在植物的生长发育以及应对胁迫等过程中发挥重要作用。有关ROS作为第二信使的相关内容在往期推文“植物的‘双刃剑'——活性氧”中有所介绍,感兴趣的读者可以回顾一下。这里小远就给大家介绍一下NO这种与ROS有诸多相似处但在植物中却相对冷门的第二信使。
NO通过S-亚硝基化修饰实现其关键的生理功能调控,这是一种依赖氧化还原状态的翻译后修饰,其本质是将NO基团共价结合至靶蛋白的活性半胱氨酸残基,形成S-亚硝基硫醇(SNO),从而动态调控蛋白质的结构和功能。在植物气孔发育中,丝裂原活化蛋白激酶(MAPK)级联和NO分别发挥着负调控和正调控的作用,然而两者间具体调控的联系是什么并不清楚。
2025年4月,中国科学院遗传与发育生物学研究所左建儒课题组联合郭红艳课题组在Developmental Cell杂志上发表了一篇题为“Nitric oxide controls stomatal development and stress responses by inhibiting MPK6 phosphorylation via S-nitrosylation in Arabidopsis”的研究论文,该研究发现NO控制的MPK6的S-亚硝基化修饰可抑制其激酶活性,从而提高下游SPCH(气孔发育关键转录因子)蛋白的稳定性,最终促进气孔发育(图7)。在这个过程中,NO介导的S-亚硝基化修饰是可逆的,所以NO可以很灵活地控制气孔的发育情况,并通过参与MAPK的信号级联过程传递和放大上游信号。
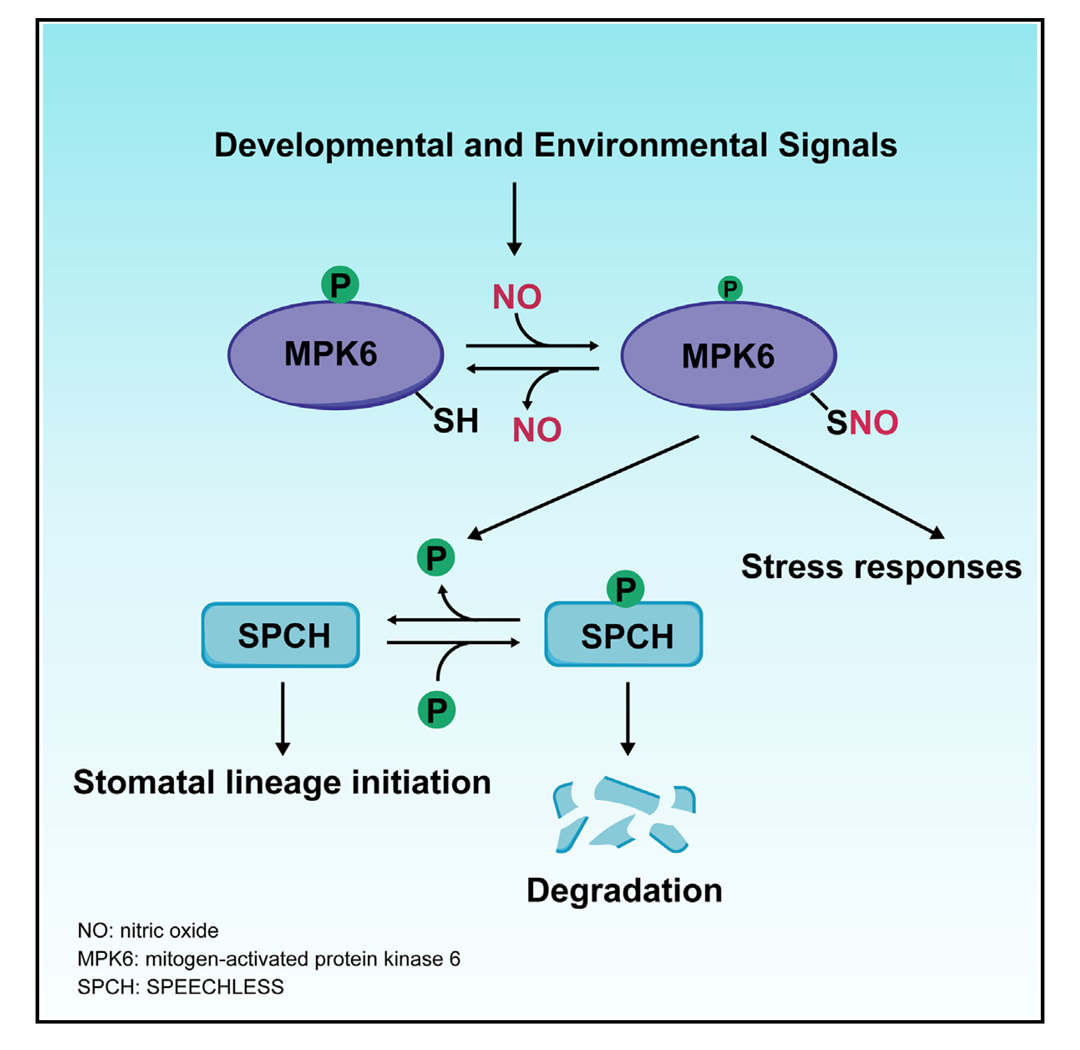
图7 NO介导的S-亚硝基化修饰参与气孔发育相关信号传导过程(Wang et al., 2025)。
除了这篇文章中提到的NO的作用,NO还参与了其他许多植物的信号传导过程,也与其他第二信使存在crosstalk,这里给大家推荐一篇相关综述“Interorgan, intraorgan and interplant communication mediated by nitric oxide and related species”,感兴趣的读者可以自行了解一下。
值得注意的是,ROS和NO通过蛋白质翻译后修饰介导信号传导的方式,显著区别于经典第二信使依赖配体-受体结合的传统模式。然而,尽管NO也作为植物中重要的第二信使发挥作用,其受到的关注度远不及ROS。小远觉得NO作为信号分子的独特性值得更多关注,未来应进一步探索其在植物信号转导中的功能与机制。
06
H2S
除了上面介绍的NO外,还有一种相对冷门的气体类第二信使——硫化氢(H2S),这种气体在植物的生长发育过程中同样起着十分重要的作用。H2S介导的信号激活与传递主要通过其对蛋白质的硫巯基化修饰实现,即将蛋白质中半胱氨酸(Cys)残基上的巯基(R-SH)转化为过硫化物(R-SSH)结构。研究表明,半胱氨酸合酶样蛋白脱巯基酶(DES1)对L-Cys具有高亲和力,可以催化其降解产生H2S( Alvarez et al., 2010)。另外,H2S可能在植物激素ABA调节植物的气孔运动上发挥着作用,但是H2S如何参与这个过程还不是很清楚(Shen et al., 2020)。
2021年3月,南京农业大学谢彦杰课题组在Molecular Plant杂志上发表了一篇题为“Hydrogen sulfide-linked persulfidation of ABI4 controls ABA responses through the transactivation of MAPKKK18 in Arabidopsis”的研究论文,该研究发现ABA引发的H2S生成导致气孔调节关键转录因子ABI4在Cys250位点发生过硫化,过硫化后的ABI4提高了对下游靶标MAPKKK18的转录激活(图8)。在这个过程中,H2S通过蛋白翻译后修饰将ABA信号传递到MAPK信号,完成了信息的传递和放大。
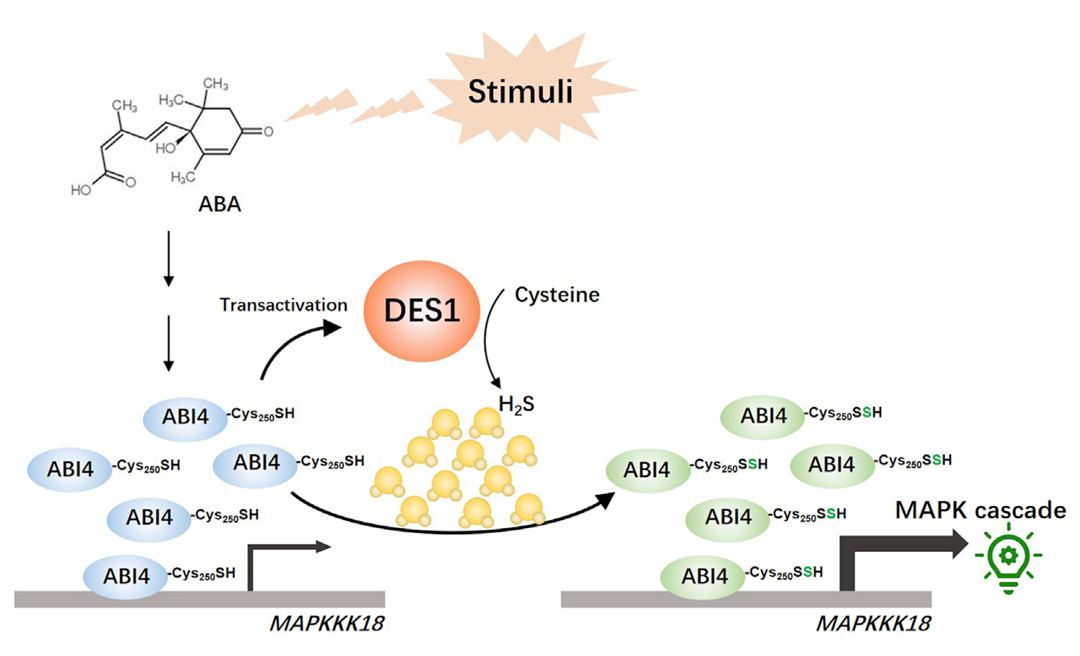
图8 H2S通过介导ABI4硫巯基化修饰参与气孔调节(Zhou et al., 2021)。
结合上篇NO的文章,可以发现这些可以参与氧化还原的第二信使都可以通过蛋白翻译后修饰传递信息,这一方面凸显了蛋白翻译后修饰在调节蛋白功能中的作用,另一方面更加说明了氧化还原是生命代谢的核心机制。然而,相较于NO,H2S的研究起步相对较晚,且H2S毒性更大且有刺鼻气味,所以这在一定程度上影响了对H2S的研究。相信随着对信号传导的研究深入,H2S的相关研究会越来越多,尤其是多种氧化还原信号crosstalk领域的研究。
第二信使间的crosstalk
在前面的内容中,伯远生物给大家介绍了一些不常见的第二信使的相关研究,从这些研究中我们可以看出每一种第二信使都发挥着十分关键的作用。大家是否想过,既然细胞内有如此多的“传令兵”,那它们之间是否有crosstalk呢,如果有的话是否可以通过这些“传令兵”关联各种不同的调控通路呢?
2024年2月,浙江大学梁岩课题组联合浙江省农科院林福呈课题组在Cell Host & Microbe杂志上发表了一篇题为“DGK5β-derived phosphatidic acid regulates ROS production in plant immunity by stabilizing NADPH oxidase”的研究论文,该研究发现在植物免疫过程中,激活的受体相互作用蛋白激酶(RIPK)可磷酸化二酰基甘油激酶DGK5β中钙调素结合域的Ser506位点,进而增强DGK5β催化磷脂酸(PA)生成的能力。产生的PA能够与呼吸爆发氧化酶RBOHD结合,抑制其液泡途径的降解,促进RBOHD在质膜上的积累,并激活ROS的爆发,从而显著增强植物对灰霉病的抗性(图9)。从上述结果可以发现,这项研究涉及了钙离子-PA-ROS多种第二信使的交互,这可以帮助我们从整体上理解不同信号通路crosstalk的联合作用。实际上,RBOHD也存在其他类型的各种修饰,包括硫巯基化修饰以及亚硝基化修饰等(Zhang et al., 2024),所以推测H2S和NO也可能参与了上述研究提到的通路中。
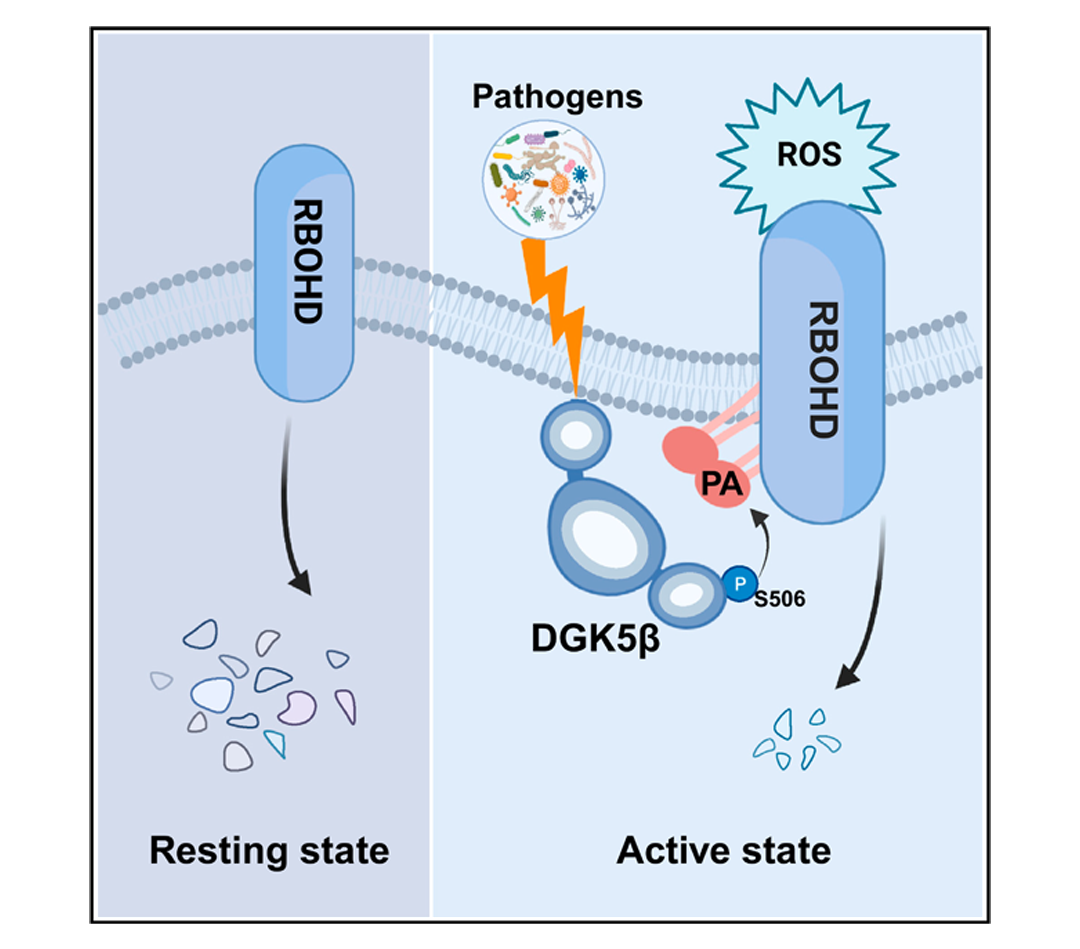
图9 钙离子-PA-ROS三种第二信使的crosstalk(Qi et al., 2024)。
既然“传令兵”可以传递多种上游信号,关联多种调控通路,那它们是如何准确区分上游信号并准确传递到下游组分呢?因为细胞是一个空间的结构,所以第二信使可以通过浓度变化的速度、幅度、频率、持续时间以及亚细胞定位来确保接受不同的上游信号并准确向下传递。Dodd等人就在“The language of calcium signaling”一文中描述过钙离子是如何通过这些机制准确处理多种信号的,感兴趣的读者可以自己了解下。
在本文中,伯远生物介绍了多种“冷门”但具有潜力的植物第二信使及其作用方式。尽管部分分子在功能上表现出第二信使的典型特征,但在定义其身份时仍需谨慎,相关判断必须建立在充分的实验证据和时间验证的基础上。随着植物分子层面研究的深入,越来越多复杂的信号通路被逐步解析。然而,如何将这些通路有机整合,进一步理解植物在不同生理状态下的整体调控机制,仍是当前研究亟需突破的方向。小远认为,细胞内的第二信使在串联多条信号路径、协调多通路响应中发挥着关键作用。深化对已知第二信使的研究,并不断探索新的第二信使类型,将有助于推动植物信号研究从“局部拆解”走向“系统整合”,进而加深我们对植物生命活动整体性调控机制的理解。
References:
Aݩlvarez C, Calo L, Romero L C, et al. An O-acetylserine (thiol) lyase homolog with L-cysteine desulfhydrase activity regulates cysteine homeostasis in Arabidopsis[J]. Plant Physiology, 2010, 152(2): 656-669.
Chen, H., Qi, L., Zou, M. et al. TIR1-produced cAMP as a second messenger in transcriptional auxin signalling. Nature 640, 1011–1016 (2025).
Dodd A N, Kudla J, Sanders D. The language of calcium signaling[J]. Annual review of plant biology, 2010, 61(1): 593-620.
Dongus J A, Parker J E. EDS1 signalling: At the nexus of intracellular and surface receptor immunity[J]. Current opinion in plant biology, 2021, 62: 102039.
Huang S, Jia A, Song W, et al. Identification and receptor mechanism of TIR-catalyzed small molecules in plant immunity. Science 377: eabq3297[EB/OL].(2022)
Jia A, Huang S, Song W, et al. TIR-catalyzed ADP-ribosylation reactions produce signaling molecules for plant immunity. Science 377, eabq8180[EB/OL].(2022)
Jia Q, Bai Y, Xu H, et al. Mitochondrial GPAT-derived LPA controls auxin-dependent embryonic and postembryonic development[J]. Proceedings of the National Academy of Sciences, 2022, 119(49): e2212881119.
Kolbert Z, Barroso J B, Boscari A, et al. Interorgan, intraorgan and interplant communication mediated by nitric oxide and related species[J]. New Phytologist, 2024, 244(3): 786-797.
Kosmacz M, Luzarowski M, Kerber O, et al. Interaction of 2′, 3′-cAMP with Rbp47b plays a role in stress granule formation[J]. Plant physiology, 2018, 177(1): 411-421.
Lin J, Bjørk P K, Kolte M V, et al. Zinc mediates control of nitrogen fixation via transcription factor filamentation[J]. Nature, 2024, 631(8019): 164-169.
Qi F, Li J, Ai Y, et al. DGK5β-derived phosphatidic acid regulates ROS production in plant immunity by stabilizing NADPH oxidase[J]. Cell Host & Microbe, 2024, 32(3): 425-440. e7.
Shen J, Zhang J, Zhou M, et al. Persulfidation-based modification of cysteine desulfhydrase and the NADPH oxidase RBOHD controls guard cell abscisic acid signaling[J]. The Plant Cell, 2020, 32(4): 1000-1017.
Van Damme T, Blancquaert D, Couturon P, et al. Wounding stress causes rapid increase in concentration of the naturally occurring 2′, 3′-isomers of cyclic guanosine-and cyclic adenosine monophosphate (cGMP and cAMP) in plant tissues[J]. Phytochemistry, 2014, 103: 59-66.
Wang D, Guo H, Gong X, et al. Nitric oxide controls stomatal development and stress responses by inhibiting MPK6 phosphorylation via S-nitrosylation in Arabidopsis[J]. Developmental Cell, 2025.
Zhang X, Zhang D, Zhong C, et al. Orchestrating ROS regulation: coordinated post‐translational modification switches in NADPH oxidases[J]. New Phytologist, 2025, 245(2): 510-522.
Zhou M, Zhang J, Shen J, et al. Hydrogen sulfide-linked persulfidation of ABI4 controls ABA responses through the transactivation of MAPKKK18 in Arabidopsis[J]. Molecular Plant, 2021, 14(6): 921-936.




















 911
911

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








