2.5.2A 心血管医疗设备:心脏瓣膜、起搏器和除颤器、机械循环支持及其他心内装置
引言
心血管疾病仍然是西方世界发病率和死亡率的首要病因,每年在美国造成超过80万例(近三分之一)死亡。此外,作为全球最主要的死因,心血管疾病每年导致超过1700万人死亡,预计到2030年这一数字将增长至超过2300万。其中最重要的亚型是冠心病,占死亡人数的七分之一以上,仅在美国每年就导致超过36万人死亡。此外,美国每年另有超过2.5万人死于瓣膜性心脏病,其中1.7万人患有主动脉瓣疾病,预计到2040年该数字将翻倍,到2060年将增至三倍(本杰明等,2019年)。
好消息是,在过去的数十年中,针对心血管疾病患者的创新外科手术和介入性诊断与治疗手术的数量和范围都出现了显著增长。来自国家卫生统计中心和美国心脏协会的数据显示,美国每年大约进行800万例重大心脏和血管手术。这些外科手术和介入手术的广泛应用,同时伴随着并且离不开各种由高度先进生物材料制成的假体和医疗设备的使用。2014年的数据显示,经皮冠状动脉介入手术(几乎全部使用血管内裸金属或药物洗脱支架)、371,000例冠状动脉旁路移植术、156,000例心脏瓣膜手术、起搏器、导线和转复除颤器(420,000例),以及大量心脏辅助装置、血管移植物、封堵器、补片和其他器械的使用(达戈斯蒂诺等,2018年;本杰明等,2019年)。
因此,心血管假体和医疗设备及其组成的生物材料对于介入心脏病学家和心脏与血管外科医生的临床实践至关重要。器械的数量和复杂性使得可以在外科手术或导管式介入治疗方案之间进行选择,从而优化患者的短期和长期管理。认识到这些器械的并发症(其中许多与构成器械的生物材料有关),并加以理解,已促使人们通过生物材料及器械的研发不断改进其性能和安全性。由此带来的显著进步已转化为更优质的患者护理。对于已广泛应用多年的器械,其并发症的性质、发生频率和病理解剖结构,以及相关的血液–组织–生物材料相互作用机制已有发表;但对于近年新引入或改进的器械以及目前处于研发阶段的器械,这些方面的认识仍较为有限(肖恩和戈特利布,2016年;布贾和肖恩,2016年)。
本章及后续章节总结了心血管医疗设备的关键考虑因素,包括这些设备所针对和用于治疗的疾病的潜在病理、相关的生物材料信息,以及需要避免的最重要并发症。第一章重点讨论与心脏瓣膜假体相关的设计中的生物材料和工程问题,这类假体已广泛应用了约六十年,在临床上具有重要意义;多种类型瓣膜假体所出现的并发症及其结局和病理描述已被广泛了解。本章还讨论了起搏器和可植入转复除颤器(ICD)、可植入心脏辅助装置和人工心脏,以及其他心内装置,包括通过经皮导管技术以微创方式治疗心血管疾病的方法,如房间隔缺损封堵器和左心耳封堵器。第二章讨论用于血管修复与置换的器械(包括血管移植物、腔内血管支架和支架移植物)、预防肺栓塞的滤器,以及其他位于心脏外部的导管和心血管设备。
心脏瓣膜功能与瓣膜性心脏病
四个心内瓣膜在确保血液单向流经心脏方面起着关键作用。三尖瓣允许血液从右心房单向流入右心室,肺动脉瓣允许血液从右心室单向流入肺动脉,二尖瓣允许血液从左心房单向流入左心室,主动脉瓣则允许血液从左心室单向流入主动脉。心脏瓣膜随着每个心动周期开闭一次,即大约每秒一次,相当于每年约四千万次,75年寿命中约三百亿次。
心脏瓣膜疾病可引起狭窄(即血流受阻)或反流(即血液经瓣膜反向流动)(Schoen和Mitchell,2015;舍恩和布塔尼,2016)。有时,同一瓣膜可同时存在狭窄和反流。某些疾病过程(如感染性心内膜炎(心脏瓣膜感染))可在数天内迅速破坏受累瓣膜,导致急性心力衰竭甚至死亡;而其他疾病(如钙化性主动脉瓣狭窄)则可能需要数十年才会出现临床表现。近年来,研究人员在建立一个整合心脏瓣膜从宏观到微观再到超微结构的动态功能结构、生物力学特性以及病理生物学行为的概念框架方面取得了进展(Ayoub等,2017)。
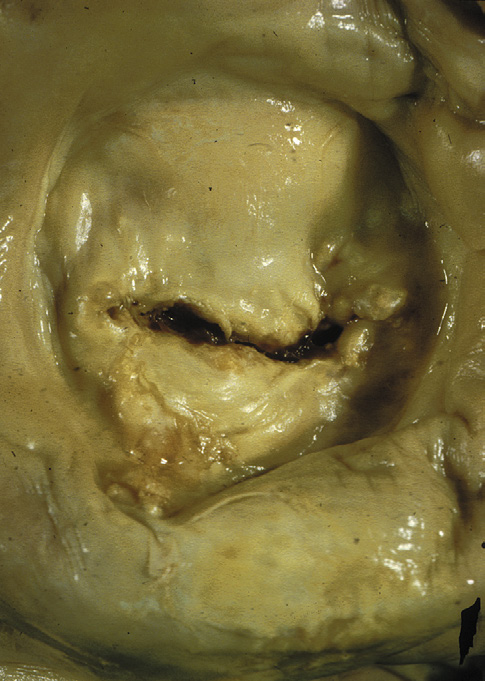
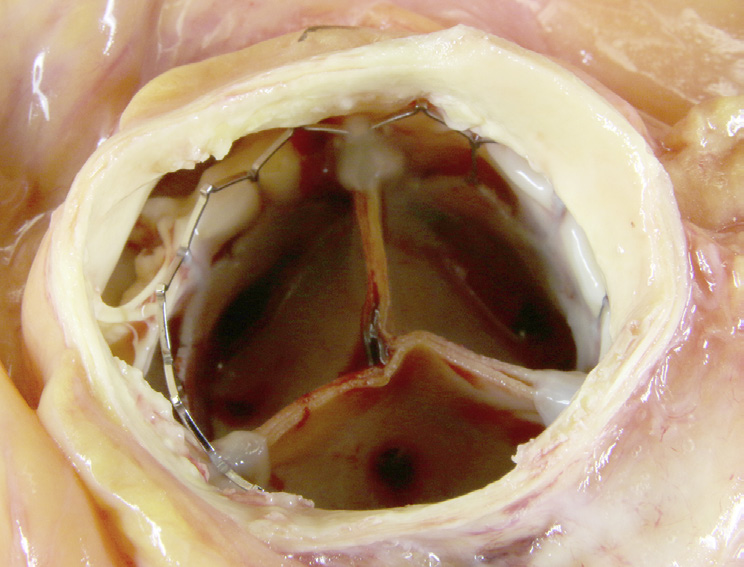
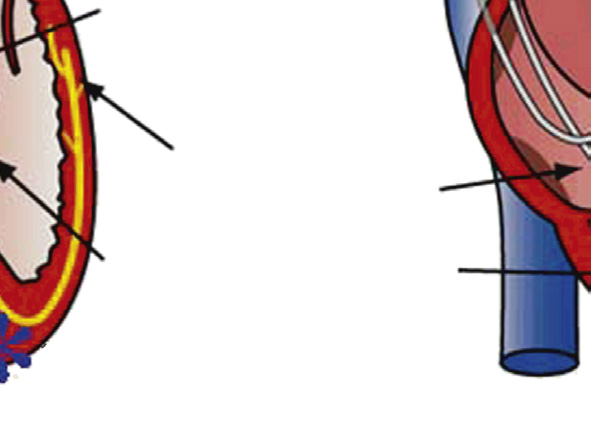
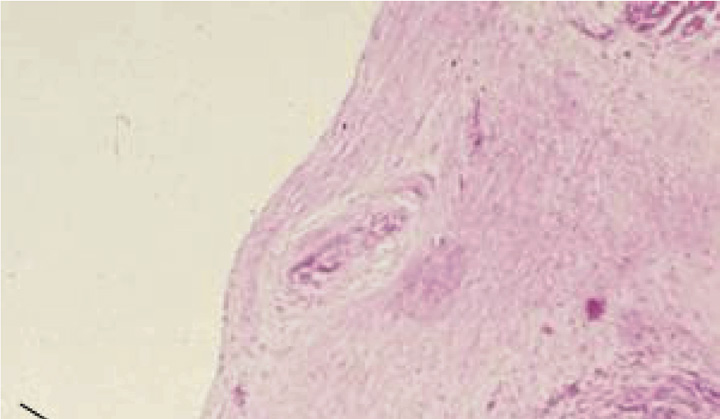
瓣膜性心脏病有多种主要类型,大多涉及主动脉瓣和/或二尖瓣。最常见的瓣膜疾病类型以及总体上进行瓣膜置换的主要指征是钙化性主动脉瓣狭窄——即由于原本解剖结构正常的瓣叶发生年龄相关性钙化,导致主动脉瓣继发性梗阻(图2.5.2A.1A)(卡贝洛和保卢斯,2009)。阐明主动脉瓣钙化的精确机制一直较为困难,但近年来通过对持续性和周期性机械力对瓣膜间质细胞行为以及瓣膜组织内炎症性细胞因子环境的影响研究,已取得了一些新认识(梅里曼和舍恩,2013)。钙化结节在瓣叶中形成,导致瓣膜无法完全打开,从而引起左心室压力超负荷,进而诱发该心腔壁的肥厚(质量增大)。这种状况需要数十年才会发展,并通常在人生的第七和第八个十年出现症状。
尽管正常的主动脉瓣有三个小叶,但所有人群中1%–2%的人出生时即带有二叶式主动脉瓣(即仅有两个小叶),这种情况称作先天性二叶式主动脉瓣(马蒂厄等人,2015)。先天性二叶式瓣膜通常在早期及成年期功能良好,但患有此状况的人会在相对较年轻的年龄出现瓣膜功能障碍,从而产生症状——大约比具有三个小叶瓣膜的患者早10年。
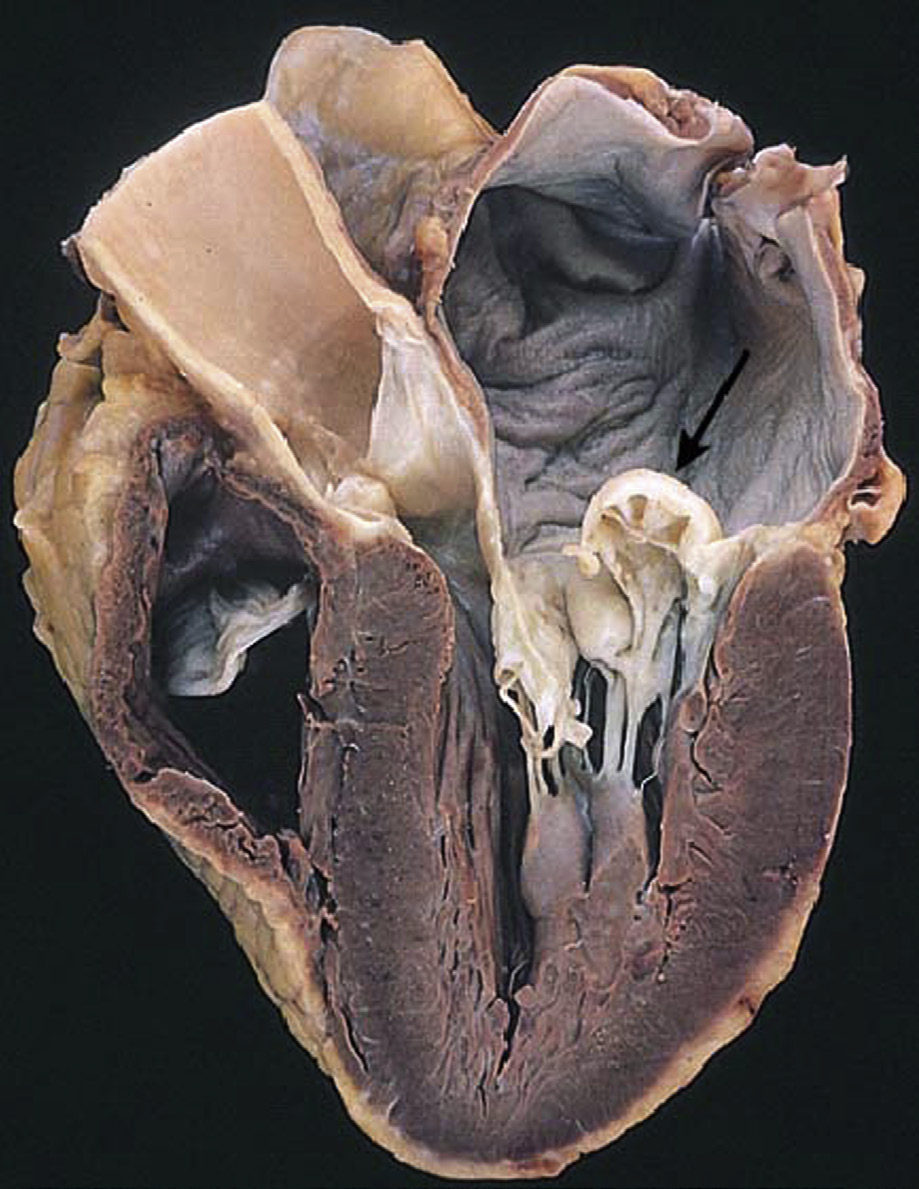
主动脉瓣反流(也称为主动脉瓣关闭不全)虽较不常见,但仍是重要的问题,最常由主动脉根部扩张引起。这会导致瓣膜小叶无法完全有效地闭合,从而允许血液通过瓣膜反流,导致左心室容量超负荷(戈德伯格和哈尔佩林,2008)。二尖瓣狭窄(图2.5.2A.1B)有一个主要病因——慢性风湿性心脏病,该病导致二尖瓣瓣叶发生瘢痕化和僵硬。这种疾病通常在链球菌性咽炎(一种常见的儿童咽喉感染)引发的急性风湿热发作后数年甚至数十年才出现临床表现(钱德拉谢卡尔等人,2009)。而二尖瓣反流则由多种不同病因引起;最常见的为黏液样瓣膜退行性变(又称松弛的二尖瓣),其特征是二尖瓣组织强度不足,导致瓣叶过度变形(Carabello, 2008)(图2.5.2A.1C)。此外,左心室异常扩张和/或存在瘢痕,致使瓣膜支撑不良,以及感染性心内膜炎(即瓣膜感染)等,也是二尖瓣反流的其他主要原因。
右侧瓣膜(三尖瓣和肺动脉瓣)的疾病远比左侧瓣膜少见。然而,在患有先天性心脏病的儿童中,除了左侧瓣膜外,还需要用于肺动脉位置的瓣膜;因先天性畸形进行的瓣膜置换约占所有瓣膜置换的5%(巴内特和阿德,2009年)。瓣膜性心脏病的主要临床并发症是心力衰竭,其原因是病变瓣膜上游或下游心腔因压力或容量超负荷引起心肌改变所致。

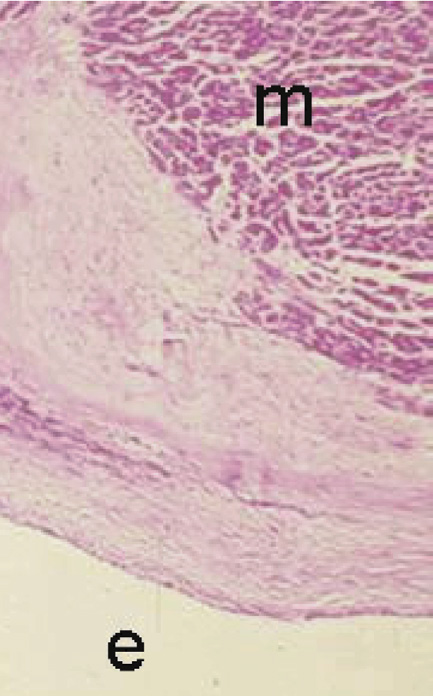
心脏瓣膜病很常见且严重,患有各种类型心脏瓣膜病的患者具有较高的死亡率和发病率。例如,对于未接受外科手术治疗的重度主动脉瓣狭窄(最严重的功能异常),在症状出现后2–3年的死亡率约为50%(图2.5.2A.2A);因此,这种疾病的自然病程比许多癌症更为严重。瓣膜置换术对此类患者是一种非常有益的治疗方式;瓣膜置换术后10–15年的存活率为50%–70%,无严重并发症存活率约为30%–50%(Rahim-tool a, 2003)。主动脉瓣和二尖瓣置换术的手术死亡率分别为3%和6%。尽管如此,瓣膜置换术相较于疾病的自然病程已有显著改善,但接受人工瓣膜的患者仍可能发生与装置相关的并发症(图2.5.2A.2A)。

瓣膜性心脏病的外科手术治疗包括使用假体进行瓣膜置换,以及修复现有的异常瓣膜组织以恢复其功能(费达克等人,2008年)。根据医疗保健研究与质量局医疗卫生成本和利用项目收集的数据估算,2005年,美国有36,678人接受了主动脉瓣或二尖瓣置换术,8,669人接受了瓣膜修复手术(巴内特和阿德,2009年)。重建/修复手术旨在消除二尖瓣关闭不全的修复以及最大程度减轻风湿性二尖瓣狭窄的严重程度,如今已非常有效且普遍。美国最近的一项临床实践调查显示,目前69%的二尖瓣反流外科手术采用修复而非置换(加米等人,2009年)。只要可能,瓣膜修复优于置换;修复的优势在于避免了假体相关并发症的风险,并消除了许多置换瓣膜患者所需的长期抗凝治疗,而对于使用机械瓣膜的患者,长期抗凝治疗则是必须的。外科瓣膜修复通常伴随使用或不使用人工瓣环成形环对瓣环进行稳定。遗憾的是,对于大多数主动脉瓣疾病,通常无法进行修复。
当无法进行修复时,重度有症状的瓣膜性心脏病需通过外科瓣膜置换术治疗,该手术包括切除部分或全部病变瓣膜,并以功能性替代物进行置换。从设计角度来看,理想的置换瓣膜应具备非血栓性、非溶血性、抗感染、化学惰性、耐用且易于植入的特点。它应能完全打开并迅速而彻底地关闭,能够在原位适当愈合,并且不会被患者察觉(例如,无噪音)(哈肯等人,1962年;萨皮尔斯汀和史密斯,2001年)。
外科生物假体和机械心脏瓣膜
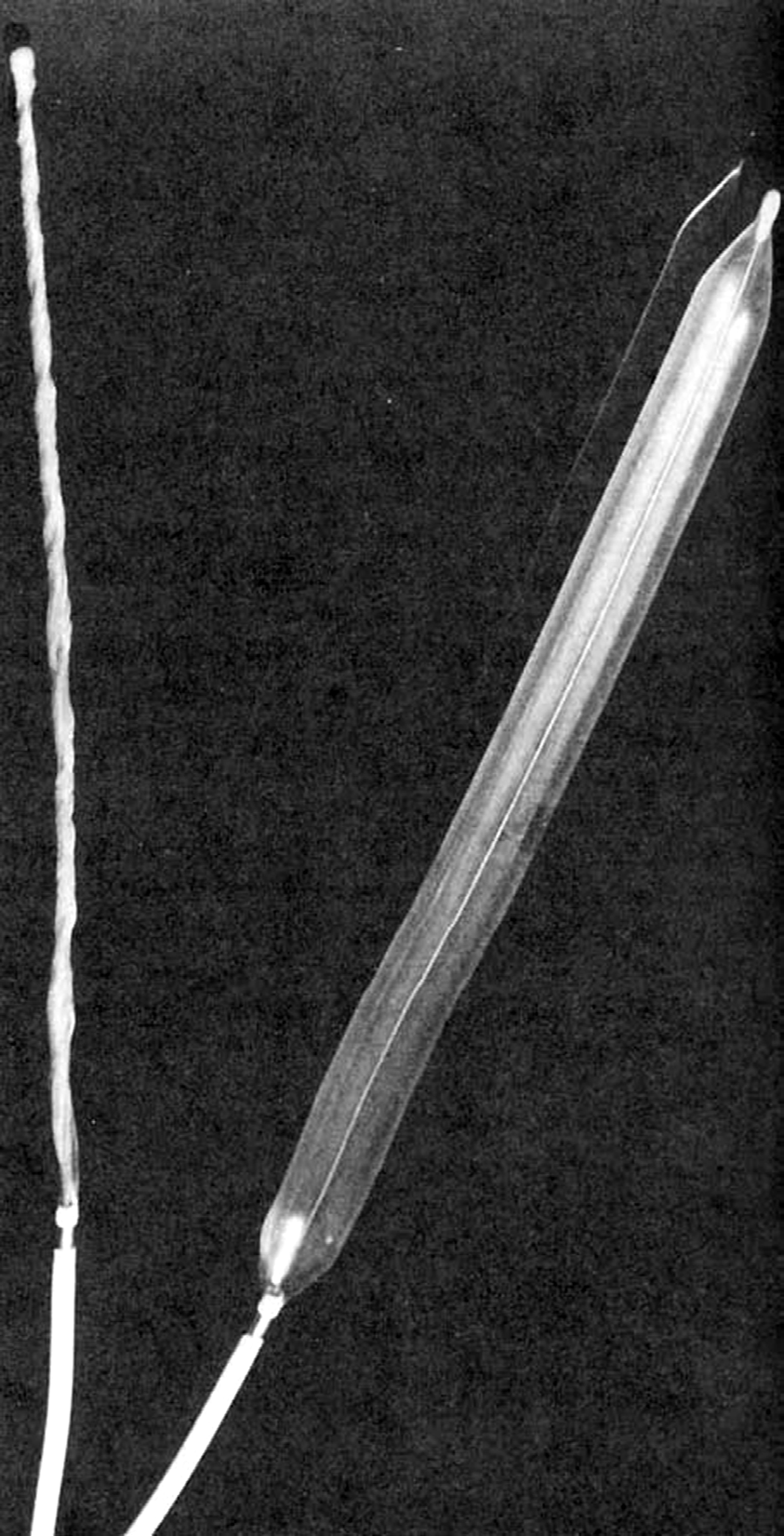
人工心脏瓣膜及相关心血管外科技术的发展在20世纪上半叶得以实现,这得益于多项关键技术的进步,包括心脏导管插入术、创新的外科手术技术、心肺旁路机以及抗凝剂肝素(蔡科夫,2007)。在20世纪50年代后期,由于外科医生与生物医学工程师之间的合作推动,外科研究实验室中成熟的创新手术和装置技术被转化为临床实践。这些发展为使用生物或合成假体置换功能障碍的心血管部件创造了新的机会。现代瓣膜置换技术的一个关键步骤是赫夫纳格尔球阀,该瓣膜设计用于通过近端和远端固定环快速植入主动脉瓣反流患者的降胸主动脉中(布塔尼等,2002)。
然而,该瓣膜虽可防止来自下半身的反流血流,但仅部分减轻了心脏做功,并未改善冠状动脉血流。随后,心脏外科医生阿尔伯特·斯塔尔博士及其同事,联合机械工程师洛厄尔·爱德华兹,制造出一种由不锈钢笼架和热固化硅橡胶球体,以及被聚四氟乙烯织物缝合环包围的基座,后者使外科医生能够将瓣膜原位(即在心脏内的解剖学上的适当位置)缝合固定。上述三种通用组件——活动部件(合成或生物材料)、引导活动阻塞件运动的支撑结构,以及在吻合部位锚定的缝合环——构成了所有既往和现有外科心脏瓣膜假体的关键部分。心脏瓣膜假体已广泛应用半个多世纪以上,是生物材料科学与生物医学工程领域的一项临床重要成就。事实上,享有盛誉的2007年拉斯克临床医学研究奖授予了阿尔伯特·斯塔尔博士和阿兰·卡彭蒂埃博士,以表彰心脏瓣膜置换术作为一项重大临床成功的意义(蔡科夫,2007;利夫顿,2007)。斯塔尔于1960年首次成功地在心脏中实施了瓣膜置换术,通过在二尖瓣位置植入笼球式机械瓣膜假体完成了这一手术(斯塔尔,2007)。卡彭蒂埃制造了一种“生物假体”,将化学处理的生物组织与机械结构相结合,创造出一种基于组织(尽管无生命)的心脏瓣膜置换装置(卡庞捷,2007)。多种不同类型瓣膜假体的相关结果数据及其并发症的病理描述已被广泛认知(冯帕塔纳辛等,1996;博诺等,2006;舍恩和布塔尼,2016)。
斯塔尔和卡彭蒂埃的成就为心脏瓣膜置换术的临床成功奠定了基础。如今,每年在美国有超过8万例瓣膜被置换,全球范围内则超过27.5万例。此外,用于微创和经皮(导管式)瓣膜置换与修复以及其他介入技术的器械和技术正在经历快速的创新与发展,并且在创造具有生命力的组织工程心脏瓣膜置换方面已取得了令人振奋的进展。
已有数百种替代心脏瓣膜置换装置的设计在实验和患者中进行了探索;其中大多数由于设计和材料缺陷导致并发症,而这些并发症只有在临床使用中才显现出来(德瓦尔等,2000;埃德蒙兹,2001;舍恩和布塔尼,2016)。人工瓣膜的开启和关闭完全是被动的,其活动部件(阻塞器或盘[片])对心腔和大血管内的压力及血流变化作出响应。目前的心脏瓣膜替代物主要有两种类型:机械瓣膜和生物组织瓣膜。为特定患者选择使用哪种瓣膜通常很困难(Rahimtulla,2003;Head等,2017;Hirji等,2018),尽管从长期来看,在主动脉和二尖瓣位置,机械瓣膜与生物瓣膜的总体并发症率相似(图2.5.2A.2B)。
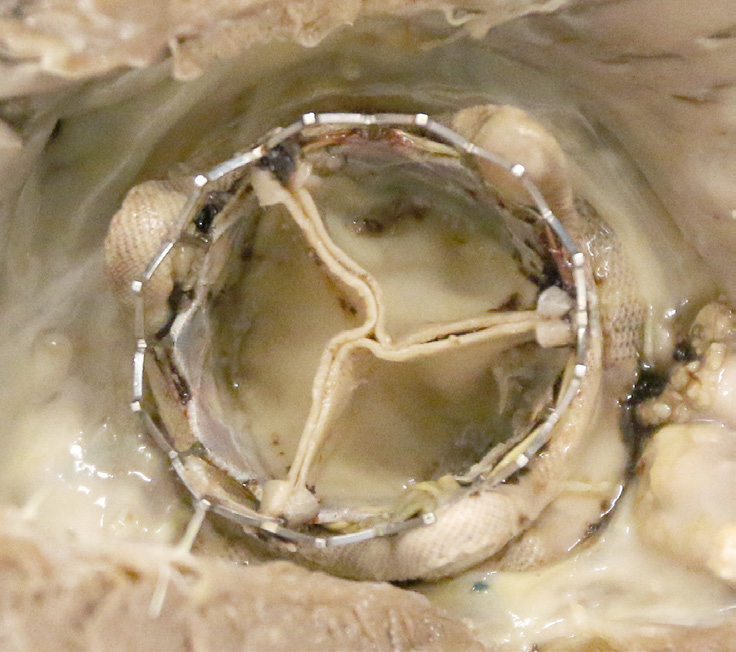
机械性人工心脏瓣膜(图2.5.2A.3)由非生理生物材料构成,采用金属笼架(钴铬或钛合金)中的刚性可移动阻塞器,如比约克‐希尔、霍尔‐美敦力和欧米科学瓣膜,或在碳外壳中使用两个碳半圆盘,如圣犹大医疗(最常用)、卡博梅迪克斯CPHV、医学碳素研究所或On‐X假体。从外观上看,机械瓣膜与天然心脏瓣膜并不相似。目前,所有机械瓣膜的阻塞器均由热解碳制成。热解碳具有高强度、抗疲劳性和耐磨性,以及优异的生物相容性,包括相对抗血栓性。接受机械瓣膜的患者必须终身接受抗凝治疗,以降低血栓形成和血栓栓塞事件的风险。

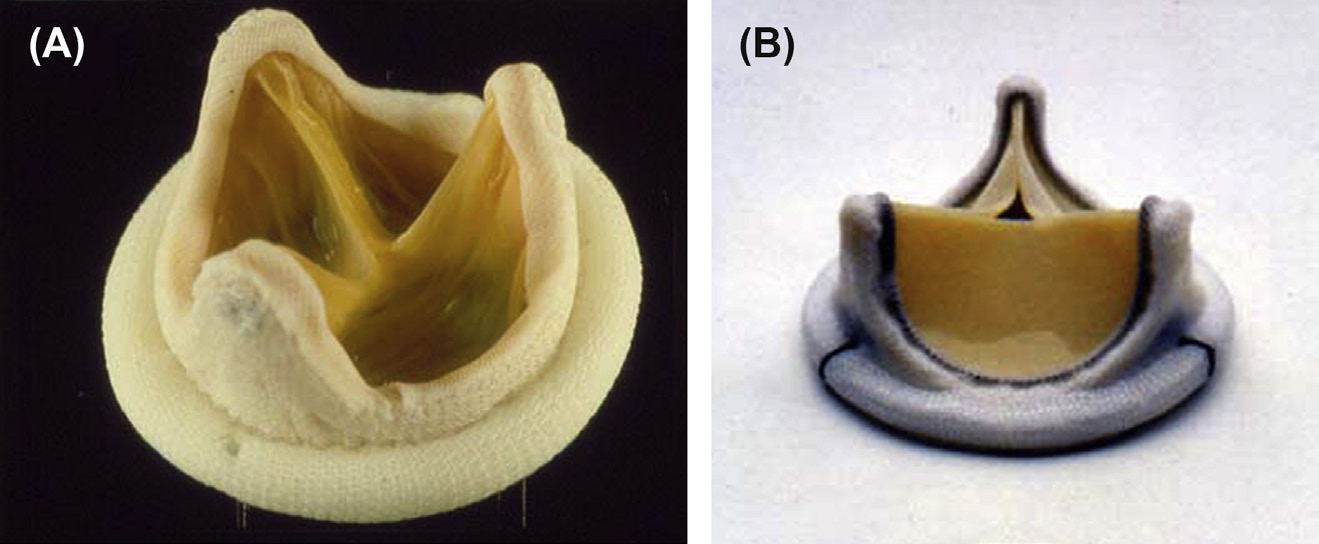
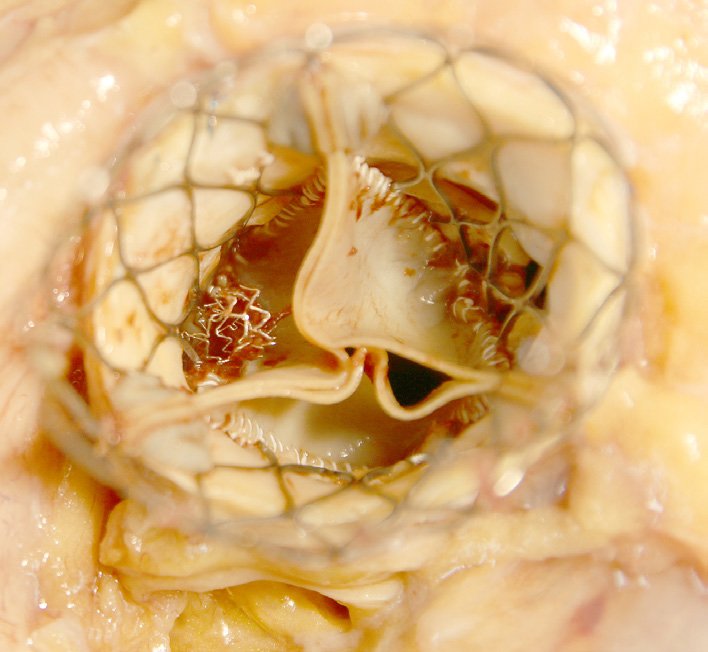
具有三叶式结构和中央孔口的组织瓣膜(图2.5.2A.4)类似于天然瓣膜。“生物假体”描述了一种特殊类型的组织瓣膜,由来自动物的三个小叶组织构成——最常见的是猪主动脉瓣或牛心包——每种组织均经过戊二醛处理。戊二醛固定可保存组织,降低其(原本就相对较低的)免疫反应性,并杀死瓣膜组织内的细胞。这些异种移植物不需要像器官移植(如肾脏、肝脏或心脏)那样进行免疫抑制。然而,由于这些瓣膜不再含有活细胞,其瓣叶本身无法像正常组织那样重塑或对损伤作出反应。人工组织瓣膜瓣叶通常安装在带有三个支柱(或支撑杆)的金属或塑料支架上,以模拟天然半月瓣的几何结构。与机械瓣膜一样,基底环被涤纶或聚四氟乙烯覆盖的缝合环包裹,以方便外科手术植入和愈合。目前使用最广泛的瓣膜类型是卡彭捷‐爱德华心包瓣。

偶尔也会使用来自人尸体主动脉或肺动脉瓣的组织瓣膜,无论是否带有相关血管管道(称为同种异体移植物或同基因移植物)。这些瓣膜具有良好的血流动力学特征,在无需长期抗凝治疗的情况下血栓栓塞并发症发生率较低,并且因心内膜炎行瓣膜置换术后再感染率较低(奥布莱恩等人,2001年)。数十年前,当开始使用瓣膜同种异体移植物时,它们通过化学方法或辐射进行灭菌和/或保存;此类瓣膜瓣叶钙化和破裂的发生率较高。随后的技术发展导致了目前的做法——采用冷冻保存而非化学保存的同种异体移植物。冷冻过程中使用二甲基亚砜防止冰晶形成。随后将瓣膜储存于−196°C的液氮中直至使用。现代同种异体瓣膜在防止退化和组织失效方面的效果等于或优于传统的猪生物假体瓣膜,但其应用受到可用性、获得合适尺寸的困难以及植入术所需更复杂的外科手术的限制。
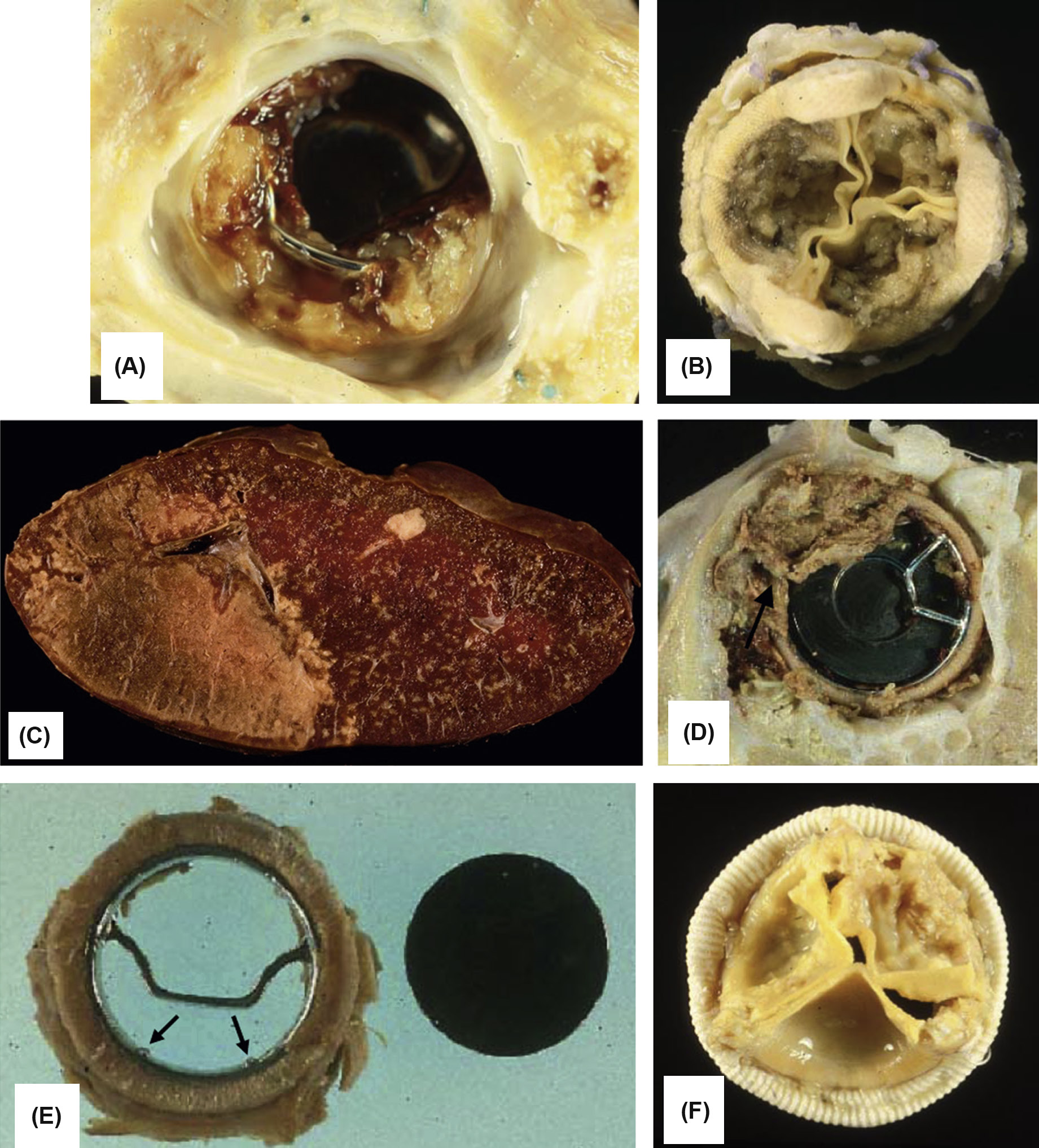
瓣膜假体的可靠性及其与宿主和局部组织的相互作用在患者预后中起着重要作用。四类瓣膜相关并发症在限制治疗成功方面最为重要(图2.5.2A.5):血栓形成和血栓栓塞、感染、结构性功能障碍(即构成假体的生物材料发生失效或退化),以及非结构性功能障碍(即不属于前述类别的其他并发症和失效模式)。与机械假体相比,组织瓣膜的主要优势在于其类解剖中心血流和相对较低的血栓形成倾向(见下文);因此,除非患者存在心房颤动(AF)或其他特定的瓣膜血栓形成倾向,通常不需要抗凝治疗。
血栓栓塞并发症是机械瓣膜心脏瓣膜置换术后死亡率和发病率的主要病因。目前尚无任何合成材料或修饰的生物表面能像正常的未受扰动内皮一样具有抗血栓(抗血栓)性能。与整个心血管系统类似,维尔肖三联征(表面血栓原性、高凝状态和局部静态血流)在很大程度上可预测装置发生血栓形成的倾向以及心血管假体上血栓沉积的位置(贝内特等人,2009年)。血液接触人工表面可能引发血栓形成、栓塞,以及血小板和血浆凝血因子的消耗,同时激活的凝血、补体产物和血小板的全身效应。因此,接受机械性心脏瓣膜替代的患者需要终身使用华法林衍生物进行抗凝治疗,这会带来出血风险,可能很严重,在某些情况下甚至致命(Vahanian, 2008)。在瓣膜假体上形成的血栓沉积物可导致阻塞器固定不动,或脱落形成栓子进入远端动脉床(图2.5.2A.5A–C)。
人工瓣膜感染(心内膜炎)发生在3%–6%的人工瓣膜受体中(图2.5.2A.5D)。当心内膜炎是最初进行瓣膜置换的原因时,其风险显著增加。生物假体和机械瓣膜的感染率相似。然而,由于机械瓣膜的生物材料本身无法被感染,因此机械瓣膜上的心内膜炎局限于缝环处的假体/组织交界区,并伴有该区域的组织破坏(Piper等,2001年)。尽管生物假体瓣膜心内膜炎也可能局限于宿主组织/假体交界处,但生物组织(即使经过化学固定)仍可支持细菌和其他微生物的生长,因此在某些情况下小叶也会受累。最常见的感染入口包括通过牙科手术的口腔、泌尿系统感染和干预措施以及留置导管;这些均会破坏天然的黏膜或皮肤屏障,可能导致病原体进入血液。人工瓣膜心内膜炎可发生在早期(术后不到60天)或晚期(可能在数年后)。早期人工瓣膜心内膜炎的微生物病因主要为葡萄球菌属,包括表皮葡萄球菌和金黄色葡萄球菌,尽管植入术时常规使用的预防性抗生素方案正是针对这些微生物。早期人工瓣膜心内膜炎的临床过程往往呈暴发性。晚期人工瓣膜心内膜炎最常见的致病菌包括表皮葡萄球菌、金黄色葡萄球菌、草绿色链球菌和肠球菌。单纯使用抗生素很难根除人工瓣膜心内膜炎,因此通常需要外科再次手术干预。
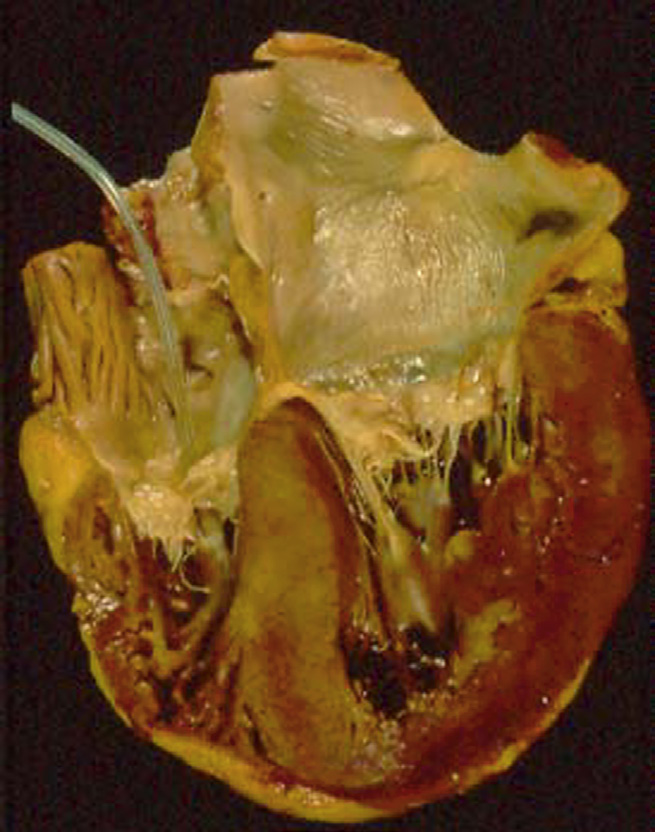
由于材料退化导致的人工瓣膜功能障碍可能需要再次手术,或引起与假体相关的死亡。许多瓣膜型号因耐久性差而退出临床使用。机械瓣膜和生物假体的耐久性考虑差异很大,具体取决于各自的类型、采用不同材料或具有不同设计特征的特定假体型号,甚至同一型号假体在主动脉位置与二尖瓣位置的应用也有所不同。机械瓣膜假体的金属或碳部件发生断裂通常后果严重,但幸运的是较为罕见(图2.5.2A.5E)。目前使用的单叶或双叶倾斜盘瓣膜,其阻塞器采用热解碳制成,支撑杆为金属材质或阀壳为碳外壳,总体具有良好的耐久性。过去因设计缺损导致的断裂问题在两类瓣膜中尤为值得注意。其中一种情况是,比约克‐希尔单叶倾斜盘瓣膜曾被重新设计,旨在改善盘片开启并缓解了原始且广泛应用的型号所出现的梗阻和血栓栓塞并发症。由此产生的比约克‐希尔60度和70度凸凹倾斜圆盘瓣膜出现了焊接的金属出口支柱断裂并从瓣膜上分离的问题,导致导致频繁发生的致命性碟片脱出(布洛特等,2005;哈里森等,2013)。该型号超过80,000个瓣膜被植入,其中至少600个以这种方式发生断裂。根本问题在于瓣膜碟片以更高的速度和力量关闭所产生的意外后果,导致过度旋转以及与金属出口支柱发生过于剧烈的碰撞。当出口支柱应力超过其疲劳极限时,便会发生疲劳断裂,最常发生在将该支柱锚定至阀壳的焊缝区域。在另一案例中,植入的爱德华兹(原赫梅克斯)‐杜洛梅迪克斯双叶倾斜圆盘瓣膜中的碳质瓣膜部件(半圆盘或阀壳)发生断裂。此类瓣膜中至少有46个以这种方式失效(马斯托罗贝托等,2000)。对这些explants的研究表明,瓣膜断裂伴瓣叶脱出是由以下五个因素的不同组合所致:(1)瓣叶热解碳涂层中的微孔隙;(2)功能过程中空化气泡对碳表面的冲击;(3)异常的尺寸公差组合;(4)某些患者环状组织吸震性能差(可能由于钙化引起的僵硬);以及(5)制造或手术操作不当引起的瓣膜假体结构缺陷。其他碳质双叶倾斜圆盘瓣膜(如圣犹大医疗瓣膜)中碳质部件的断裂则极为罕见。

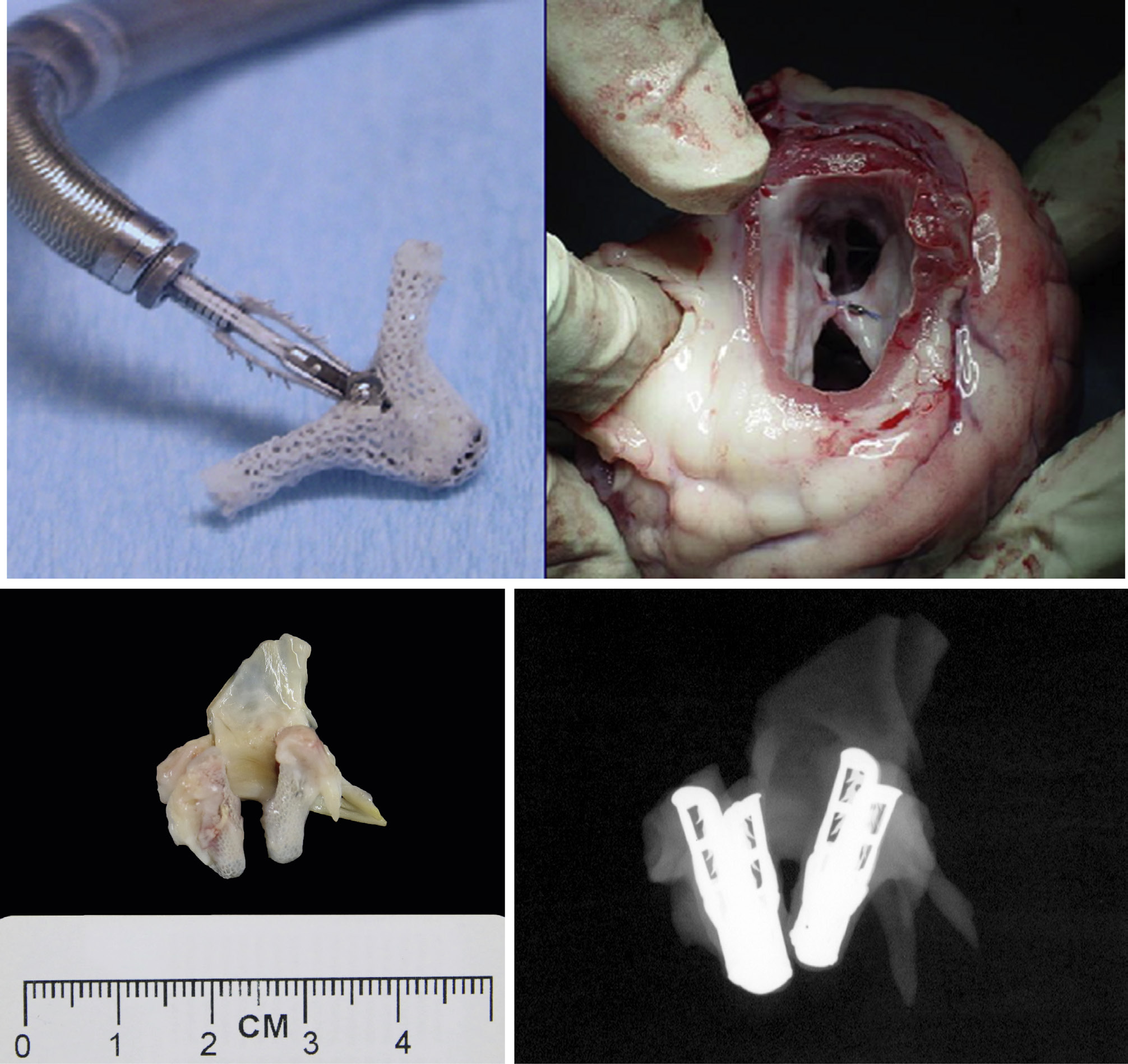
相比之下,伴有功能障碍的结构性瓣膜失效较为常见,是目前最广泛使用的生物假体发生失效的主要病因(图2.5.2A.5F)。生物假体瓣膜的结构性组织失效通常导致进行性症状恶化,需要再次手术(肖恩和利维,2005年)。在植入后15年内,作为二尖瓣或主动脉瓣置换植入的猪主动脉瓣中有30%–50%因原发性组织失效而需要更换(图2.5.2A.6)。瓣叶钙化(见第2.4.5章)是主要的病理机制,而反流通过撕裂处是最常见的猪瓣膜失效模式。目前更常使用的牛心包瓣膜也存在与设计相关的撕裂和/或钙化问题。钙化在年轻患者中明显加速,儿童和青少年尤其表现为加速进程(萨利布等,2014年)。
在导致非结构性失效的并发症中,有一类与假体在植入部位的愈合有关,即愈合不足或过度。愈合不良可引起瓣周漏,当瓣膜关闭时,血液通常通过假体与宿主组织交界处相对较小的缺损发生逆向血流。瓣周漏可能无明显临床意义,也可能因高剪切应力导致血液高速通过狭小空间,从而对细胞膜产生机械破坏,引发溶血(即红细胞破坏),或因反流而导致心力衰竭。相反,过度愈合称为组织过度生长(或肉芽组织),可阻碍闭合件运动或导致继发性血栓形成。
目前正在临床前研究和临床研究及实施中对瓣膜假体进行各种渐进式改进。例如,为防止生物瓣膜钙化的方法正在被积极研究,其中一些方法已在临床上使用。早期数据增强了人们的信心,认为这些方法可能延长了人工瓣膜的耐用性。生物瓣膜的使用寿命延长导致其使用量显著回升。因此,正如整体心脏瓣膜置换行业数据所反映的那样,组织瓣技术与设计方面的创新在过去十年中推动了该市场领域的不成比例增长,扩大了组织瓣膜的应用指征,并可能提高了其耐久性。因此,植入的组织瓣膜占总瓣膜的比例呈现出上升趋势。组织瓣膜的使用持续扩大,研究估计,在一些国家,组织瓣膜目前已占所有替代心脏瓣膜的80%(莫尔,2014;艾萨克斯等,2015;戈德斯通等,2017)。与机械瓣膜相比,生物假体使用量增加的趋势在老年受体中尤为明显,因为这些患者的钙化失效发生率通常较低,而抗凝治疗则会增加严重出血的风险。
所谓无缝线瓣膜的出现使得采用更微创的外科方法治疗主动脉瓣疾病成为可能,从而实现了更快的植入(Zannis等,2012)。手术包括切除病变的主动脉瓣瓣叶,并植入无缝线瓣膜装置。尽管这些瓣膜是通过外科手术植入的,但它们采用了后续将讨论的经皮导管瓣膜的一些设计特征。3f Enable瓣膜(Medtronic, Inc.,明尼阿波利斯,明尼苏达州)由三片相等的马心包组织构成,安装在自膨式镍钛诺支架上,其流入面带有聚酯法兰,以防止移位并减少瓣周漏。Perceval S瓣膜(LivaNova,伦敦,英国)则在镍钛合金支架内安装有牛心包瓣叶。该支架由近端和远端节段组成,并配有连接元件,用于支撑瓣叶并实现与主动脉根部的锚定。这两种瓣膜在临床应用中对特定患者人群均显示出良好的前景(Chauvette等,2018;Fuzellier等,2016)。
其他改进瓣膜的方法包括改良生物瓣膜支架设计和组织安装技术以降低瓣叶应力,改进或替代传统戊二醛预处理的组织处理方法以提高耐久性和植入后生物相容性,以及采用轻度交联自体心包瓣膜。采用三个柔性合成聚合物瓣叶、具有近似天然主动脉瓣解剖结构的近解剖学结构中心血流三叶瓣假体,可能得益于聚合物材料技术的重大进展,尤其是热塑性聚氨酯(Bezuidenhout等,2015)。尽管聚合物瓣膜已用于心脏辅助装置的临床应用(Leat和Fisher,1993),但在原位柔性聚合物瓣膜置换中,耐久性限制仍是主要关注问题,临床前瓣膜失效通常表现为血栓形成、撕裂和/或瓣叶钙化(Fishbein等,1975;Claiborne等,2012)。无缝线瓣膜在微创和传统主动脉瓣手术中提供了缩短主动脉阻断时间并最大化有效瓣口面积的机会。其性能和安全性已在长达5年的时间内得到验证(Meuris等,2015;Di Eusanio和Phan,2015)。
科技进步推动了活体瓣膜置换的发展目标,旨在避免传统瓣膜置换的并发症,适应受体体内变化的环境条件,并可能随患者生长而生长(Schoen,2011;Rippel等,2012;Bouten等,2012;Emmert等,2014)。组织工程(活体)瓣膜置换的长期成功将取决于其可存活的细胞成分(特别是瓣膜间质细胞)能否实现正常功能,具备修复结构损伤、重塑细胞外基质的能力,并在生长中的患者体内潜在地生长。转化挑战巨大(拉布金等,2002;Stassen等,2017;Zhang等,2019)。
从自体细胞(血管壁细胞或骨髓来源的间充质干细胞)接种于可生物降解的合成聚合物(例如涂有聚‐4‐羟基丁酸的聚乙醇酸网)上,在体外培养生成的组织工程心脏瓣膜作为带瓣导管,在生长中的羔羊肺循环中已实现长达5个月的功能(霍尔斯特鲁普等,2000;拉布金等,2002)。在一些研究中,这些移植物在体内逐渐演变为具有类似天然半月瓣结构的特化分层结构。由血管壁细胞和可生物降解聚合物并植入非常年轻的羔羊,在2年期间随整体动物生长按比例增大(霍尔斯特鲁普等,2006)。新兴的生物材料技术可能推动创新的心脏瓣膜组织方法,包括3D生物打印、多层生物材料、金属网支架和脱细胞瓣膜(张等,2015;吕德斯等,2014;张等,2015;阿拉维和赫拉德瓦尔,2015;马苏米等,2014)。
为了消除对体外细胞接种与培养步骤的需求,一种替代的组织工程技术采用了脱细胞天然衍生生物材料(如动物异种移植物或人同种异体瓣膜、脱细胞绵羊肠黏膜下层)的支架,或在未预先接种细胞的情况下植入多孔聚合物基质,旨在利用内在循环细胞来定植并潜在地重塑支架(马森尼等,2000;加赞法里等,2015;博鲁曼德等,2018)。组织来源的支架必须具备理想的三维结构、机械性能以及有利于细胞附着与长入的黏附/移位位点。然而,在人体中植入的脱细胞猪瓣膜引发了强烈的炎症反应,并出现结构性失效(西蒙等,2003)。目前也在开展针对经导管植入的接种细胞的工程化组织瓣膜的研究(德里斯森‐莫尔等,2014)。
经皮导管瓣膜及其他器械
生物假体和机械瓣膜的外科植入术(前文已讨论)具有长期且经过验证的成功记录,可改善症状和生活质量,并提高存活率。然而,总体估计有30%–40%的主动脉瓣狭窄患者由于高龄、虚弱以及常伴有多种合并症,被认为不适合接受外科主动脉瓣置换术(戈德巴格等,2007)。然而,过去数十年中一项极为重要的进展是出现了一种微创的常规主动脉瓣置换术替代方案,称为经导管主动脉瓣植入术(TAVI),该技术于2002年首次应用于临床,使原本无法治疗的大批患者获得了有效机械矫正瓣膜疾病的机会(罗德斯‐卡保,2012;热内鲁等,2012;哈姆等,2016)。因此,TAVI及其相关新型瓣膜置换装置已迅速成为许多原本被视为无法手术患者(尤其是老年患者)的新治疗标准。
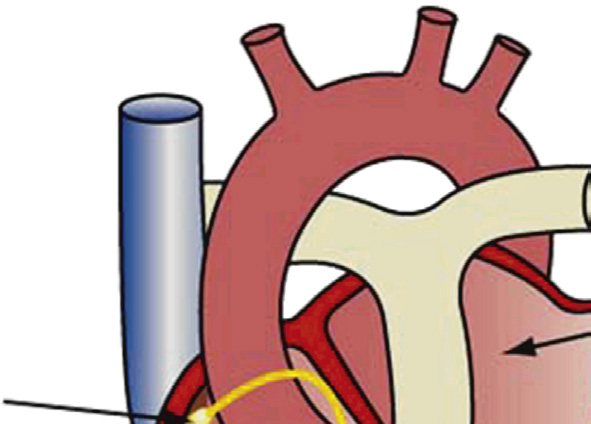
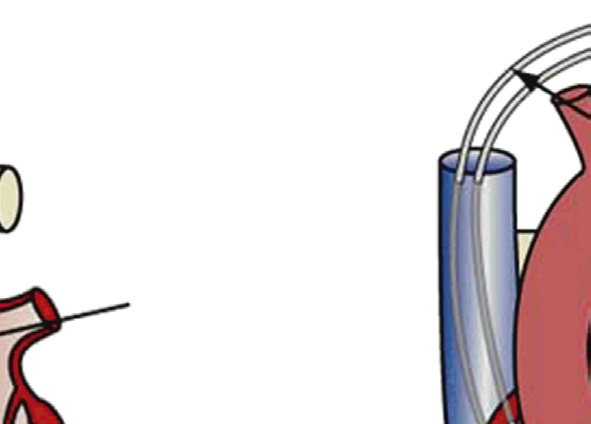
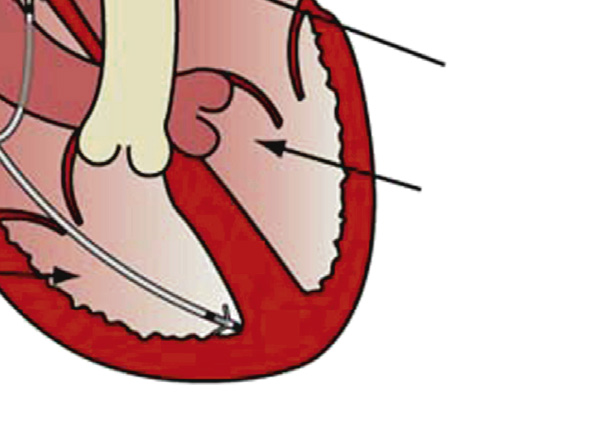
与传统开放性外科手术治疗心脏瓣膜病不同,导管式瓣膜植入术通过导管经股动脉逆行进入主动脉,到达主动脉瓣,在此处释放一种新型瓣膜装置(即扩张);因此该手术无需打开胸腔。alternatively,也可通过顺行且微创的外科方法将装置植入心脏,该方法需暴露心尖左心室(称为transapical implantation)。对于股动脉和主动脉存在严重动脉粥样硬化病变的患者,导管在通过这些部位时可能搅动斑块导致栓子脱落,因此更倾向于采用这种入路。输送策略包括将装置压缩并置入导管式鞘管中;对于球囊扩张型装置,必须将其压缩在球囊上。在主动脉瓣狭窄的情况下,瓣膜装置被植入至钙化主动脉瓣的小叶之间,将病变的小叶推离血流通道(即与之相对的是)开胸手术,经导管主动脉瓣植入术期间不切除病变的瓣膜组织—图2.5.2A.7B。在经导管主动脉瓣植入术期间,输送、定位和在最佳位置的永久固定对于手术成功至关重要,通常需要结合多种外部成像方式来引导。
经导管主动脉瓣植入术的临床经验正在迅速积累;自2002年首次临床植入以来,全球已实施了约300,000+例经导管主动脉瓣植入术。来自不同国家的随机和观察性临床试验,包括观察性研究以及随机试验,已将经导管主动脉瓣植入术与传统主动脉瓣置换术进行了比较(史密斯等人,2011年;科达利等人,2012年;金等人,2014年)。这些研究的共识是,在高风险患者中,经导管主动脉瓣植入术在手术“成功”方面至少在术后2年内在发病率和死亡率方面不劣于传统主动脉瓣置换术(泰斯等人,2014年;里亚登等人,2015年)。经导管主动脉瓣植入术与外科瓣膜置换术在血流动力学上具有可比性。最近的数据表明,对于中等或较低手术风险的患者,经导管主动脉瓣植入术也可能是开胸手术的极佳替代方案(里亚登等人,2017年;麦克试验组,2019年;波普马等人,2019年)。
经导管瓣膜植入术所用器械具有外层支架样结构,内部包含瓣叶。该支架可撑开瓣环,抵抗球囊扩张后瓣环或病变的天然瓣叶回缩的趋势,支撑瓣叶,并提供假体在瓣环内固定的方法。用于瓣膜部件的组织包括牛心包、马心包、猪心包以及牛颈静脉瓣膜。支架由自膨胀不锈钢、铂铱合金或其他合金,或形状记忆材料(如镍钛合金,例如镍钛诺)制成。
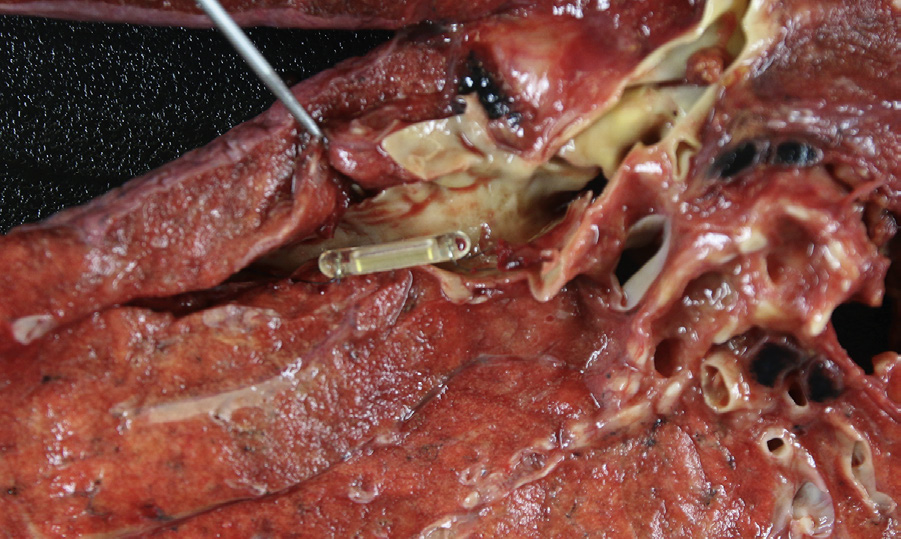
目前,多种导管式装置正处于主动脉和肺动脉位置的不同开发阶段和临床应用阶段。经导管主动脉瓣中临床经验最丰富的两种装置是爱德华‐萨皮恩系列装置(爱德华生命科学公司)和科瑞瓦尔夫 ReValving系统(美敦力公司)。萨皮恩装置由球囊可扩张不锈钢支架构成,内含一个牛心包三叶瓣(图2.5.2A.7A和B)。支架周围附有聚合物裙边,以减少瓣周漏。科瑞瓦尔夫装置由自膨胀镍钛诺支架构成,内含一个猪心包三叶瓣(图2.5.2A.7C和D)。对于因先天性心脏病缺损矫正而植入右心室至肺动脉连接装置后发生功能障碍的儿童,可使用美敦力 Melody经导管肺动脉瓣,该装置由球囊可扩张的铂铱合金支架构成,内含带天然静脉瓣的一段牛颈静脉,通过股静脉穿入下腔静脉并穿过心脏右侧进行输送(图2.5.2A.7E)(Lurz等,2009年)。导管式瓣膜还可用于治疗因狭窄或反流导致失效的外科植入生物瓣膜,即所谓的“瓣中瓣”应用,将新的人工瓣膜直接置入原有瓣膜内部(图2.5.2A.7F)。

经导管瓣膜植入术带来了新的挑战(Fishbein等,2014)。带瓣支架明显大于大多数现有的经皮心脏导管和器械,因此血管通路困难,导管通过路径可能发生损伤,且存在导致栓子脱落的重大风险。在主动脉位置,可能会影响冠状动脉血流,或干扰二尖瓣前叶活动、传导系统或原有的病变小叶。支架结构还可能妨碍未来通过导管对冠状动脉进行干预的通路。在主动脉瓣环或肺动脉通道内稳固固定,以及支架和瓣膜组织的长期耐久性,也是主要挑战。外科手术并发症最常见的是瓣周漏、伴有出血的血管损伤和栓塞性卒中(Fassa等,2013;Van Mieghem等,2015)。经导管心脏瓣膜也可能出现与外科生物假体类似的假体相关失效模式,以及与其特定设计相关的独特失效模式;人工瓣膜心内膜炎(Mylotte等,2015;Neraqi‐Miandoab等,2015;Amat‐Santos等,2015)以及由于瓣叶钙化和血栓形成导致的结构性瓣膜失效是最常见的并发症。随着经导管技术应用不断扩大,一个关键的未知因素是假体的耐久性。
许多二尖瓣疾病患者也需要创伤较小的经导管治疗。首例针对自体瓣膜的经导管二尖瓣置换术(TMVR)于2012年完成。然而,由于二尖瓣解剖结构及其与邻近结构关系的复杂性和变异性,该新疗法的发展进度较慢,相比之下,经导管主动脉瓣植入术的临床应用则迅速得多(Patel和Bapat,2017;Wyler von Ballmoos等,2018)。TMVR可用于退化的假体瓣膜和成形环,也可用于多种原发性二尖瓣疾病。对于退化的生物瓣膜、成形环以及原生瓣膜合并二尖瓣环钙化的情况,可使用为主动脉位置设计的经导管心脏瓣膜进行植入,手术安全性和成功率较高。而对于原生瓣膜二尖瓣反流的情况,其复杂性已促使多种针对原发性瓣膜疾病的TMVR系统被开发出来,这些系统采用了不同的锚定机制和几何结构;目前这些系统均处于研究阶段,尚无任何获得美国食品药品监督管理局(FDA)批准的产品。已有研究采用类似于TAVI所用装置开展经皮二尖瓣置换术(Webb等,2019)。
目前正在开发或临床使用的其他经皮装置可用于治疗二尖瓣反流。MitraClip装置(雅培实验室,伊利诺伊州艾伯特公园)是一种经导管输送装置,通过以缘对缘方式将二尖瓣前叶和后叶固定在一起,从而减少二尖瓣反流(Panaich和Eleid,2018)。该装置于2013年获得美国食品药品监督管理局批准,由聚酯覆盖的植入物组成,包含两个钴‐铬金属臂,可开合以夹住二尖瓣前叶和后叶的边缘(图2.5.2A.8)。当金属臂闭合时,瓣叶被固定在一起,瓣膜口近似形成一个“图2.5.2A.8”形状,具有两个开口,而不是自体瓣膜的单个开口。聚酯材料为大孔隙的,有利于组织向内生长,旨在实现装置的锚定并防止异物材料上的血栓形成。已开展临床研究;最近的一项临床试验MitraClip与药物治疗相比,证明了该装置在因中重度或重度二尖瓣反流导致心力衰竭的患者中的安全性和有效性(Stone等,2018年)。

心律失常
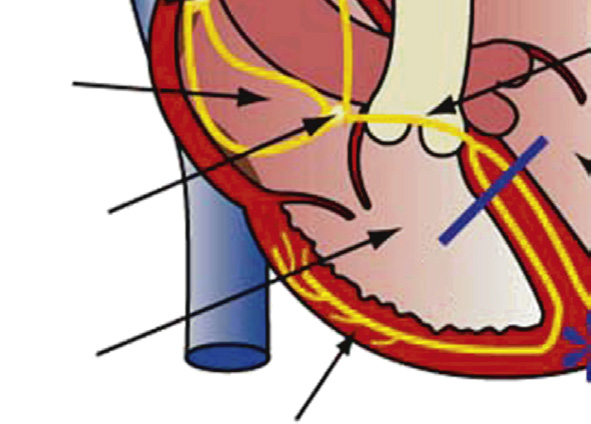
正常心脏电活动周期(图2.5.2A.9A)始于窦房结(SA)产生的冲动,该心脏天然起搏器,位于右心房靠近与上腔静脉连接处。冲动通过左右心房壁的肌肉扩散,引起心肌细胞去极化,导致心房收缩。冲动到达房室结(AV结),房室结位于右心房后部,被冠状窦口、三尖瓣隔瓣和房间隔膜部所包围(称为Koch三角)。在房室结内经过短暂延迟后,冲动传至希氏束,并进入位于室间隔的左右束支。冲动通过右心室和左心室心肌扩散,引起心肌细胞去极化波,从而产生协调的心室收缩。窦房结和房室结以及希氏束及其右束支和左束支由特化为传导功能的心肌细胞组成。
心律失常(Huikuri等,2001年)反映了冲动启动或冲动传导的异常。位于窦房结以外的冲动生成(自律性)细胞的异位起搏点可能引发心脏冲动,导致次优心室收缩。这些心律失常通常较快,即快速性心律失常,可导致心室颤动,可能致命。固有窦房结功能障碍也可能引起冲动启动的紊乱。相反,冲动传导的紊乱主要表现为传导阻滞或折返。传导阻滞是由于疾病过程(如缺血或炎症)或某些药物影响,导致正常冲动在特殊传导组织中无法正常传播所致。阻滞可以是完全性的(无冲动传导)或不完全性的(冲动传导比正常慢),并且可以是永久的或暂时的。当心脏冲动沿心肌纤维环路传导,并在没有来自窦房结的第二次冲动的情况下重新激动先前已兴奋的组织时,称为折返。
对于无法通过抗心律失常药物进行药理控制的心律失常患者,有两种治疗选择:(1)电治疗以控制心律,例如直流电复律或植入式装置,如起搏器和植入式心脏复律除颤器(ICD);(2)介入/手术治疗,以切除病变组织或阻断异常通路,例如心内膜切除术、冷冻消融术或射频消融术(Halbfass等,2018)。
心脏起搏器
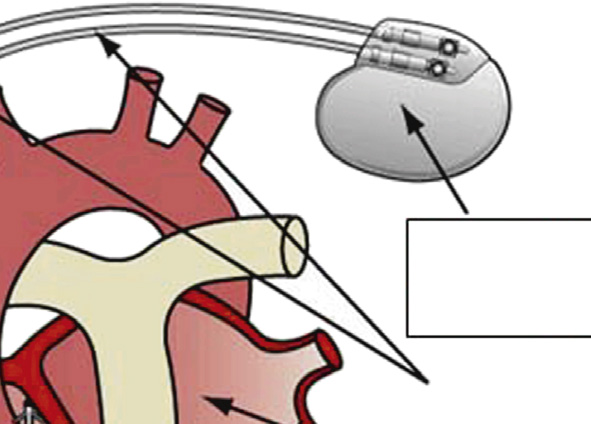
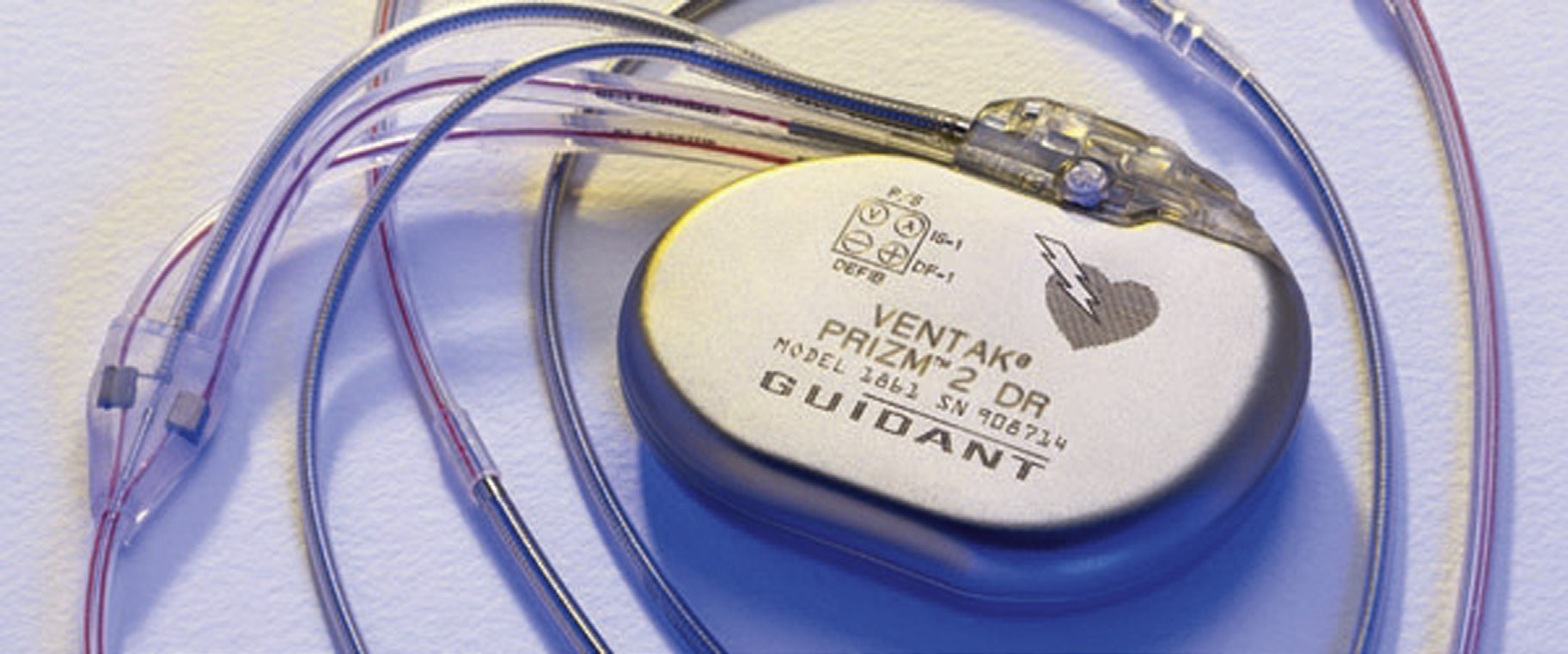
心脏起搏器是向传导系统提供冲动以启动心肌收缩的医疗设备。第一台心脏起搏器于1958年植入,自那时起,心脏起搏已成为一种成熟的治疗工具。与当今设备(9–45 cm³)相比,第一代起搏器体积较大(40–200 cm³),且缺乏当前设备中的许多标准功能。目前美国有超过一百万名患者装有起搏器(图2.5.2A.9B和C),每年新植入的永久性起搏器超过25万台;起搏器植入、调整或取出是一种常见手术操作。大多数心脏起搏器植入于60岁以上患者,但在必要时也用于儿童,包括婴儿。永久性心脏起搏最常见的适应证是各种类型的传导阻滞。某些传导阻滞会导致心动过缓(异常低心率),而另一些主要发生在左束支或右束支的传导阻滞,则会在正常心率情况下引起心室不同步和心室收缩效率降低。这些传导阻滞可导致心输出量减少以及充血性心力衰竭的症状和体征,但可通过心脏起搏得到有效治疗。
现代心脏起搏(库苏莫托和戈德施拉格,2002年),无论是临时的还是永久的,都是通过一套相互连接的组件实现的,包括:(1) 脉冲发生器,包含电源和电路,用于启动电刺激并感知心脏电活动;(2) 一根或多根从脉冲发生器通向心脏的电绝缘导体,每根导体的远端带有双极电极;以及(3) 电极与邻近心肌细胞之间的组织,或血液和组织界面。起搏器通过电极向心肌输送微小电流(2–4 mA),引起去极化和心脏收缩。
临时起搏最常用于伴有心脏传导系统障碍的急性心肌梗死患者,这些障碍可能进展为完全性心脏传导阻滞。临时心脏起搏的导线通常经静脉插入右心室心尖部,脉冲发生器位于体外。在心脏手术过程中,当心外膜已暴露时,可通过将带有裸露末端的绝缘导线放置在心房或心室的心外膜表面实现临时起搏,导线从前胸部穿出胸腔,以便于拔除。最终,临时起搏器将被永久装置替代或停止使用。
永久性心脏起搏需要长期植入脉冲发生器和电极导线。脉冲发生器通常由钛合金制成,放置在左前胸部皮肤下的组织囊袋中,导线经左锁骨下静脉经静脉推进,终止于心脏的心内膜表面。导电元件通常采用MP‐35N(一种由镍、钴、铬和钼组成的合金,具有优异的强度和耐腐蚀性)与银或不锈钢等高导电材料复合而成;这些导线通常外层包覆硅胶和/或聚氨酯作为绝缘材料。电极尖端通常根据起搏模式放置在右心房和/或右心室内。
单腔起搏器根据预设时间间隔发出刺激。该起搏器还能感知固有心脏活动,并可被抑制以避免产生不必要或不适当的刺激。这种“按需”起搏对于问题间歇性出现的患者非常有价值。双腔起搏器在心房和心室均设有电极,可发出顺序心房和心室信号,以接近正常心跳的时间顺序。该装置还能感知心房和心室的固有去极化,并在适当时间发出刺激,以维持心腔之间的适当同步。
患有左束支传导阻滞等心室传导延迟的患者可能会因心室收缩不同步而发生心力衰竭,此时左右心室不能同时收缩。通过双心室起搏进行心脏再同步治疗是一种干预措施,将起搏电极置于右心房、右心室和冠状窦。该冠状窦电极刺激左心室侧壁,使左右心室能够同时兴奋,并使整个左心室的收缩更加均匀。研究表明,心脏再同步治疗可显著改善这些患者的心脏功能(McAlister et al., 2007)。
永久植入式起搏器由碘化锂电池供电,使用寿命有限,为5–8年,当电池耗尽时需要取出并重新植入新设备。事实上,首位于1958年接受植入式起搏器的患者在其一生中总共更换了22个不同的脉冲发生器,直至其于2001年以86岁高龄去世。改进电池技术以实现更长的使用寿命,将减少患者所需的重新植入次数以及这些手术带来的并发症。
电极与可去极化心肌组织之间的界面对于起搏器的正常功能至关重要(图2.5.2A.9D)。通常,由电极引起的不可兴奋的纤维组织层会在电极尖端周围形成,这是不利的,因为它增加了启动心肌细胞去极化所需的阈值起搏刺激强度(图2.5.2A.9E)。减少这种纤维化的策略包括改进导线设计,以及使用缓慢局部释放皮质类固醇以最小化导线植入后形成的纤维组织厚度(Mond和Grenz,2004)。实际要点是,如果在植入后早期阶段脉冲发生器输出未设置得足够高,则可能导致起搏丧失并带来潜在的致命后果。相反,在阈值稳定后仍维持过高的输出水平会显著缩短电池寿命。因此,已开发出具有可调节输出变化的起搏器。
理想的经静脉起搏导线应在植入时即提供稳定的固定,达到并维持最低刺激阈值,最大限度地提高感知能力,并能长期可靠运行。电极在心内膜上的固定可以是主动或被动的。在主动固定中,电极设计用于抓握心内膜表面,以在植入时实现即时固定。增强被动固定的有效方法是在电极尖端区域增加伸出的“小齿”或鳍状结构。另一种改进固定的方法是开发具有多孔金属表面的电极,以促进组织向内生长。当导线植入特定部位时,可能需要特殊设计。一个例子是J形心房导线,其弯曲形状有助于将电极尖端置于右心耳,该位置本身就是最稳定的固定位置。
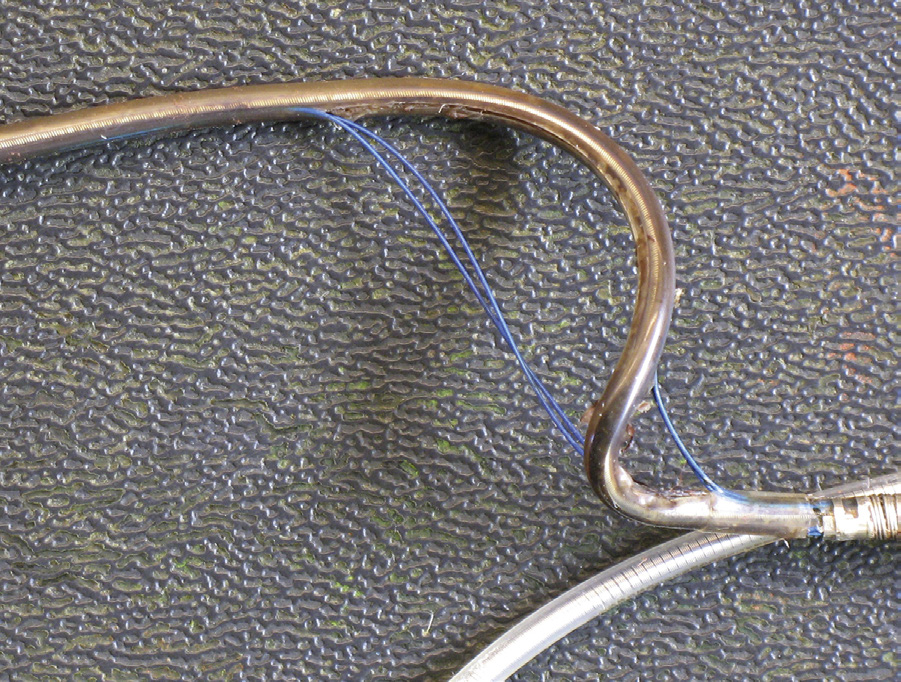
“无导线”起搏器治疗(Della Rocca等,2018)是一种已引入临床实践的新技术,以两种新型器械的形式出现:Nanostim无导线起搏系统(圣犹大医疗)和Micra经导管起搏系统(美敦力公司)。这些器械(图2.5.2A.9F)由一个包含传统单腔起搏器全部功能的胶囊样模块组成,但完全植入于右心室心尖部并通过螺旋线圈或小钩这一主要固定方法附着于室间隔。植入术通过经静脉通路在荧光透视引导下经皮进行;该装置在近端具有设计特征,可在植入过程中回收以实现重新定位,或在日后取出。这些装置旨在提供与传统经静脉起搏器相同的起搏功能,但避免了因大型皮下发生器囊袋以及穿过心腔和瓣膜的长导线所引起的后续并发症。


植入式心律转复除颤器
首台植入式心律转复除颤器(ICD)于1980年植入;目前,美国每年植入超过10万个ICD。ICD的目的是通过重置心脏电活动和刺激正常心律,预防患有某些危及生命的心律失常患者的猝死。多项前瞻性临床试验已证实,ICD能够终止持续性室性心动过速(异常高的心室率)和心室颤动(不协调的电/心肌活动)。在总死亡率方面的获益已有充分记录(抗心律失常药物与植入式除颤器比较(AVID)研究组,1997年)。
经静脉ICD的组成部件与起搏器类似,主要包括脉冲发生器以及用于快速性心律失常检测和治疗的导线。脉冲发生器是一种自供电、独立计算机,内置一个或两个3.2V锂‐银‐五氧化二钒电池,用于为系统的所有组件供电,包括铝电解储能电容器。这些器械的使用寿命为3至5年,到期后需要取出并植入新设备。导线通常通过经静脉途径放置在右心室内。ICD导线通常包含多个同轴导电元件,既能感知电信号,也可输送适当电击,每个导电元件可能涂有聚四氟乙烯等绝缘材料,所有元件均被包裹在硅胶内,并在外层覆盖聚氨酯绝缘层。ICD持续监测心室率,当心室率超过特定值时即提供治疗。当前设备最初会提供短暂的快速心室起搏脉冲,可在不施加高能量电击的情况下终止某些类型的室性心动过速。这种方法可在无需电击的情况下终止高达96%的室性心动过速发作。如果该起搏无法终止心律失常,ICD将在右心室内的电极与脉冲发生器表面之间输送10–30焦耳的电击,以终止心律失常发作。这些设备还会连续记录心律失常事件及治疗结果。对于存在室性心律失常高风险的患者(一级预防)以及已经发生过未致死性猝死事件的患者(二级预防),可考虑使用植入式心脏复律除颤器(ICD)。
与经静脉ICD不同,一种称为皮下植入式心律转复除颤器(S‐ICD)的ICD已被开发并应用于临床,用于检测和终止恶性心律失常(威科克斯等人,2016年)。S‐ICD采用血管外电极导线,大多数情况下将其植入左侧胸骨旁中线稍左的皮下组织内,与胸骨平行。该导线连接至脉冲发生器,脉冲发生器则植入于胸腔左侧腋中线处。导线以类似于体表心电图的方式感知来自心脏电活动的“远场”信号,而电击则由位于心脏上方皮下组织中的脉冲发生器发出,方式类似于体外除颤器。因此,S‐ICD不与心脏和血液直接接触,处于更稳定的机械环境中,有望减少后文所述的一些并发症。
起搏器和植入式心律转复除颤器的并发症
这些器械存在许多相同的并发症,其中许多需要进行器械的取出和更换。与许多心血管设备一样,这些属于维持生命的技术,一旦发生设备故障,可能导致致命后果:起搏器因无法进行适当的心脏起搏,而植入式心脏复律除颤器(ICD)则因无法感知或对致死性心律失常提供适当治疗。虽然由于电池耗尽导致的正常设备使用寿命结束在技术上可能不被视为设备故障,但它确实需要进行设备置换,并且可能因导线‐组织界面处纤维化增加,导致刺激阈值升高而过早发生。
硬件故障(包括电池/电容器和充电电路、连接器以及导线)是最常见的设备故障,而软件问题相对较少。一些机械故障包括电极脱位、导线断裂、电极腐蚀和绝缘失效(图2.5.2A.9G)(蔡特勒等人,2015年)。导线的并发症可能与导线本体有关,不同于导线‐设备包接口或电极部分。近年来,已有多种设备和组件因上述失效模式被召回(阿明和艾伦博根,2010年)。多年来导线的改进包括采用螺旋线圈和多丝设计,以降低电阻并增强柔韧性和耐久性(哈卡尼和蒙德,2009年)。过去曾有许多关于起搏器功能受到干扰的报道,干扰源从家庭使用的电动剃须刀、牙刷和微波炉,到医院中的电外科和理疗设备不等。幸运的是,近期几代心脏起搏器在抗电磁干扰能力方面已得到显著提升。
许多并发症与设备生物材料和宿主组织的相互作用有关。这些包括感染、血栓形成和血栓栓塞、心肌穿透或穿孔、脉冲发生器上方皮肤的压迫性坏死,以及脉冲发生器的移位或旋转。感染是植入式装置普遍令人担忧的并发症,这当然也适用于起搏器和植入式心脏复律除颤器(ICD)(Joy等,2017)。感染可能起源于皮下囊袋,并沿电极导线扩散,该导线作为被污染的异物。或者,也可能因细菌在受损的心内膜或与导线相邻的血栓上定植而发生。引起这些感染最常见的致病菌是凝固酶阴性葡萄球菌,例如表皮葡萄球菌。可能发生败血症和脓毒性肺栓子。装置相关性心内膜炎的根本治疗原则是使用抗生素控制感染,随后至少取出导线,当起搏器囊袋受累时,则需移除整个起搏系统(Baddour等,2010)。
植入式心脏复律除颤器(ICD)比起搏器包含更复杂的硬件,这可能导致并发症的发生率相对增加。针对植入式心脏复律除颤器(ICD)还有一些特殊的考虑因素。反复进行除颤可能产生以下影响:(1)反复放电对心肌和血管结构的直接作用;(2)留置血管内电极可能具有促血栓形成的作用。对于患者而言,植入式心脏复律除颤器(ICD)另一个主要的并发症,除了无法感知或终止心律失常而导致猝死外,就是不适当的电击。除了在电击时令人惊吓且相当疼痛外,接受多次不适当电击的患者还可能出现创伤后应激障碍症状。
如前所述,导线的设计旨在优化其与邻近心肌的相互作用;但当出现需要移除导线的并发症时,这可能带来问题。一些导线可通过持续轻柔牵引移除,但许多导线需要借助额外工具和技术,以将其从导线本体穿行的静脉壁以及常牢固粘附的组织中松解出来(Krainski et al., 2018)。如果导线被致密的纤维组织牢牢包裹,可能需要采用体外循环下的心脏切开术。
充血性心力衰竭
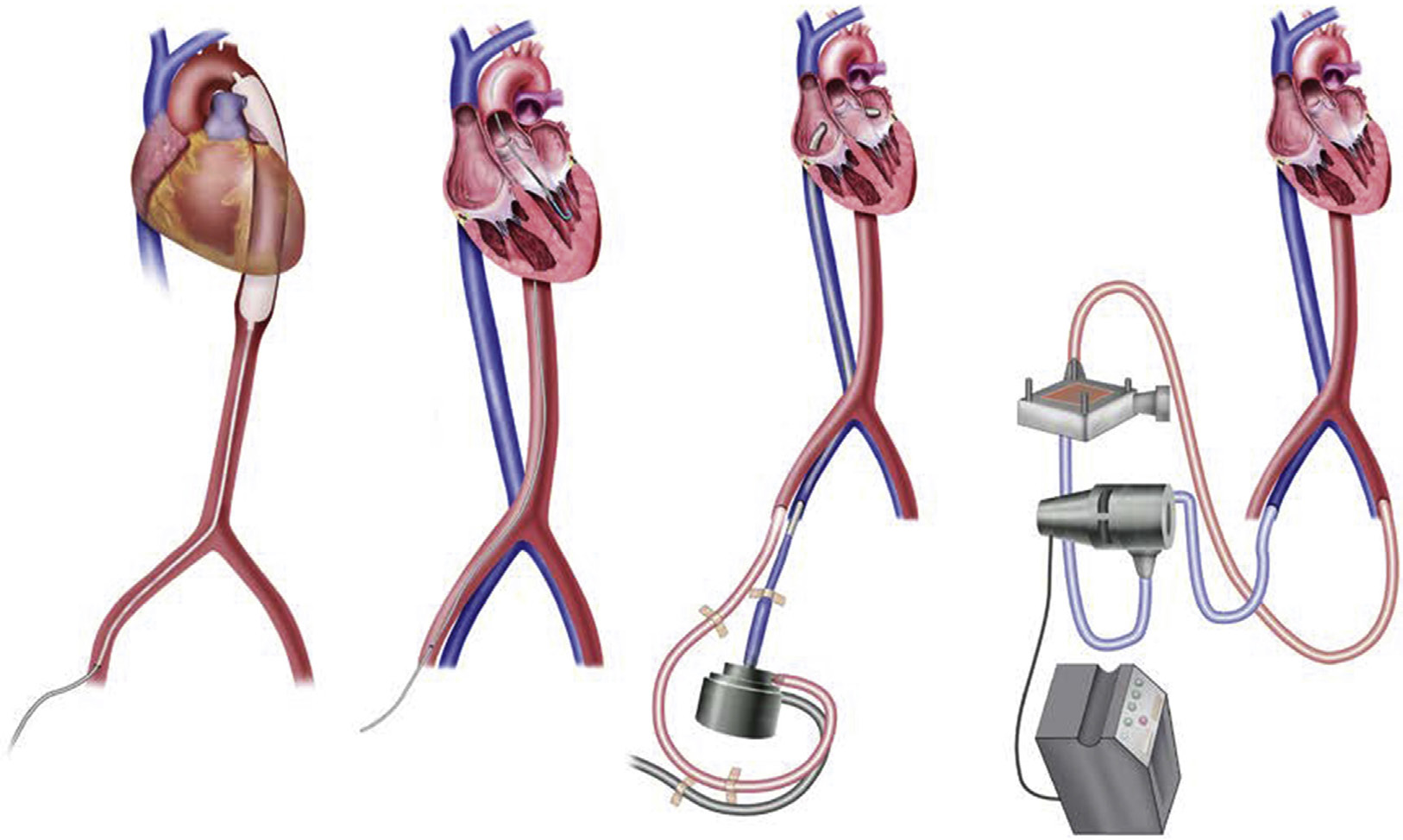
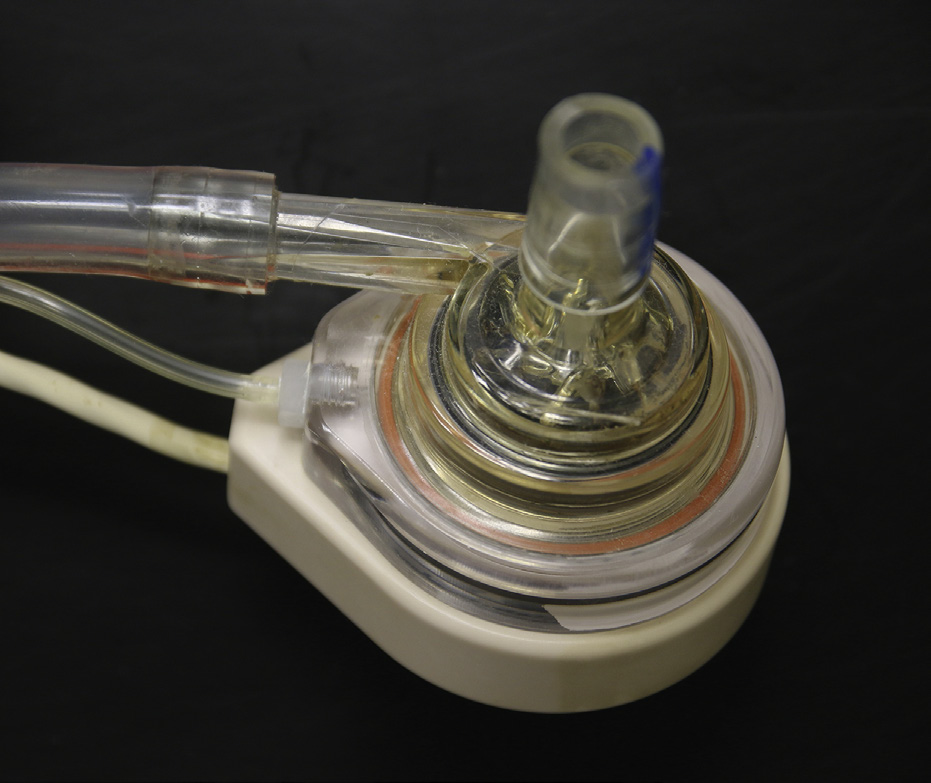
充血性心力衰竭(Jessup和Brozena,2003)是心脏泵功能的缺陷,是一种极为常见的病症,影响约6.2百万美国居民。每年在美国,充血性心力衰竭是6万名个体死亡的主要病因,超过28万例死亡的促成因素,并且是超过110万例住院患者的主要出院诊断,均较往年有所增加。心脏移植是部分此类患者的潜在解决方案(Mancini和Lietz,2010)。然而,合适的供体心脏数量(每年仅2500个)与可能从心脏移植中获益的患者数量(估计每年超过10万人)之间的差距日益增大,这促使人们致力于开发机械装置以增强或替代心脏功能(Baughman和Jarcho,2007;Boilson等,2010;Krishnamani等,2010)。
充血性心力衰竭是许多特定心脏疾病的最终共同通路,包括瓣膜性心脏病、伴有继发性缺血性心脏病的冠状动脉粥样硬化以及直接累及心肌的疾病(称为心肌病)。心力衰竭可突然发生,如心肌梗死或病毒性心肌炎;也可表现为数月或数年内心肌持续恶化导致的运动耐量逐渐下降和呼吸困难。它可在心脏手术(例如瓣膜置换、心脏移植)和非心脏手术(例如腹主动脉瘤修复术




















 50
50

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








