聚噻吩纳米颗粒中中性药物的电刺激释放:药物‐聚合物相互作用的智能调控
引言
电活性导电聚合物(ECPs)能够对电刺激实现优异的控制,具有良好的电学和光学性质,具备高电导率/重量比,并且可以是生物相容的、可生物降解的和多孔的。[1]此外,ECPs的一个巨大优势在于,通过引入生物聚合物、肽或其他相关基团,其性能可根据特定应用需求进行定制。[2]
另一方面,生物医学装置中药物分子的按需释放可实现精确的靶向给药,并能根据多种生物医学应用的需求进行时间上可调节的控制。[3,4]近年来的技术进步推动了利用不同刺激(如光、磁场和电场、超声波以及电化学信号)来触发智能材料配方(例如薄膜、微米和纳米粒子以及植入装置)中的药物释放。[4,5]这些技术与无法根据治疗需求变化进行调整的传统系统(例如基于聚合物的生物降解性的系统)相比,能够实现对药物递送更精确的控制。
电响应药物递送系统在这方面尤其具有吸引力,因为电信号相对容易产生,可精确控制,并且无需使用大型、专用和复杂的设备即可远程施加。此外,还有可能开发出允许重复给药的药物递送系统。特别是,近期的体内试验已证明导电聚合物纳米颗粒(NPs)是成功的电响应药物递送系统。[6,7]因此,施加一个微弱的外部电场以这些系统通过注射器注射在目标部位实现皮下定位,使药物从纳米颗粒中释放,从而扩散到周围环境中。
目前,已存在多种将药物掺入导电聚合物基质以实现后续释放的方法,这表明这些有机材料是可控药物递送的潜在平台。例如,通过掺杂结合在导电聚合物薄膜中的分子,可通过施加还原电势实现可控释放。此外,由于导电聚合物具有多孔结构并含有离域载流子,有助于结合分子的扩散,这进一步说明了导电聚合物非常适用于药物释放应用。然而,基于导电聚合物薄膜的制剂(最为常见)存在载药量低的主要缺点。尽管通过增加薄膜厚度可负载更多药物,但大部分释放发生在表面,而体相中的药物分子则难以释放。与薄膜相比,导电聚合物纳米颗粒具有更高的表面积体积比,从而实现更高的药物负载。尽管尺寸较小,导电聚合物纳米颗粒仍具有电学和电化学响应性,这对于设计可控和可编程药物递送系统具有显著优势。考虑到广泛的应用前景,导电聚合物纳米颗粒无疑将在需要化学物质程序化递送的所有科学领域(包括生物医学领域)中发挥决定性作用。
在一些近期但仍然稀少的研究中,聚吡咯(PPy)纳米颗粒被用于研究,聚吡咯(PPy)可能是最受关注的无毒导电聚合物[13]聚(3,4‐乙烯二氧噻吩)(PEDOT)纳米颗粒通过原位乳液聚合方法负载姜黄素和胡椒碱,其中十二烷基苯磺酸同时作为稳定剂和掺杂剂。所负载的药物影响纳米颗粒的形貌、尺寸和胶体稳定性。此外,非刺激性药物释放的动力学研究表明,姜黄素的聚合物···药物相互作用强于胡椒碱。该观察结果表明,基于姜黄素与PEDOT结合的药物递送系统更适合实现外部定制释放曲线。通过比较在有无电刺激条件下获得的释放轮廓,验证了这一结论。结果表明,在生理环境中对负载的PEDOT纳米颗粒施加−1.25 V的负电压,可实现姜黄素的可控且时间编程的药物释放。
已被用于触发敏感的、剂量可控的药物释放。[6,14,15]更具体而言,通过体内实验验证了嵌入水凝胶中的PPy纳米颗粒对双重刺激(温度和电场)的响应性。[6]此外,已评估了从电响应型PPy纳米颗粒中按需释放不同极性和分子量的药物。[14]实现的生物相容性以及重复脉冲释放所表现出的线性响应表明,此类方法简便且具有微创性,适用于潜在的医疗应用。[6,14]另外,已有报道载药PPy纳米颗粒的pH敏感行为,[15]表明其释放可通过pH值、药物电荷和/或添加带电两亲分子进行调控。
在导电聚合物(ECPs)中,聚(3,4‐亚乙二氧基噻吩)(PEDOT)因其优异的电容性能、快速的掺杂‐脱掺杂过程、稳定的充放电响应以及高导电性、生物相容性和连续操作中的稳定性,可能是用于制造生物医学装置应用最广泛的材料。[16–18]PEDOT的结构、表面形貌和孔隙率与上述PPy完全不同[17,19],因为前者仅由α,α‐连接构成,而后者则是高度交联的。因此,PEDOT的电化学和电学响应远优于PPy。尽管具有这些优势,将药物负载到PEDOT纳米颗粒中以实现按需释放的研究仍几乎未被探索。帕拉迪和西里瓦特[20]研究了负载在PEDOT纳米颗粒并与海藻酸盐水凝胶混合后的苯甲酸的电控释放。最近,刘等人[21]将一种热休克蛋白70(HSP70)抑制剂2‐苯乙炔磺酰胺负载于温敏性聚(N‐异丙基丙烯酰胺)壳层中,并将PEDOT纳米颗粒作为光热耦合剂引入其中。
在本研究中,两种中性和疏水性药物在水中通过乳液聚合法合成过程中被负载到PEDOT纳米颗粒中(药物/PEDOT 纳米颗粒)。这些药物包括姜黄素(CUR),其具有广泛的药理特性,从抗菌、抗病毒、抗原虫、抗真菌和抗炎到抗癌活性[22];以及胡椒碱(PIP),一种哌啶生物碱,具有抗炎、抗生育以及作为中枢神经系统中血清素合成促进剂等药理特性[23]。研究了药物从导电聚合物纳米颗粒中的释放行为,分别在无电刺激和有电刺激条件下进行。结果表明,负载姜黄素的PEDOT纳米颗粒可作为电场触发释放的药物储库。
结果与讨论
尽管已提出多种方法,通过将相应单体与软模板结合来合成导电聚合物纳米颗粒[24],但这些方法因对粒径和胶体稳定性控制不佳而受到批评。此外,还存在难以去除表面活性剂的问题[25]。在最近的一项研究中,周及其同事采用水热法,以FeCl3·6H2O作为氧化剂,十二烷基苯磺酸钠作为稳定剂,制备了粒径分布为17.2 ± 1.6 nm的PEDOT纳米颗粒[26]。本研究中,PEDOT纳米颗粒是在40 °C的水中十二烷基苯磺酸(DBSA)同时作为稳定剂和掺杂剂,过硫酸铵(APS)作为氧化剂(Figure 1b)。值得注意的是,需要稳定剂以避免导电聚合物(ECP)生成难以加工的不溶性块状粉末。所得PEDOT纳米颗粒的有效直径(Deff),如支持信息中图S1所示,通过扫描电子显微镜(SEM)和动态光散射(DLS)测得分别为35 ± 6和84 ± 2 nm。
 通过乳液聚合进行PEDOT纳米颗粒化学合成的示意图。b) 使用(a)中所示方法制备的PEDOT纳米颗粒的透射电子显微镜(TEM)显微照片。c) CUR和PIP的化学结构。)
通过乳液聚合进行PEDOT纳米颗粒化学合成的示意图。b) 使用(a)中所示方法制备的PEDOT纳米颗粒的透射电子显微镜(TEM)显微照片。c) CUR和PIP的化学结构。)
本研究中考虑的两种药物CUR和PIP(图1c)在乳液聚合过程中原位负载。由于它们的疏水性,这些药物保留在表面活性剂胶束的核心中,而不是与介质相互作用。聚合后,形成了PEDOT纳米颗粒,并成功实现了药物负载。载药率(DLR),即包封药物质量与总质量之比,对于CUR和PIP分别为5.9 ± 1.6%和8.0 ± 0.4%,这些值与其他聚合物囊泡所达到的值相似[28]。此外,药物在PEDOT纳米颗粒中的成功负载还通过后续讨论的傅里叶变换红外光谱进一步证实。
负载CUR和PIP的PEDOT纳米颗粒,此后分别称为CUR/PEDOT和PIP/PEDOT 纳米颗粒,呈球形在溶液中稳定(图2)。尽管CUR和PIP均为中性、疏水且分子大小相似(分别为368.4和285.3 g mol−1),但药物种类显著影响了载药纳米颗粒的平均有效直径(Deff),这一点通过动态光散射和扫描电子显微镜测量结果得到证实。表1显示,姜黄素/PEDOT 纳米颗粒粒径较小且呈单分散(即Deff标准差较低),而PIP/PEDOT 纳米颗粒相对较大且呈多分散(即Deff标准差较高)。所制备的纳米颗粒及其聚集体尺寸均成功保持在4 微米以下,低于人体毛细血管的最小直径[29],从而避免了血管堵塞或被人体网状内皮系统清除的风险。
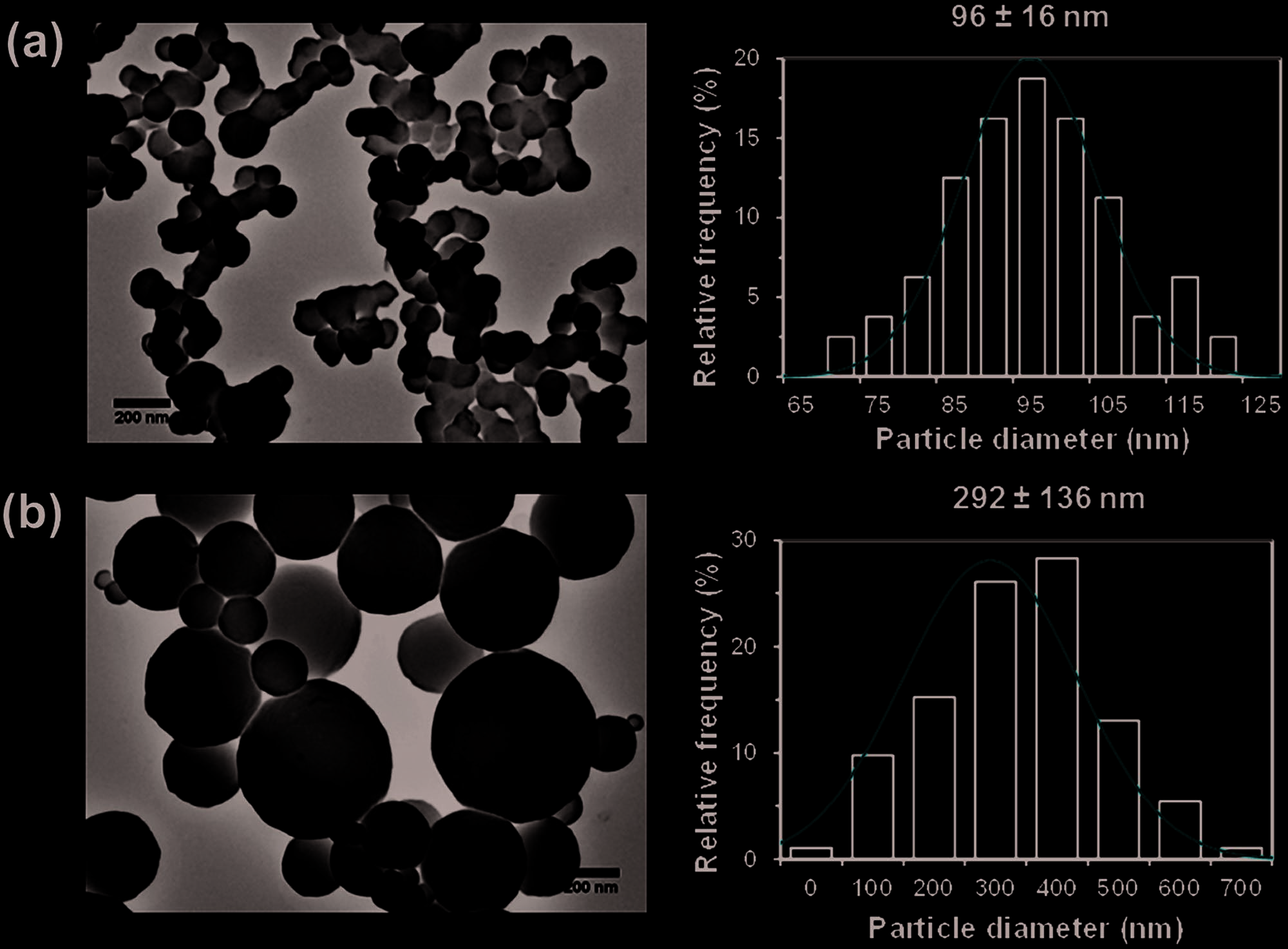 姜黄素/PEDOT纳米颗粒 和 b) 匹哌嗪/PEDOT纳米颗粒 的扫描电镜图像(比例尺:200 nm)。还显示了由扫描电子显微镜测量得到的有效直径直方图及平均值。)
姜黄素/PEDOT纳米颗粒 和 b) 匹哌嗪/PEDOT纳米颗粒 的扫描电镜图像(比例尺:200 nm)。还显示了由扫描电子显微镜测量得到的有效直径直方图及平均值。)
| 表1. 通过扫描电子显微镜和动态光散射测定的有效直径(D eff ),以及未载药 PEDOT、姜黄素/PEDOT和PIP/PEDOT 纳米颗粒的载药率(DLR)和ζ‐电位。 | D eff [ nm ] SEM | D eff [ 纳米 ] 动态光 散射 | DLR [ % ] | ζ‐电位 [ mV ] |
|---|---|---|---|---|
| PEDOT | 35 ± 6 | 84 ± 2 | – | − 29.4 ± 3.6 |
| CUR/PEDOT | 96 ± 16 | 207 ± 3 | 5. 9 ± 1 .6 | − 26.5 ± 25.1 |
| PIP/PEDOT | 292 ± 132 | 304 ± 17 | 8. 0 ± 0 .4 | − 18 . 7 ± 3 .0 |
SEM和DLS观察结果得到了原子力显微镜(AFM)图像的支持,如图3所示,这些图像反映了PEDOT、CUR/PEDOT和PIP/PEDOT 纳米颗粒之间的显著差异。因此,PEDOT 纳米颗粒保持稳定且非常小,而CUR/PEDOT以及特别是PIP/PEDOT则表现出更大的尺寸和更强的聚集倾向。这种尺寸增加可能是由于极低的水溶性所致两种药物促进了PEDOT纳米颗粒内部相对较大分子核的形成。
其聚集倾向通过ζ电位(ζ‐电位)得到证实,变化如下:PEDOT < CUR/PEDOT < PIP/PEDOT(表1)。当ζ‐电位的绝对值约为30时,认为水分散体系的物理稳定性良好。因此,CUR/PEDOT和PIP/PEDOT纳米颗粒的胶体稳定性(ζ‐电位分别为 −26.5 ± 5.1和 −18.7 ± 3.0毫伏)低于PEDOT纳米颗粒(−29.4 ± 3.6毫伏)。
傅里叶变换红外光谱已用于确定PEDOT纳米颗粒表面官能团的化学结构。图4展示了记录的药物、PEDOT纳米颗粒以及药物/PEDOT 纳米颗粒的傅里叶变换红外光谱。掺杂DBSA的PEDOT纳米颗粒显示出噻吩、醚和磺酸根基团的主要吸收峰:噻吩环中CC的伸缩振动模式在1647和1557 cm−1,CH2伸缩振动模式在1478、1396和750 cm−1,COC振动在1206和1057 cm−1,以及SO伸缩振动在667 cm−1。
在聚合过程中添加药物并未影响PEDOT谱带的定位;相反,观察到与各药物相关的谱带,证明了药物已被成功掺入。单独CUR在1626 cm−1和1535 cm−1处的两个主要特征性CO伸缩振动谱带以及在1267 cm−1处的烯醇CO峰,在CUR/PEDOT 纳米颗粒中同样被检测到(图4a)。类似地,在3293 cm−1 处的宽谱带和在3508 cm−1 处的尖锐峰表明存在羟基,而在959 cm−1 和713 cm−1 处的峰则分别归属于苯甲酸trans‐ 和 cisCH振动。最后,游离PIP的傅里叶变换红外光谱(图4b)明显显示出在1628 cm−1和1545 cm−1处的特征性CO伸缩振动峰,这些峰在PIP/PEDOT 纳米颗粒中得以保留。
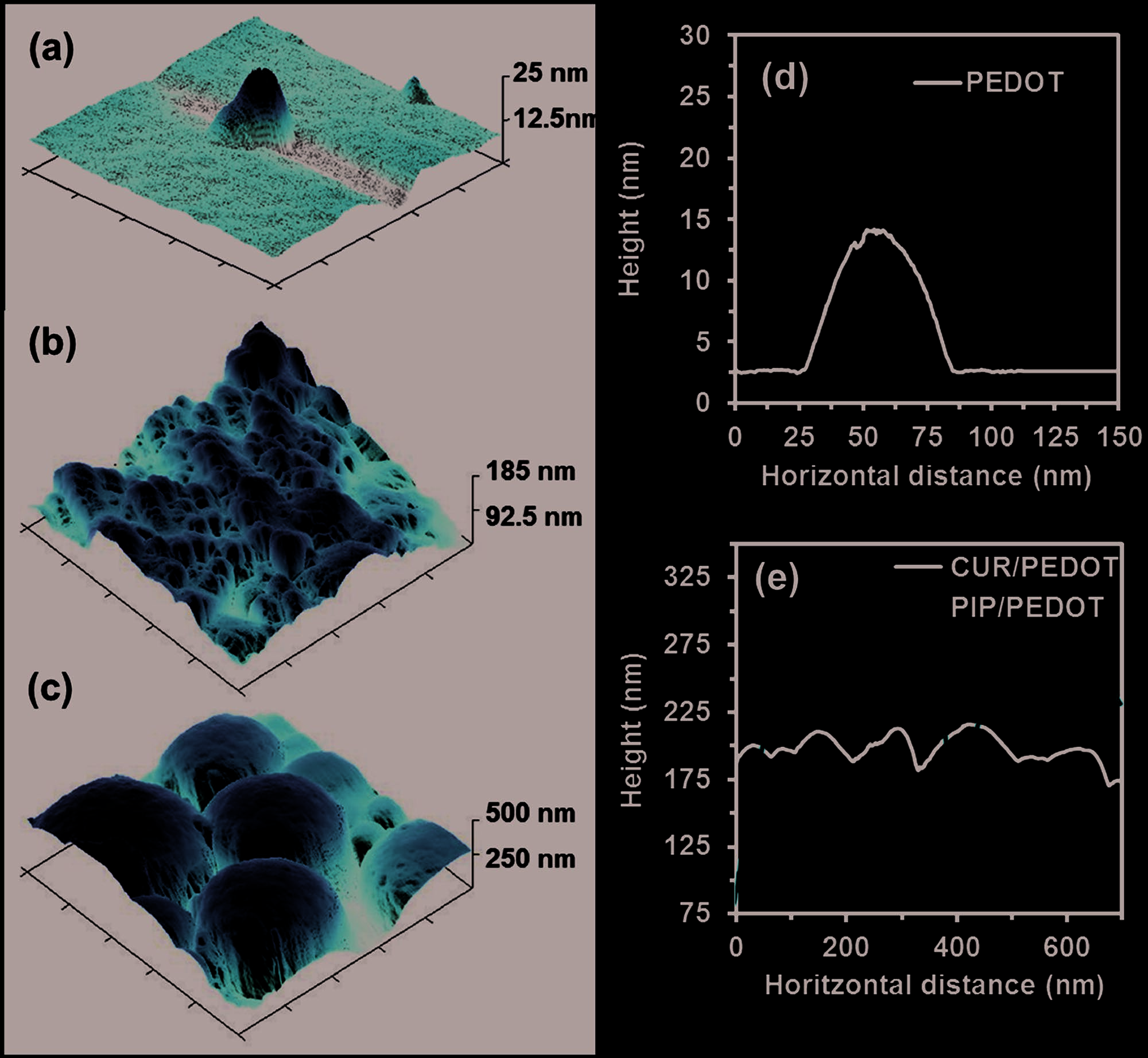 PEDOT、b)CUR/PEDOT 和 c)PIP/PEDOT 纳米颗粒的原子力显微镜图像(1 × 1 μm2)。(d,e)面板中的图表对应于选定的颗粒的轮廓。)
PEDOT、b)CUR/PEDOT 和 c)PIP/PEDOT 纳米颗粒的原子力显微镜图像(1 × 1 μm2)。(d,e)面板中的图表对应于选定的颗粒的轮廓。)
 PEDOT纳米颗粒、姜黄素和姜黄素/PEDOT 纳米颗粒;b)PEDOT纳米颗粒、胡椒碱和PIP/PEDOT 纳米颗粒的傅里叶变换红外光谱。)
PEDOT纳米颗粒、姜黄素和姜黄素/PEDOT 纳米颗粒;b)PEDOT纳米颗粒、胡椒碱和PIP/PEDOT 纳米颗粒的傅里叶变换红外光谱。)
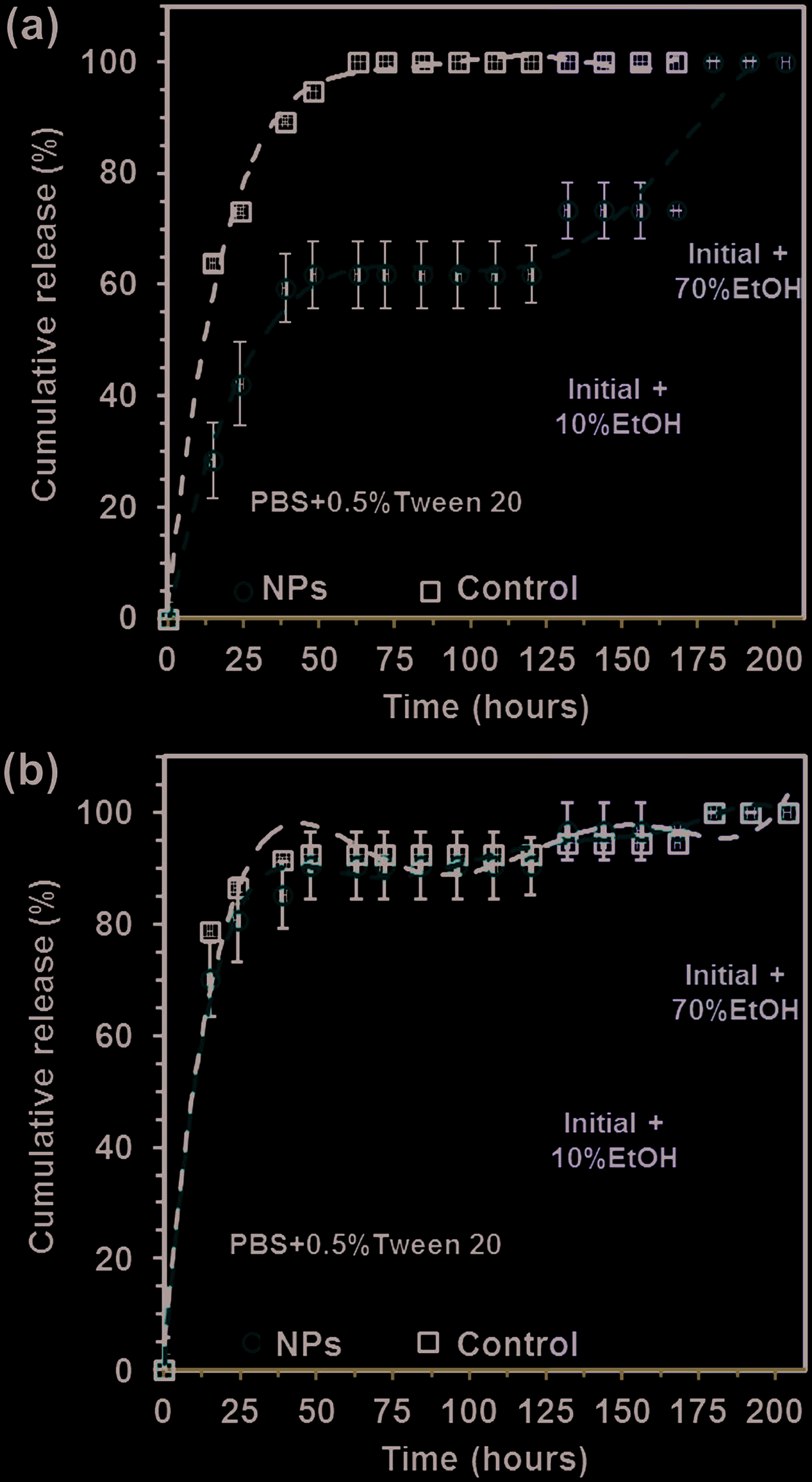
使用分子量截断为3500 kDa的透析袋来研究非刺激性药物释放在不同介质中的动力学(图5)。为了实现CUR和PIP的完全释放,考察了三种对药物亲和力逐渐增强的不同环境:含0.5%吐温20的磷酸盐缓冲液(该表面活性剂有助于药物溶解),以及该溶液分别与10%乙醇(EtOH)和70%乙醇混合的体系。通过比较药物/PEDOT 纳米颗粒与相应对照组(即单独药物)的药物释放量,可以观察到CUR和PIP在与PEDOT相互作用时表现出不同的行为。具体而言,CUR从CUR/PEDOT 纳米颗粒中的释放速度明显慢于PIP从PIP/PEDOT 纳米颗粒中的释放速度(相对于各自的对照组)。
这些结果反映出CUR与PEDOT之间存在相对较强的相互作用,使得药物难以从纳米颗粒中释放,除非使用高浓度醇类的环境(图5a)。相反,PIP从纳米颗粒中的释放情况与其对照组非常相似,表明其释放主要由药物与导电聚合物之间亲和力较弱所驱动的简单扩散现象所致。这一特征也通过释放介质中乙醇含量增加对释放影响几乎可以忽略得到证实(图5b)。
 姜黄素和 b) 胡椒碱。)
姜黄素和 b) 胡椒碱。)
CUR/PEDOT与PIP/PEDOT之间行为的差异应归因于两种药物形成氢键能力的不同。因此,预计会形成CUR···PEDOT氢键在姜黄素(CUR)的羟基基团(图1c)与PEDOT的二氧六环环之间形成。值得注意的是,这类特定相互作用被发现对DNA···PEDOT相互作用起着至关重要的作用[31],且这类作用高度依赖于DNA序列。相比之下,胡椒碱(PIP)中缺乏能够作为氢键供体的基团,因此无法形成PIP···PEDOT氢键相互作用。总体而言,这些结果表明姜黄素/PEDOT 纳米颗粒是作为电响应药物递送系统的有前景的候选材料。
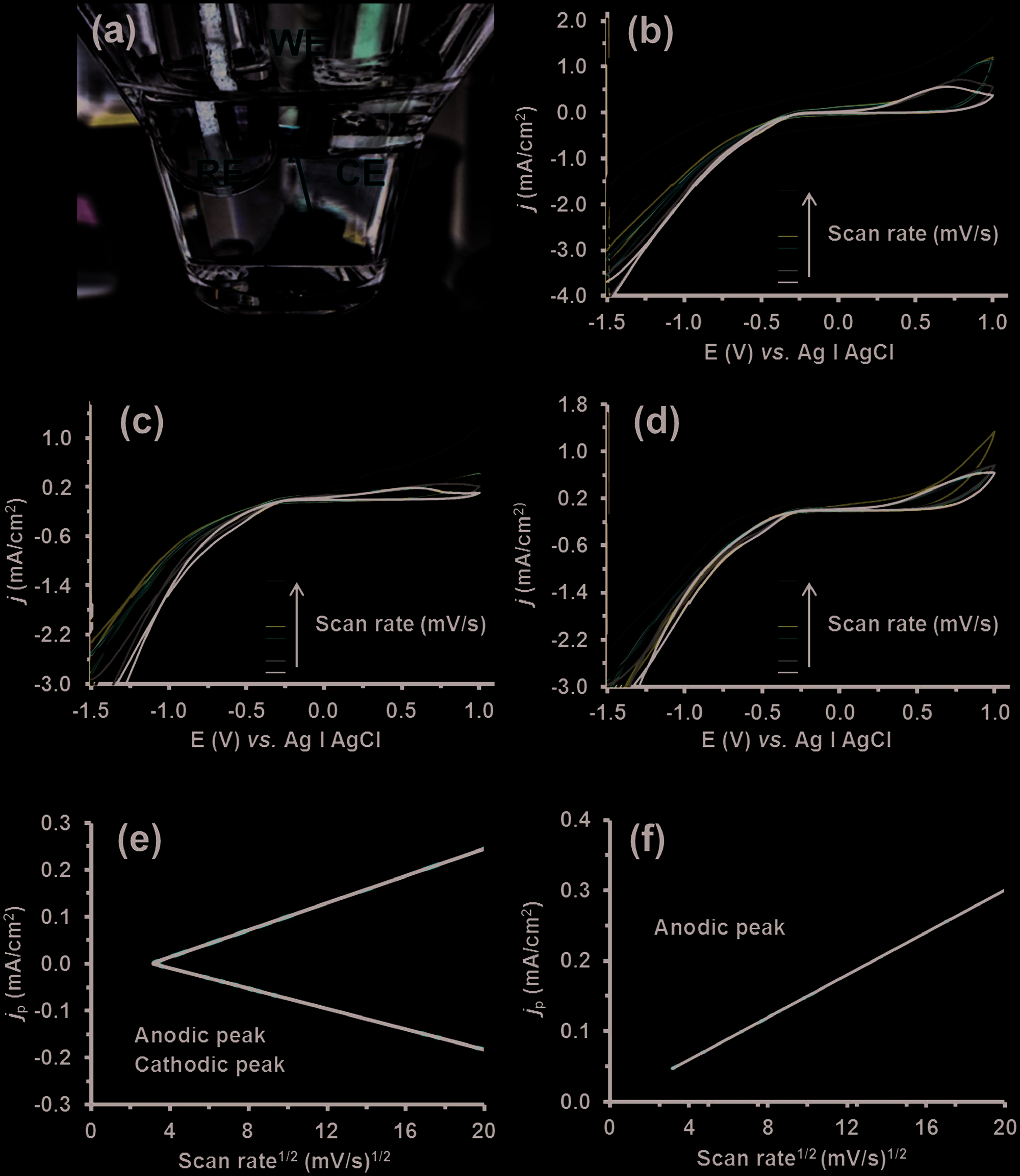
在进行电刺激研究之前,通过循环伏安法(CV)检测了CUR、PIP以及PEDOT和药物/PEDOT 纳米颗粒的电化学响应,记录了在−1.5至+1 V电位范围内不同扫描速率下的氧化‐ 还原循环。Figure 6a(左)显示了当从沉积在GCE上的CUR/PEDOT 纳米颗粒记录CV时三电极体系的照片。有趣的是,当使用较低扫描速率时,可以直观地观察到CUR从纳米颗粒中的释放。
CUR和PIP的循环伏安图分别显示在支持信息中的图S3a,b中。由于CUR分子含有两个羟基,可能发生由电子云偏移引起的共轭效应。可以看出,CUR在 ≈+0.4 V电位处表现出一个明确的阳极峰,在 ≈−0.10 V处有一个较不明显的阴极峰。(图S3a,支持信息),这与之前在其他地方观察到的结果相似。[32]这些准可逆峰归因于不可逆氧化反应的产物,该产物可吸附在电极表面。随着扫描速率的增加,峰的绝对值强度增大,并且峰电位发生轻微偏移,表明它们对应于一个准可逆的氧化还原过程。[33]相反,胡椒碱的伏安图显示出两个不可逆的阳极峰,分别位于0.12 V和0.92 V。
图6b–d比较了吸附在玻碳电极上的PEDOT、CUR/PEDOT和PIP/PEDOT纳米颗粒的循环伏安图。电流密度随扫描速率成比例增加,表明电化学过程依赖于扩散。此外,对CUR/PEDOT纳米颗粒记录的伏安图进行详细分析,可识别出姜黄素阳极峰,其电位介于0.4至0.5 V之间,具体取决于扫描速率。图6e绘制了姜黄素在阳极峰和阴极峰(j p)处的电流密度与扫描速率的平方根的关系,而图6f则表示胡椒碱在0.92 V处不可逆阳极过程的相同关系图。所有情况下均观察到线性行为。此外,对于姜黄素,阳极过程的斜率略高于阴极过程。这些结果证实了电极反应依赖于扩散,即电活性物质通过浓度梯度向电极表面的传质速率。
 用于未载药 PEDOT 和药物/PEDOT 纳米颗粒电化学表征的三电极系统的相机图像。红色箭头指出在 CUR/PEDOT 纳米颗粒实验中释放的姜黄素。WE、CE 和 RE 分别指工作电极、对电极和参比电极。在 PBS 1×(pH 7.4) 电解质介质中,以不同扫描速率(10、20、40、60、80、100、200、300 和 400 mV s− 1)从 −1.5 到 1.0 V 测得的 b) 未载药 PEDOT 纳米颗粒、c) CUR/PEDOT 纳米颗粒以及 d) PIP/PEDOT 纳米颗粒的循环伏安图。e) 姜黄素的阳极和阴极峰以及 f) 苯妥英的阳极峰处的电流密度(j p)随扫描速率的平方根的变化情况。)
用于未载药 PEDOT 和药物/PEDOT 纳米颗粒电化学表征的三电极系统的相机图像。红色箭头指出在 CUR/PEDOT 纳米颗粒实验中释放的姜黄素。WE、CE 和 RE 分别指工作电极、对电极和参比电极。在 PBS 1×(pH 7.4) 电解质介质中,以不同扫描速率(10、20、40、60、80、100、200、300 和 400 mV s− 1)从 −1.5 到 1.0 V 测得的 b) 未载药 PEDOT 纳米颗粒、c) CUR/PEDOT 纳米颗粒以及 d) PIP/PEDOT 纳米颗粒的循环伏安图。e) 姜黄素的阳极和阴极峰以及 f) 苯妥英的阳极峰处的电流密度(j p)随扫描速率的平方根的变化情况。)
聚噻吩纳米颗粒中中性药物的电刺激释放:药物‐聚合物相互作用的智能调控
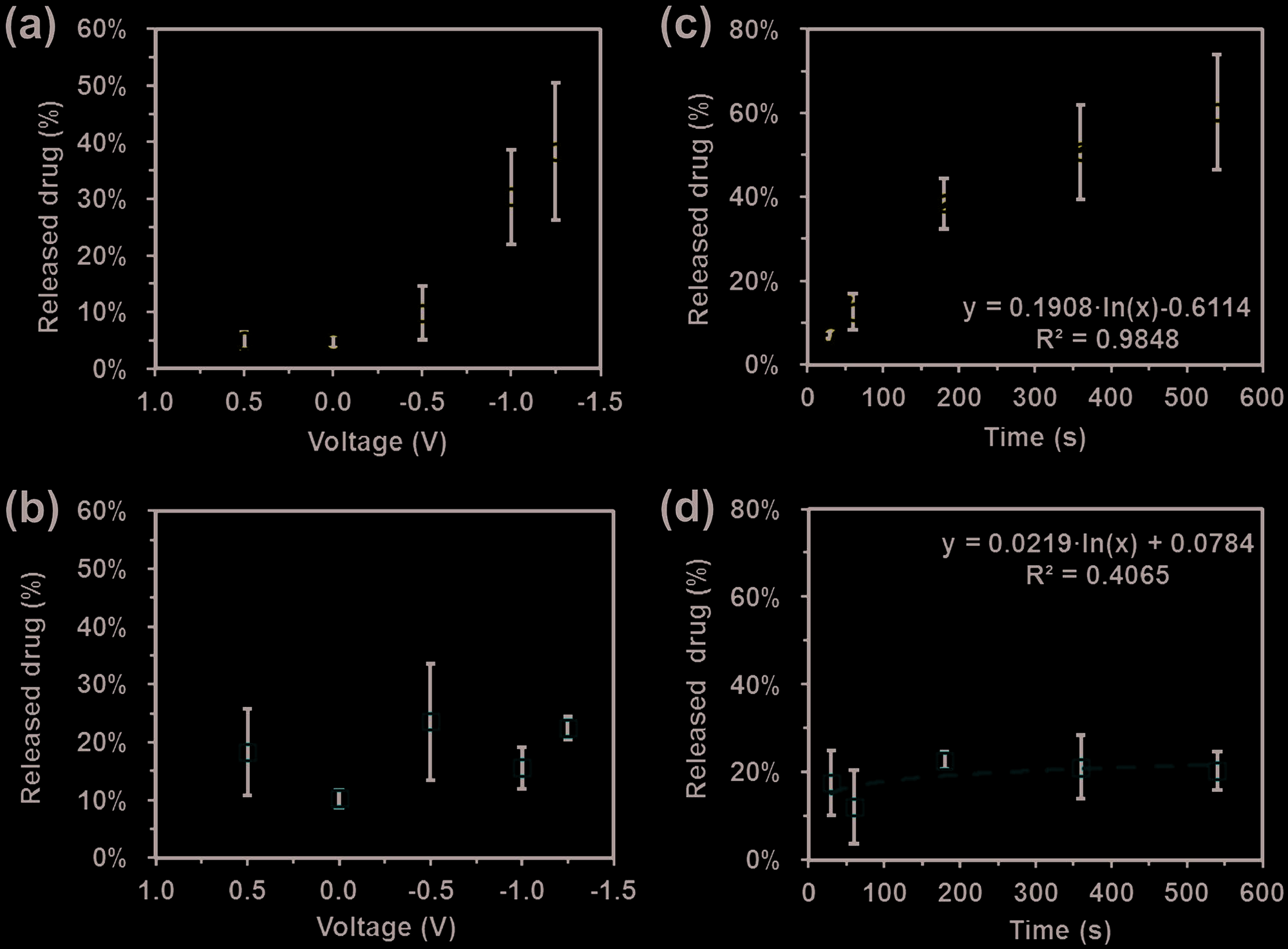
使用常规三电极体系进行电刺激实验,该体系类似于图6a所示,以涂覆有药物/PEDOT 纳米颗粒的玻碳作为工作电极(WE),裸露玻碳作为对电极(CE),Ag|AgCl作为参比电极(RE)。为了研究电压对药物/PEDOT 纳米颗粒中姜黄素和苯妥英释放的影响,在不同电压(即0.00, −0.50, −1.25 和 +0.50 V)下进行了实验,持续时间为3 min。实验结果与对照组进行了比较,对照组在无电电压条件下进行(以下简称0.00 V)。为了模拟生理环境,采用含0.5%(v/v)吐温20的PBS在pH 7.4条件下作为电解质介质进行电刺激药物释放实验。
针对CUR和PIP的结果分别显示在图7a、b中,表现出完全不同的行为。释放的姜黄素占总姜黄素的百分比相对于在施加电压为0.50 V或无刺激时,包封的姜黄素含量低于5%,而随着负电压的增加,其释放量逐渐呈线性上升。因此,施加−1.25 V电压刺激3分钟可实现38%的姜黄素释放。对于PIP/PEDOT 纳米颗粒,在无刺激情况下药物释放量为10%,当施加电压为−0.50 V和0.50 V时,释放量分别增加至18%和23%。在PIP的情况下未观察到系统性的规律(图7b),表明该药物的释放无法通过电刺激进行控制和程序化调控。
 姜黄素 和 b,d) 胡椒碱 (n = 6)。释放药物百分比相对于负载药物总量表示。)
姜黄素 和 b,d) 胡椒碱 (n = 6)。释放药物百分比相对于负载药物总量表示。)
图7c,d分别显示了药物/PEDOT纳米颗粒中姜黄素和苯妥英随时间的释放情况。这些实验在固定电压−1.25 V下进行,结果与图7a,b中报道的结果一致。这表明仅对姜黄素可通过电刺激实现有效的可控释放。因此,尽管在30秒后仅释放了7%的姜黄素,但释放的药物量随时间对数增长。在3和9分钟之间的时间段内,释放量从38%增加到60%。此外,补充实验显示,当电压关闭时,姜黄素的释放停止,证明这是一个调控过程。这些结果表明,可控的姜黄素释放可以通过时间和施加电位来实现(分别对应图7a,c)。释放曲线不仅在新鲜样品中可重复,而且在储存长达一个月的悬浮液中也可重复。苯妥英释放随时间的变化实际上几乎为零(即在3和9分钟后均为20%),进一步证实该药物与导电聚合物之间的弱相互作用阻碍了其释放PIP/PEDOT 纳米颗粒作为剂量可控药物递送载体的适用性。
先前的研究表明,药物的摄取和释放速率可能取决于导电聚合物(ECP)的结构、组成和氧化态。[11]在通过电刺激释放带电药物的特定情况下,主要影响因素是氧化态,因为该过程的驱动力是药物与ECP之间静电排斥作用的出现。因此,ECP的氧化和还原分别导致阳离子和阴离子药物的释放。[11]然而,CUR和PIP在pH 7时为中性药物,因此其电刺激释放预期由更复杂的机制控制。遗憾的是,能够实现中性药物可控释放的设计极为稀少。兰格(Langer)及其同事[35]利用生物素掺杂的聚吡咯(PPy),在聚合物表面的生物素结合位点负载生物素化的神经生长因子(NGF)。PPy薄膜的还原引发了电刺激触发的NGF释放,且释放的NGF保持了生物学活性。另一方面,N‐甲基吩噻嗪(NMP)被载入掺杂了阴离子β‐环糊精的PPy中,在氧化时发生释放,这是由于氧化在ECP和NMP上均形成了正电荷所致。[36]
本研究提出的电刺激姜黄素释放机制基于电压对导电聚合物氧化态的影响,从而影响PEDOT与姜黄素的相互作用。施加正电压(+0.50 V)不会刺激姜黄素的释放,该电压增强了聚合物的正氧化态(图S3,支持信息),而药物的氧化在该电位左右开始发生(图S3,支持信息)。相反,姜黄素的释放在施加负电压时变得可被电刺激施加负电压会引发电化学去掺杂(还原)PEDOT纳米颗粒。因此,随着负电压的增加,还原态PEDOT位点占总活性位点(即发生电子交换的位置)的比例也随之上升,在−1 V电压下,聚合物链预计会完全或几乎完全被还原(即去掺杂,呈中性电荷)。[34]据观察,较低的电压会导致ECP纳米颗粒发生机械和电化学降解。ECP的去掺杂会影响其与药物之间的分子间相互作用,当PEDOT链处于中性状态时,氢键显著弱于氧化态。[37]因此,姜黄素/PEDOT纳米颗粒中电刺激姜黄素释放的机制可用以下方程(1)概括
α β α β β ( )
⋅ ⋅⋅⋅ + → ⋅ − ⋅⋅⋅ + + −
α
α β
− −
− −
−
(PEDOT DBSA) CUR (PEDOT ( )DBSA) CUR DBSA CUR
+
( ) +
n e
m n m (1)
其中,nCUR 指与氧化态聚合物纳米颗粒通过氢键结合的药物分子,mCUR 对应在通过电刺激向系统泵入 β 个电子后仍与聚合物纳米颗粒保持氢键结合的药物分子,α+ 和 (α−β)+ 分别为氧化态和还原态 PEDOT 的氧化态(即当 PEDOT 完全还原时,α= β,导电聚合物的电荷为零)。
本研究提出的中性药物释放机制,适用于能够与导电聚合物基质形成特定相互作用的中性药物,该机制类似于通常报道的当带负电荷的药物作为掺杂剂离子时的情况。[8]遗憾的是,这种机制并不适用于PIP/PEDOT 纳米颗粒,因为该药物缺乏氢键供体。因此,PIP 分子通过聚合物纳米颗粒壁快速释放,这种扩散过程独立于外部刺激的存在与否。因此,尽管施加电电压会影响PEDOT 链的氧化态,但它并不能改善由PIP 分子与导电聚合物的芳香环之间本质上较弱的分散相互作用所决定的释放控制。
为了克服姜黄素在光下不稳定、体内口服生物利用度差以及在水性溶剂中缺乏溶解性的局限性,研究人员已广泛探索使用由聚合物材料(例如聚乳酸‐共‐乙醇酸)制成的微米和纳米粒子作为载体。[38]尽管聚合物微米和纳米粒子提供了生物相容性,且在某些情况下还具有可生物降解性,能够实现姜黄素的持续释放并提高其生物利用度,但仍发现了一些缺点。其中最重要的问题是释放过程的有效控制,本研究通过向涂覆有CUR/PEDOT 纳米颗粒的电极施加可控电压,实现了程序化的姜黄素释放,从而克服了这一问题。
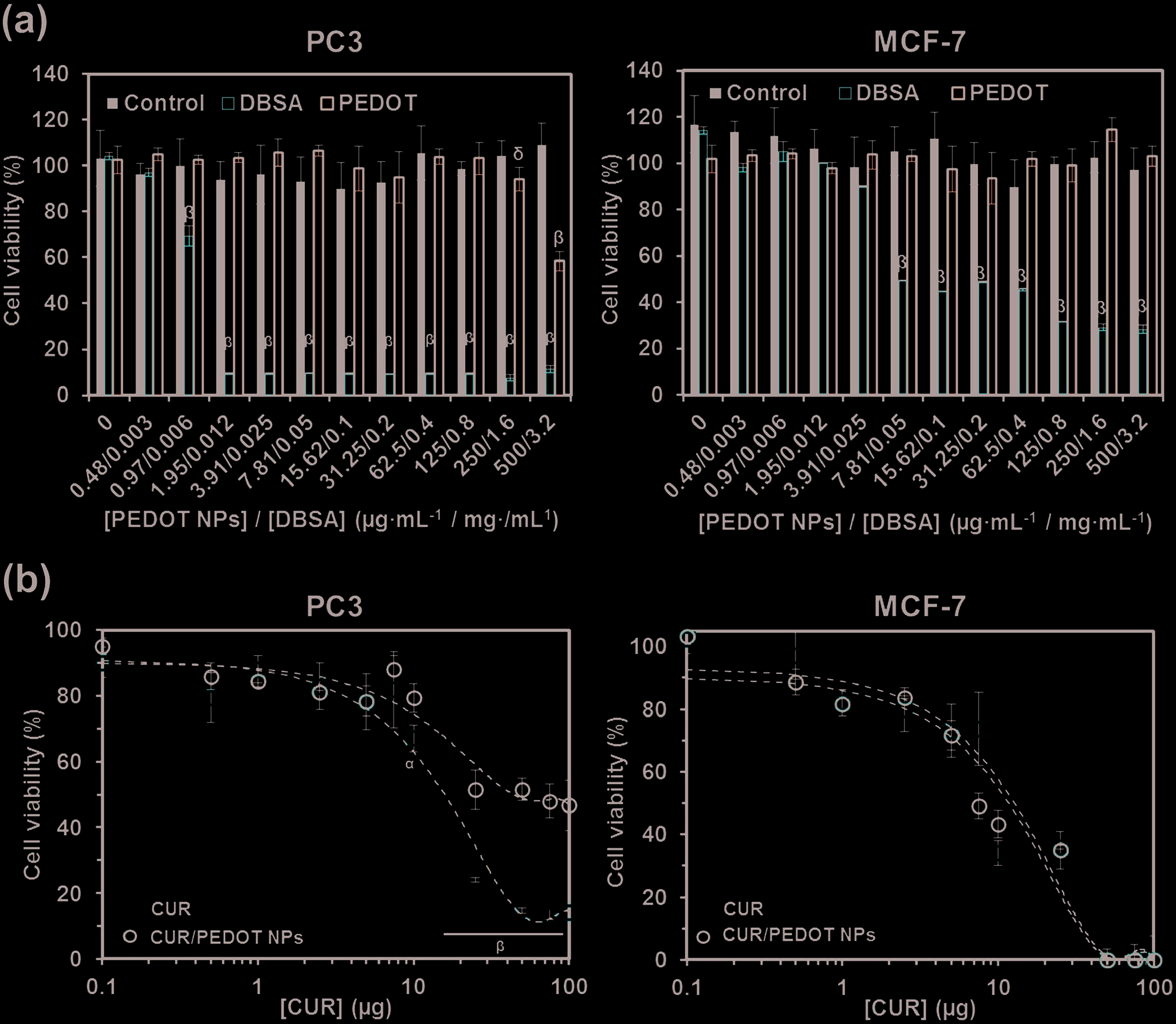
该系统的生物相容性和细胞毒性是进一步生物学分析的重要特性应用。使用3‐(4,5‐二甲基噻唑‐2)‐2,5‐二苯基四氮唑溴盐(MTT)比色法检测PEDOT纳米颗粒和表面活性剂(DBSA)单独在人类类上皮前列腺和乳腺腺癌细胞系(分别为PC3和MCF‐7)中的作用,检测时间在24小时治疗后(图8a)。PEDOT纳米颗粒在高浓度以下不表现出任何毒性效应。此外,经过三次洗涤步骤后,掺杂剂的含量低于6 μg mL−1,此时DBSA才开始具有毒性。游离姜黄素和姜黄素/PEDOT 纳米颗粒的细胞毒性通过相同细胞系在24小时治疗后进行评估,显示出显著的浓度依赖性(图8b)。两种体系的行为存在显著差异,游离姜黄素的毒性明显高于姜黄素/PEDOT 纳米颗粒。具体而言,对于PC3细胞,前者的半最大抑制浓度(IC50)约为20 μg mL−1,后者约为100 μg mL−1;而对于MCF‐7细胞,两者的IC50均约为10 μg mL−1。这些结果结合事实表明,在无外部刺激时,载入纳米颗粒内的药物仅部分释放,这证实了通过乳液聚合法形成的PEDOT 纳米结构是一种非常有前景的电活性载体,可用于具有能与氢键相互作用基团的中性药物的可控递送。
 PEDOT纳米颗粒和DBSA在24小时对PC3和MCF‐7细胞的细胞毒性研究。尽管它们在同一图表中表示,但PEDOT纳米颗粒和DBSA的实验是独立进行的。b)姜黄素和CUR/PEDOT 纳米颗粒在24小时对PC3 和 MCF‐7 细胞的细胞毒性评价。数值为三个样品的平均值,误差棒表示其标准差。柱状图/数据点上的希腊字母表示应用双因素方差分析和Tukey多重比较检验时存在的显著差异:α, δ, β分别表示在特定浓度组内p值低于0.05、0.001和0.0001时观察到的显著差异。)
PEDOT纳米颗粒和DBSA在24小时对PC3和MCF‐7细胞的细胞毒性研究。尽管它们在同一图表中表示,但PEDOT纳米颗粒和DBSA的实验是独立进行的。b)姜黄素和CUR/PEDOT 纳米颗粒在24小时对PC3 和 MCF‐7 细胞的细胞毒性评价。数值为三个样品的平均值,误差棒表示其标准差。柱状图/数据点上的希腊字母表示应用双因素方差分析和Tukey多重比较检验时存在的显著差异:α, δ, β分别表示在特定浓度组内p值低于0.05、0.001和0.0001时观察到的显著差异。)
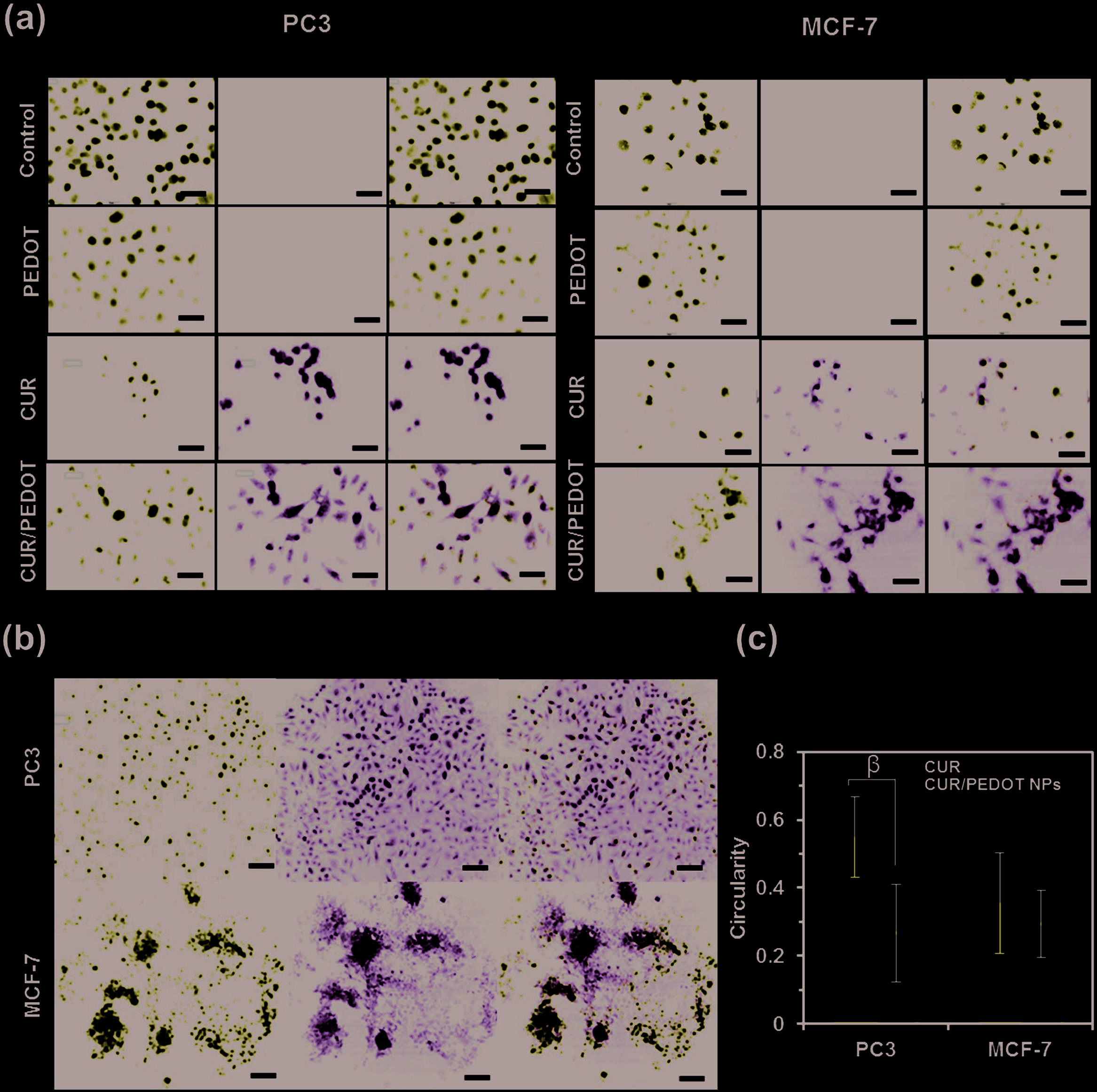
为了探究细胞毒性的机制,通过荧光显微镜观察了游离姜黄素和姜黄素/PEDOT 纳米颗粒在PC3 和 MCF‐7 细胞中的细胞摄取情况。Figure 9 显示了未处理细胞、PEDOT 纳米颗粒处理组、游离姜黄素处理组和姜黄素/PEDOT 处理组作用24 h后的图像。以不含药物的培养基作为对照组,以及PEDOT 纳米颗粒处理组。这两个组在任何时间点均未显示荧光信号,且细胞核数量没有减少。相反,在作用24 h后,游离姜黄素和姜黄素/PEDOT 纳米颗粒组在细胞质中均观察到强烈的荧光。此外,这两个组的细胞核数量较处理前有所降低。同时观察到不同的细胞形态:游离姜黄素处理的细胞比姜黄素/PEDOT 处理的细胞呈现更圆的形态,表现为高圆度(图9c)。这些结果表明细胞受游离姜黄素的影响比其被封装在PEDOT纳米颗粒中时更大,再次表明只有在刺激后药物才能发挥完全作用。
PC3 和 MCF‐7 细胞在未孵育任何物质(对照组)、PEDOT纳米颗粒、姜黄素和姜黄素/PEDOT 纳米颗粒中孵育24小时后的高倍荧光图像。比例尺代表40 μm。b)PC3 和 MCF‐7 细胞与姜黄素/PEDOT 纳米颗粒孵育24小时的低倍细胞图像。比例尺代表100 μm。每个面板从左到右依次显示Hoechst染色的细胞核(蓝色)、姜黄素荧光(绿色)以及双图像叠加。c)通过ImageJ 软件评估的细胞圆度。β表示进行t检验时p值低于0.0001,存在显著差异。)
总体而言,本文获得的结果表明,CUR/PEDOT纳米颗粒可被视为基于姜黄素的抗菌、抗病毒、抗原虫、抗炎或抗癌活性的治疗应用中的潜在可控释放系统。该系统通过施加仅−1.25 V的无害外部电压(例如来自普通小型电池),即可在所需的周期性时间实现特定剂量的药物释放。此外,经过进一步优化以略微降低所需电压后,有望利用人体内自然存在的弱电场(如心血管和神经组织的固有电场)对CUR/PEDOT纳米颗粒系统进行刺激,从而实现更先进的生物医学应用。
结论
通过使用DBSA作为稳定剂和掺杂剂的原位乳液聚合法,实现了CUR和PIP在PEDOT纳米颗粒中的包封。这两种中性药物仅在与氧化态聚合物链形成氢键相互作用的能力上有所不同,在有无外部电刺激的情况下,其释放行为表现出显著差异。CUR的释放受到此类特定药物···ECP相互作用强度的控制,当施加外部负电压使聚合物链还原时,这些相互作用减弱。因此,CUR/PEDOT纳米颗粒是一种极具前景的组合,能够通过外部刺激有效调控药物释放。该方法可推广至其他具有类似氢键能力的中性药物,可能成为基于姜黄素程序化剂量治疗的一种潜在策略;姜黄素除多种药理特性外,已证明对包括结直肠癌、乳腺癌、肺癌、前列腺癌和胰腺癌在内的多种恶性肿瘤具有抗癌效果。[22d]
 聚噻吩纳米颗粒电控药物释放
聚噻吩纳米颗粒电控药物释放





















 35
35

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








