用于生物材料和医疗器械的电液动力技术(EFDTs)
3D导管用于周围神经再生
16.1 神经变性与再生的病理生理学
16.1.1 周围神经解剖学
周围神经包括脊髓外的所有脊神经以及除视神经以外的所有脑神经。这些神经遍布全身,是自主神经系统和躯体神经系统的重要组成部分。由于周围神经存在于全身各处的组织中,因此常因外伤或疾病而受损。与其他主要由具有较短轴突的神经元胞体组成的神经系统部分不同,周围神经由长轴突构成,这些轴突有时可从位于中枢神经系统(CNS)内或靠近CNS的神经元胞体延伸超过一米。躯体神经系统的脊髓运动神经元胞体位于脊髓前角,而脊髓感觉神经元胞体则位于脊髓背外侧数毫米处的背根神经节(DRGs)内。来自背根神经节(DRGs)的感觉神经元发出单一轴突,该轴突分叉为两支:一支通向感觉靶点,另一支进入脊髓背角,在脊髓中枢神经系统(CNS)内的神经元之间形成突触。
周围神经轴突负责长距离的快速传导,因此许多周围神经轴突由施万细胞(SCs)髓鞘化。施万细胞(SCs)是周围神经系统(PNS)特有的特化胶质细胞类型,可促进快速传导。施万细胞为周围轴突提供额外支持,包括神经营养因子、调节电化学通讯以及促进受损神经的再生[1]。周围神经还含有大量肥大细胞、束膜细胞、内皮细胞和类似成纤维细胞的神经内膜细胞,这些细胞在正常稳态以及再生过程中发挥作用。
周围神经在结构上被组织成具有功能意义的区室。由胶原蛋白和弹性纤维组成的外膜基底膜包裹着神经,将其与其他组织分隔开来。在外膜基底膜内部,轴突根据其延伸的解剖区域进行分组,每组轴突被束膜包裹。轴突及其包绕的束膜膜被称为神经束[2]。神经中的神经束数量可以从一个到一百多个不等,具体取决于神经的大小和复杂性。鉴于引导再生轴突到达其适当靶点的重要性,重建束状结构是神经再生策略面临的一个挑战。
在每个神经束内,单个轴突进一步被包裹在称为神经内膜的细薄结缔组织层中。纵向排列的毛细血管在神经内膜内沿轴突平行延伸,并由神经束之间的血管网络供血。外膜血管高度相互连接,血流量和方向会根据局部代谢需求而变化[3]。损伤后,除了有髓和无髓轴突外,所有支持细胞和基底膜也必须再生[4]。
16.1.2 周围神经损伤与再生过程
周围神经损伤的表现各异,根据是否完全损伤以及损伤导致神经横断、压伤或拉伸而有所区分。临床医生通常根据电生理功能障碍的程度对损伤进行分类,最常用的是Seddon和Sunderland分级[5,6]。尽管不完全和完全神经损伤在损伤反应和再生过程方面相似,但本文将重点讨论完全横断性损伤后的情况,此类损伤需使用桥接装置进行治疗。在这种情况下,神经遭受创伤性损伤,部分神经元会因损伤而死亡[7]。近端残端发生的神经元死亡和变性的程度与损伤严重程度相关。锐性切割伤造成的损伤较小,但通常会向近端延伸数个郎飞结的距离[8]。由于基底膜的弹性,近端残端迅速回缩,受损血管出血从而启动凝血级联反应。髓鞘/施万细胞从受损的轴突部分解离,浸润的吞噬细胞清除髓鞘碎片和其他组织损伤残留物[9]。在损伤远端的神经节段也会发生类似的过程,但由于轴突与神经元胞体分离,该过程沿着远端神经结构的整个长度更为广泛地进行。这些远端轴突经历华勒变性,施万细胞也从变性的轴突上解离[10]。浸润的巨噬细胞和中性粒细胞吞噬髓鞘及其他组织碎片,使远端神经结构更有利于轴突浸润和再生[11]。
损伤后数小时至数天内再生过程即开始。数小时内开始凝血并形成纤维蛋白基质,数天内逐渐成熟为再生结构[12]。聚集的巨噬细胞吸引近端和远端残端处的血管系统及施万细胞,这些细胞开始迁移至基质上。位于远端神经结构内的施万细胞以及迁移而来的施万细胞由髓鞘形成状态转变为促再生状态[13]。处于促再生状态的施万细胞增殖,并沿着血凝块中的纤维蛋白束以及内皮细胞与近端轴突排列,形成再生通路。施万细胞分泌有丝分裂原,如神经营养因子、降钙素基因相关肽、神经调节蛋白、胶质细胞源性神经营养因子等,促进神经元存活和轴突延伸[13,14]。如果近端和远端残端足够接近,即使没有桥接,细胞外基质分子也能连接两个残端device[15]。施万细胞、内皮细胞和成纤维细胞在纤维蛋白束上迁移,并形成布恩格带,跨越间隙并延伸至远端神经结构[16,17]。该桥接结构还包含成纤维吞噬细胞以及构成成熟再生周围神经的多种其他细胞类型。该桥接结构为幸存轴突的延伸提供了有利环境,且在损伤后2至3周内即发生显著的轴突延伸[12,18]。
时间、距离和再生路径在组织学和功能再生的程度上起着重要甚至决定性的作用。施万细胞向促再生类型转化的过程在损伤后立即开始,但如果施万细胞在数周后仍未与再生轴突接触,它们将逐渐失去再生能力,并减少神经营养因子的表达[19]。如果损伤造成的缺损达到临界尺寸,由凝血形成的细胞外基质将无法连接两个残端,且趋化信号不足以诱导再生桥的形成[20]。
即使轴突能够进入远端残端,再生路径也可能非常困难。领先的轴突以每天约1毫米的最大速度再生,而周围神经会分叉成越来越细的神经,延伸至其运动或感觉靶组织。损伤后原有的束状结构在多大程度上得以保留或重新生成目前尚不清楚,但对混合神经(包含运动和感觉轴突)进行逆行标记的结果表明,再生轴突通常会沿着错误的分支生长[21–23]。这些错误路径的轴突若误入了不正确的分支(如运动轴突进入感觉分支或反之),则在功能上是无用的,并且其中许多会在一个称为修剪的过程中被消除[24,25]。运动和感觉轴突的存活及其正常功能依赖于与适当的终末器官建立连接。即使运动和感觉轴突成功再生到合适的终末器官靶点,它们也可能连接到了与受伤前不同的运动终板或感觉靶点。这种情况可能使神经免于被修剪,但在缺乏足够的外周和中枢可塑性的情况下,很可能导致患者功能受损和协调能力下降[26,27]。
总之,周围神经的再生过程包括三个主要阶段:清除受损神经以准备再生、轴突向远端神经结构内及通过远端神经结构再生、以及支配运动或感觉靶点。即使在最佳情况下,再生也常常不完全,这三个过程中的任何一个出现问题都会使结果恶化。当运动和感觉轴突重新支配其损伤前的精确靶点时,可实现最佳再生;而再生距离越长,损伤远端的分支数量越多,达到这一目标的可能性就越低。
16.2 周围神经修复的临床和实验技术
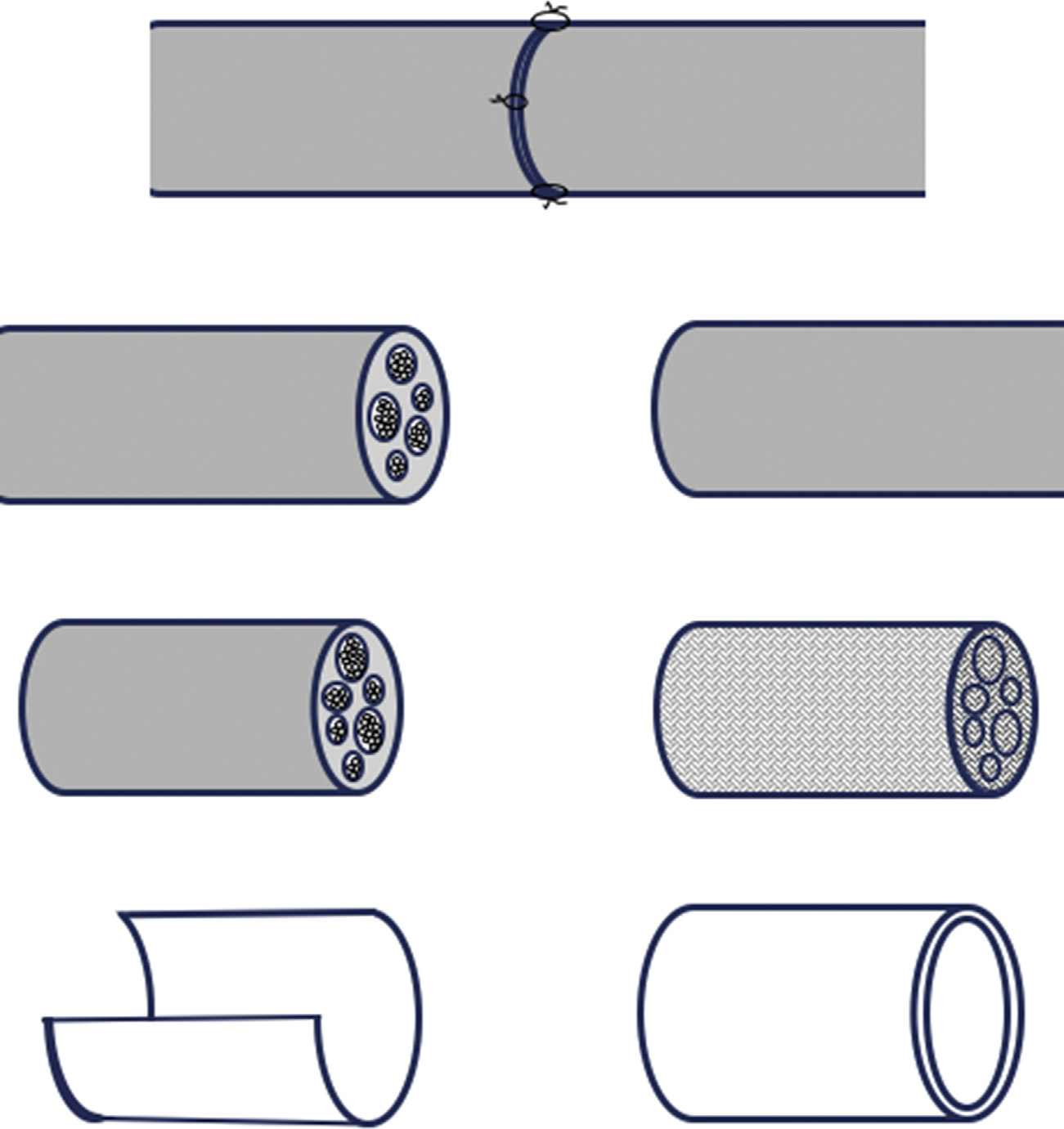
对于临界尺寸的节段性周围神经损伤,内源性桥无法充分形成,且无法将神经残端充分拉伸以实现直接吻合,此时需在缺损处植入移植物,以直接桥接缺损或促进内源性桥的形成,使其跨越原本无法再生的距离(图16.1)。
使用自体外周神经作为移植物是金标准。证据表明,对于含有运动轴突的周围神经再生,混合外周神经自体移植优于单纯感觉神经移植物[28],但在大多数情况下采集混合神经并不可行[29]。然而,牺牲感觉功能通常是可以接受的权衡,以换取运动功能恢复。腓肠神经是临床上最常用于与神经残端吻合的移植材料。这一坐骨神经的感觉分支通常较长,可达20 cm以上,并支配小腿和足部的小段区域[29a]。其他常见的感觉自体移植选择包括前臂内侧和外侧皮神经、尺神经背侧皮支、腓浅神经和腓深神经、肋间神经以及大腿后侧和外侧皮神经[30]。然而,感觉自体移植并非没有缺点;例如腓肠神经等感觉移植物的局限性包括手术风险、供区并发症、尺寸(直径)不匹配、缺乏能够最佳促进运动轴突再生的与运动相关的施万细胞,以及供体来源有限[18,31]。周围神经异体移植是一种替代方案,其优点包括可以使用与受体缺损部位相对应的确切区域的混合神经,但全身性免疫抑制的风险显著,似乎限制了其广泛应用[32]。对于(活神经)自体移植和异体移植而言,移植神经段在被获取后立即发生华勒变性,因此其等同于远端神经段。
为了克服活体神经移植物的一些局限性,研究人员已投入大量精力开发和优化可批量生产并包装以供临床随时使用的移植物。这类移植物在此后统称为加工型移植物,其设计为临时性,通常由可降解材料构成。迄今为止,已有近100种不同材料制成的加工型移植物在动物模型中进行了测试。目前,其中有十种移植物已获得美国食品药品监督管理局批准。NeuroGen、NeuraWrap、NeuroFlex、NeuroMatrix和NeuroMend均由I型胶原构成,而其他移植物则由聚合物构成:NeuroTube(聚乙醇酸)、Neurolac(聚(‐乳酸‐共‐己内酯))和SaluBridge(聚乙烯醇水凝胶),或由处理过的组织构成,例如Avance(脱细胞人异体移植物)和AxoGuard(脱细胞猪黏膜下层)[6,33,34]上述大多数移植物均为导管,旨在缝合至神经残端,但NeuraWrap和NeuroMend除外。这两种移植物设计用于包裹外周神经损伤部位,在无明显组织缺失的情况下防止再生轴突逸出以及纤维组织侵入。
动物研究和临床试验表明,加工型移植物已成功用于长达3–5厘米的节段性神经缺损[6,33,34]。与自体移植相比,使用这些移植物的再生速度明显较慢,且往往再生不完全[35]。然而,一些长期研究发现,某些加工型移植物在小于2厘米的较小间隙长度中促进再生的效果可与自体移植相媲美,这验证了其相对于自体移植存在的局限性和合并症而言的应用价值[36]。对于较长缺损,加工型移植物相较于自体移植效果甚微,而在已发表的研究中,加工/脱细胞异体移植物表现出最佳效果[37,38]。活体神经异体移植物是一种非常有效的移植材料,相较于自体移植具有明显优势:无需二次手术,可采用混合神经,能更精确地匹配直径和束状结构,并可桥接复杂的神经结构。此外,在动物模型以及长度超过20厘米的人类缺损中,异体移植物似乎仅需暂时性免疫抑制即可实现完全再生[39,40]。尽管是暂时性的,全身性免疫抑制的需求仍带来显著风险和费用,限制了其广泛应用。
使用此类移植材料似乎还取决于通过神经再生恢复的功能的重要性[30]。对于较短缺损,当再生会显著改变患者生活质量时,自体移植仍是首选方案。加工神经移植物通常用于对患者功能重要性较低的情况,此时采集带来的风险和共病不会超过功能恢复的获益。外科医生也常使用加工型移植物来包裹由自体移植物桥接的缺损,以保护脆弱的神经段,并限制纤维组织浸润和/或神经瘤形成[38]。据我们所知,目前尚无已发表的研究在大规模队列中对此进行调查。
由于加工型移植物与自体移植物在再生效果上存在差异,已开发出多种方法来改进加工型移植物的再生效果。这些改进可分为对加工型移植物物理/材料特性的改变以及添加生物诱导成分[41,42]。这些内容的详细描述超出了本章范围,我们将讨论这些努力的主要主题。如前所述,已有多种材料被研究用于此类移植物,其中许多已被证明是合适的,因为再生能够发生,且在植入或加工型移植物降解过程中未见毒性。
为改进加工型移植物,已研究的物理变化包括孔隙率、机械性能、降解与吸收的优化,以及添加亚结构特征。人们普遍认为,对于较长神经缺损而言,孔隙率对营养物质和废物交换至关重要,但有效孔径大小因所用材料和制备方法的不同而有显著差异[43–46,46a]。总体而言,孔径应允许营养物质和废物交换,但又不能过大,以免纤维组织进入加工型移植物,从而影响再生过程。此外,已有研究表明,移植物壁内特殊的多孔微结构会深刻影响细胞行为,形成一种具有指导性的微环境,并对关键生物通路实现选择性调节,以促进神经形态发生[43]。
机械性能应尽可能接近天然神经,允许拉伸和缝线维持,但在弯曲和屈曲时应保持开放管腔,以便用于关节附近的缺损。理想的降解时间线应在再生中的神经束成熟过程中保持所需的孔隙率和结构完整性,阻止纤维组织进入,同时允许血管系统整合。亚结构特征旨在在管腔内创造更有利于再生的环境。亚结构的例子包括内部通道(类似于神经束的排列)和微图案化。
加工移植物材料与活体神经自体移植物和同种异体移植物所提供的神经支持环境相比,除脱细胞异体移植物外,通常具有相对的生物惰性。将生物刺激引入加工型移植物的研究努力可分为四大类:神经刺激分子、内部基质、诱导细胞和电刺激。尽管这些方法在动物模型中均显示出一定前景,但目前尚无添加生物刺激的加工移植物被批准用于人类使用或在临床实践中广泛应用。神经刺激分子旨在模拟细胞,包括小分子药物、多肽、生长因子和大分子结构蛋白。内部基质试图创造出类似于导管亚结构的环境,以模仿周围神经再生的自然过程。已在导管内开发并测试了多种水凝胶,旨在重现非关键尺寸缺损中神经残端之间的形成的纤维支架的作用。在导管中引入细胞可提供额外的生物活性,旨在降低炎症反应,并为再生中的神经提供营养支持。这些策略通常并不以细胞替代为目标。周围神经中神经元的胞体位于脊髓或其近端的神经节内。施万细胞及其其他构成布恩格带的细胞展现出诱人的潜力,但如何获取这些细胞以避免免疫反应仍是需要关注的问题。电活动是功能正常的神经元的重要特征,在再生过程中对加工型移植物和/或神经进行电刺激的策略能够改进结果,并似乎延长和增强了远端神经结构支持再生的能力[45,47]。鉴于单一改进措施不太可能使加工型移植物在较长缺损修复中达到自体移植的水平,目前的研究正日益集中于将多种物理和生物学改进策略整合到单一装置中。
16.3 通过静电纺丝设计理想的神经导管
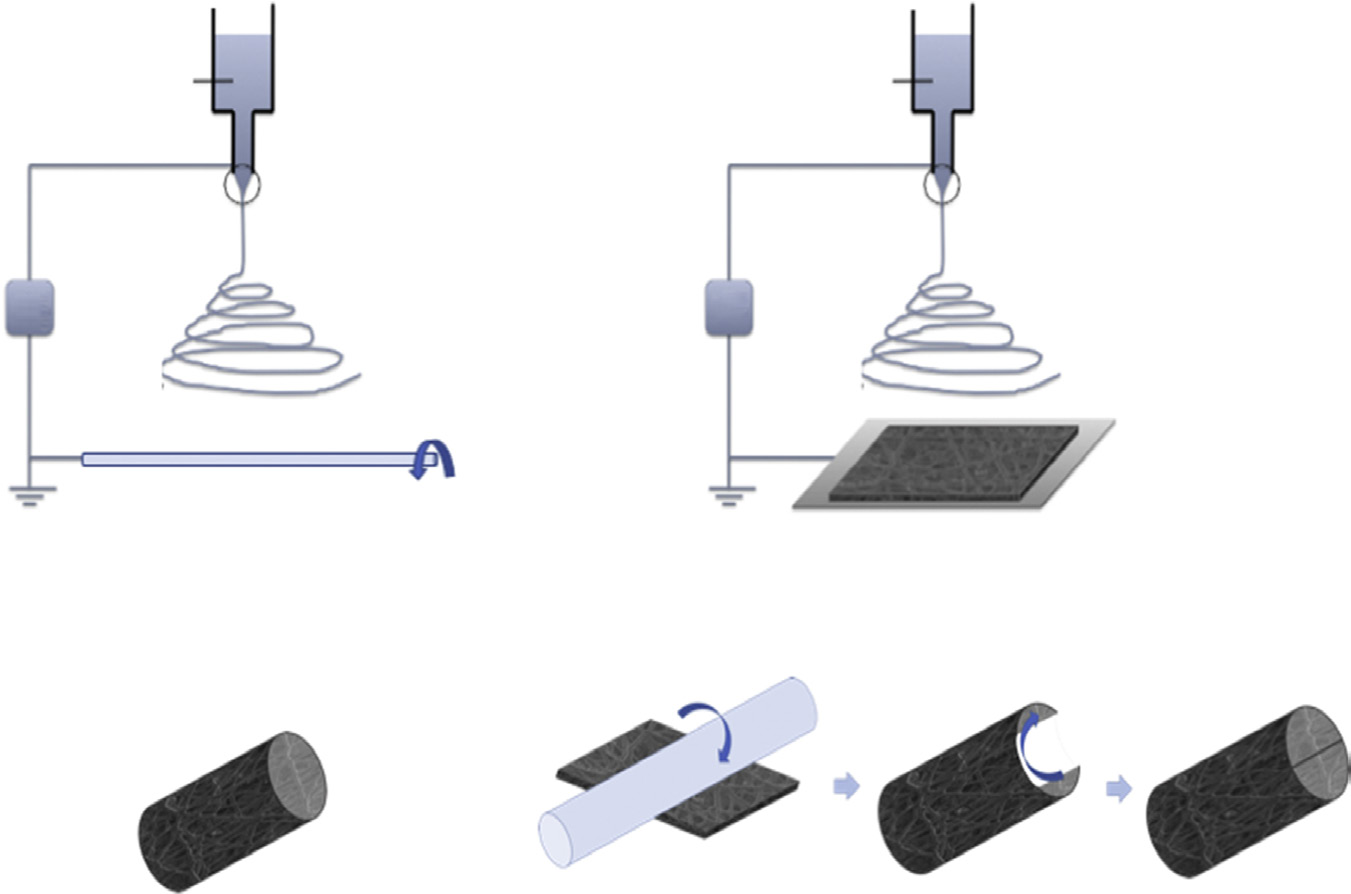
如前所述,合成神经移植物的形态学特征及其他特性(如孔隙率或孔径)可根据所采用的制备方法进行灵活调控。其中,静电纺丝已成为一种强大的技术,可用于制备能够模拟周围神经在合成移植物内适当再生微环境的3D导管。静电纺丝过程通过强电场牵引聚合物熔体或聚合物溶液的带电射流,从而形成尺寸从微米到纳米级的纤维。传统上,随机分散的纤维被收集在平板上,形成无纺布膜。通过将纤维直接收集在作为管状模板的旋转芯轴上,可制备三维纤维导管[48],如图16.2(a)所示。或者,也可采用两步法获得:先制备静电纺膜,然后将其卷绕在棒材上,并用粘合剂密封,或进一步涂覆以防止膜松脱[50],图16.2(b)。
静电纺丝导管的纤维结构保证了完全相互连通的孔隙,这对于营养交换和废物清除是必需的。然而,精确控制导管中孔径大小对于避免周围组织细胞浸润和瘢痕形成至关重要。在静电纺丝过程中,通过改变实验参数(即电压、流速、电极间距、溶液浓度和溶剂),可以轻松调节网孔尺寸、纤维直径以及纤维取向。
这种多功能性,加上能够使用多种材料以及可选择性地加入生物活性分子的特点,促使了许多研究致力于静电纺丝制备理想的神经导管。接下来,我们将概述不同类型的静电纺丝导管及其在周围神经再生中的应用。
16.3.1 单组分和多组分电纺导管
基本的静电纺丝导管由单组分、随机取向纤维制成,通过加工单一聚合物溶液获得。在大鼠坐骨神经模型中,将聚乳酸‐羟基乙酸共聚物(PLGA)的纳米纤维电纺移植物植入10毫米间隙长度。未检测到炎症反应,一个月后,十一只大鼠中有五只显示出成功的神经再生。PLGA电纺导管具有柔韧性、可渗透性,且无膨胀或断裂[51]。
静电纺丝技术的主要优势之一是能够加工不同组分的组合,从而引入其他特性或功能,以针对特定应用定制导管。最常见的是使用天然与合成聚合物的混合物,以改进缺乏细胞表面识别位点的合成电纺基材的生物活性和生物相容性。通过在旋转金属芯轴上收集随机纤维,已制备出由聚己内酯(PCL)制成的单组分电纺导管以及由PCL/明胶制成的双组分电纺导管。
已在体外和大鼠坐骨神经模型中对其性能进行了评估[48]。单组分移植物诱导了良好的神经再生,电生理评估功能恢复的结果显示复合肌肉动作电位(CMAP)的振幅和潜伏期得到改善。组织学分析显示存在血管系统和有髓轴突,这些结构负责恢复CMAP振幅。这些结果也通过损伤肌肉与健康肌肉的重量比得到了证实:在18周后,胫骨前肌(TA)和腓肠肌已恢复大部分原始质量[48]。
在双组分移植物中,纤维网为亚微米级,而PCL移植物为微米级。较小的纤维尺寸和蛋白添加在体外对细胞反应产生了积极影响,但在体内PCL/明胶导管引发了强烈的炎症反应,导致组织侵入导管管腔并阻碍轴突生长。这可能与其较低的机械性能和比单组分PCL导管更快的降解动力学有关[48]。
余等人通过静电纺丝制备了胶原/PCL神经导管,并在体外和体内进行了测试。体外实验显示,亚微米级静电纺胶原/PCL纤维促进了施万细胞黏附、延伸和增殖;而体内实验的电生理及肌肉再支配结果与自体移植相当,证明双组分导管可促进轴突再生,并成功支持成年大鼠8毫米坐骨神经缺损的神经修复[52]。
类似地,通过混合聚乳酸‐羟基乙酸共聚物和丝素蛋白制备双组分静电纺神经导管,并用于桥接Sprague‐Dawley大鼠坐骨神经的10毫米缺损。形态和功能评估结果显示其效果与自体移植相当,表明这些移植物在植入后6周可有效促进周围神经再生[53]。
共混极为常见,不仅可向合成基质中添加特定的生物信号,还可显著改进最终移植物的机械或导电性能,从而提高其性能和多功能性。
聚(d,l‐丙交酯)‐共‐聚(乙二醇)和聚吡咯(20%、30%和50%)(PELA‐PPY)在溶液中混合后通过静电纺丝制备神经导管。体外测试的样品支持大鼠嗜铬细胞瘤PC‐12细胞的附着和增殖。此外,将PELA‐PPY神经导管植入Sprague‐Dawley大鼠坐骨神经缺损(10 mm)中持续12周。电生理检查、坐骨神经功能指数、再生有髓神经纤维总数、轴突直径、髓鞘厚度以及多项免疫组织化学指标(S‐100、层粘连蛋白、神经丝蛋白、溴脱氧尿嘧啶和胶质纤维酸性蛋白)表明,与PELA神经导管相比,PELA‐PPY的结果更优,并且与自体移植结果相似。研究人员建议,较高的生物活性可能与PPY的存在有关,PPY可在细胞之间传递自身产生的电刺激[54]。
基于聚合物共混纳米复合材料的神经导管最近通过静电纺丝技术制备而成。Mohamadi 等人设计了PCL/胶原蛋白/纳米生物玻璃(PCL/胶原蛋白/NBG)导管,并利用接触角、扫描电子显微镜(SEM)、傅里叶变换红外(FTIR)、广角X射线散射和拉伸试验对其形貌、化学性质和机械性能进行了研究。样品显示出良好的孔隙率(62.5%),平均孔径为0.7 μm。拉伸试验中测得的高韧性可能与聚合物‐聚合物大分子和聚合物颗粒之间的强相互作用有关,这由FTIR分析揭示。
体外研究表明,静电纺丝胶原蛋白/聚己内酯/生物活性玻璃纳米纤维导管促进了人子宫内膜干细胞的附着和活性[55]。
通过将静电纺丝膜在不锈钢芯轴上多次卷绕,采用涂覆有聚苯胺纳米颗粒的丝素蛋白纳米纤维制备了多组分导管。在10 mm坐骨神经损伤模型中植入后,通过电生理研究和为期12个月的步态模式监测评估导管的神经再生潜力。通过对导管及再生神经进行大体检查、组织学和超微结构分析,评价横断神经的形态学再生情况。接种施万细胞的聚苯胺‐丝素蛋白纳米复合导管(接种细胞的 PASF)在植入12个月后表现出优异的神经传导速度、复合肌肉动作电位、运动单位电位、沿神经缺损处健康组织的生长以及再生轴突的厚髓鞘化,表明其具有增强的神经再生潜力。
接种细胞的PASF导管在动物中实现的功能恢复效果极佳,且优于此前使用类似导电导管所取得的结果[56]。
用于生物材料和医疗器械的电液动力技术(EFDTs)
3D导管用于周围神经再生
16.3.2 随机和优先取向结构
体内许多细胞遵循特定方向的排列模式,例如神经细胞、血管内皮细胞和肌细胞。近年来,通过不同装置制备的由取向纤维组成的静电纺丝膜因其能够在支架上对种子细胞产生接触引导作用而在组织工程中受到广泛关注[57]。
静电纺丝纤维的取向对细胞黏附和增殖的影响已被广泛研究。Gnavi等人通过调节静电纺丝过程中旋转收集器的速度,制备了随机和取向的明胶(GL)与壳聚糖(CS)纳米纤维。他们利用不同的施万细胞和神经元模型在体外评估了生物学反应,包括肌动蛋白细胞骨架组织、片状伪足和丝状伪足形成以及轴突发芽。结果表明,GL和CS纤维诱导的黏附和增殖率相似。与取向纤维相比,GL和CS随机纤维促进了更高的黏附和增殖率,而取向纤维则导致施万细胞和轴突取向生长。在此情况下,丝状伪足的形成也更高,表明取向基底比随机基底更能促进细胞迁移。这些数据表明,GL和CS纤维均可作为周围神经重建中有前景的基底材料[58]。
同样,已证明完全取向且无褶皱的PCL/明胶纤维可刺激hMSC和PC‐12细胞形成神经突并促进其延伸。精确调控静电纺丝工艺参数对于获得无缺陷的膜至关重要,因为缺陷可能改变对表面图案的识别,并影响纤维的排列优化[49]。
通过使用一种新型静电纺丝装置制备了由表面具有纵向纳米沟槽的高度取向纳米纤维构成的纤维导管。该装置包括带有金属针头喷嘴的喷丝头、高压电源以及由设置在短玻璃棒两端的两个导电磁棒组成的特殊收集器。通过连接电机的传动系统使磁铁缓慢旋转(5 rpm)。在收集纤维之前,将熔融糖浸涂于玻璃棒上形成一层薄层,以便导管能够轻易从玻璃棒上移除。随后将所得导管植入坐骨神经损伤模型大鼠体内,并与具有类似纤维取向结构但无表面沟槽的纤维导管及自体移植进行比较。电生理、步态分析、腓肠肌、三重免疫荧光和组织学分析结果表明,带有沟槽的纤维显著改进了坐骨神经再生。这一结果可能主要归因于表面沟槽形成的高度有序二级结构以及比表面积的增加。由表面具有纵向纳米沟槽的纵向取向纳米纤维制成的纤维导管可代表一种用于周围神经修复与再生的新型神经引导导管[59]。
16.3.3 多层静电纺丝导管
由取向纤维制成的电纺导管极为脆弱,在手术操作过程中易撕裂。将具有随机和取向纤维的不同静电纺丝层进行叠加,可能是获得具有各向同性机械性能导管的最佳解决方案(图16.3)。

由随机纤维制成的外层更加稳定,从而确保在再生神经达到完全功能恢复之前所需的机械稳定性。同时,管腔层沿轴向排列的纤维保证了在神经元细胞界面同时呈现拓扑和生化线索,防止神经突生长方向错误[60]。
谢等人研究了外层的随机纳米纤维是否会干扰取向纳米纤维,从而改变神经突的延伸模式并阻碍再生。他们将背根神经节(DRGs)接种在具有取向和随机聚己内酯纳米纤维的双层支架上,并评估神经突的生长情况。分别采用玻璃盖玻片和不锈钢U形框架来收集随机和单轴取向的纳米纤维。为了制备双层支架,将一层取向纳米纤维膜叠加在随机纳米纤维膜之上,并在边缘固定。然后将其包裹在金属芯轴上,并在叠加边缘处密封,以获得直径为2 mm、长度为16 mm的神经导管(NGC)。
他们观察到,底层中的随机纳米纤维对从背根神经节主体延伸出的神经突的延伸产生了负面影响,与在单层取向纳米纤维上培养的神经突相比,提供了更无序的结构。这些双层导管在大鼠坐骨神经模型中被测试其促进神经再生的能力。组织形态学分析和功能表征均表明,内表面预先接种了施万细胞(SCs)的双层神经导管(NGCs)在神经纤维数量方面可达到自体移植的54%,在最大等长强直力方面达到64.2%,在趾长伸肌质量方面达到74.9%。可以得出结论,双层神经导管在促进运动轴突再生和功能性运动恢复方面具有巨大潜力[61]。
金及其同事通过使用一种新型静电纺丝装置,成功地在一步内制备出同时具有取向和随机排列纳米纤维的膜。将铜线水平设置在旋转收集器(1000 rpm)上,并在固定铜线的垂直和水平轴向上覆盖玻璃纸胶带。通过调整玻璃纸胶带在铜线上的方向来调控纳米纤维的取向:水平方向的玻璃纸胶带附着产生垂直方向的纳米纤维取向,而垂直方向的玻璃纸胶带则产生水平方向的纳米纤维取向。纤维由PLGA和聚氨酯的共聚物制成。神经导管通过卷绕以倾斜U形制备的高度取向的纳米纤维膜而成,使其形成一种在神经导管内表面具有高度取向静电纺丝膜的新导管。随后在取向纳米纤维之上双层涂覆随机取向的纳米纤维,以增强取向纳米纤维较弱的机械强度。通过这种改进的静电纺丝装置获得的导管具备有利特性,例如选择性通透性、亲水性以及对神经生长方向的引导作用[62]。
静电纺丝技术的高度可变性使得能够制造由不同尺寸和材料的纤维组成的多层系统。Panseri等人将16号旋转铜线放置在接地靶附近,通过静电纺丝技术沉积微米和纳米纤维,以制备坐骨神经管植入物。首先沉积较大的PCL纤维60秒,随后涂覆较小的PCL/PLGA纤维120秒。导管的总壁厚约为155 μm。较大PCL纤维层确保了机械稳定性和弹性,而较小的PCL/PLGA纤维则形成了紧密的外层网状结构。样品在55°C下退火24小时真空去除可能的残留溶剂,并进一步使PCL片段结晶以增加机械强度。导管在大鼠坐骨神经模型的10毫米神经缺损中进行了体内测试。受伤动物作为阴性对照。术后四个月,对照组动物的坐骨神经未发生再生。在大多数使用双层电纺管治疗的动物中,两条切断的坐骨神经束实现了功能性的重新连接。检测到髓鞘化和IV型胶原沉积与再生纤维同时出现,且未发现明显的炎症反应。神经示踪剂证实了功能性神经元连接的重建,诱发电位结果显示出大多数治疗动物的目标肌肉实现了再支配[62a]。
16.4 导管的功能化
作为拓扑引导的取向纤维通常不足以诱导轴突延伸和刺激神经再生。快速神经突生长也起着关键作用,可通过使用功能化纳米纤维来改进,例如用生物活性分子(如细胞外基质蛋白(如层粘连蛋白和纤连蛋白)、神经活性肽(如人腱生蛋白)或生长因子(如碱性成纤维细胞生长因子、bFGF 和神经生长因子、NGF))修饰的纳米纤维。表面偶联和整体封装是功能化电纺纳米纤维的经典方法。
使用二氨基聚乙二醇和肝素作为交联分子,将bFGF和层粘连蛋白固定在PLA纳米纤维上。这些固定的因子被发现与可溶性因子一样有效,能够与取向纳米纤维协同作用,使神经突生长增强两到四倍[63,64]。
铃木等人开发了一种新型的含有甲基钴胺素(MeCbl)的静电纺丝纳米纤维膜,MeCbl是维生素B12同系物的一种活性形式,可将其局部递送至周围神经损伤部位,以药理学上促进功能恢复。他们研究了在神经损伤部位局部给予MeCbl是否能有效促进神经再生。
MeCbl在体外测试中从静电纺丝膜上缓慢释放至少8周。在体内测试中,载药电纺膜的存在未引起任何不良反应;相反,它改进了坐骨神经损伤后运动和感觉功能的恢复、神经传导速度的恢复以及髓鞘化的促进,且不影响血浆中MeCbl浓度[65]。
NGF是一种对神经元细胞存活和功能具有有益作用的神经营养因子。然而,尽管NGF在神经再生中被广泛使用,但它在体内化学不稳定且半衰期短。此外,正确剂量通常在皮克到低纳克范围,这对于避免不良副作用至关重要。NGF载体需要防止生长因子快速释放,同时还需要通过可控释放适当剂量的NGF,在相应的时间范围内支持组织再生[57]。
同轴静电纺丝是一种封装生物活性因子的智能替代方法。采用聚(L‐乳酸‐co‐Σ‐己内酯)(P(LLA‐CL))作为壳层,牛血清白蛋白(BSA)或BSA/NGF作为芯层。将静电纺丝导管植入大鼠10 mm长的坐骨神经缺损模型中。实验结果证明在聚(LLA‐CL)/神经生长因子导管组和神经自体移植组中,再生神经纤维的数量和排列、髓鞘化以及神经功能的恢复情况相似,且显著优于空聚(LLA‐CL)组或注射神经生长因子的聚(LLA‐CL)导管组。在此情况下,将神经生长因子整合入神经导管对髓鞘化和神经功能恢复均具有积极贡献[33,66]。此外,乳液静电纺丝技术已被开发用于制备核壳结构纳米纤维,以将药物、蛋白质和生长因子封装于纳米纤维内核中,作为药物递送载体[57]。胡等人通过乳液静电纺丝法制备了随机(R)和取向(A)的聚己内酯‐神经生长因子&BSA纳米纤维支架[(随机/取向)‐聚己内酯‐神经生长因子和(随机/取向)‐聚己内酯‐神经生长因子&BSA],其中神经生长因子和BSA被封装在核心,聚己内酯形成外壳。同时制备了随机和取向的纯聚己内酯、聚己内酯‐BSA和聚己内酯‐神经生长因子纳米纤维用于对比。实验分析显示,加入BSA作为稳定剂后,乳液静电纺丝聚己内酯纳米纤维中的神经生长因子在28天内实现了缓释。MTS检测表明,(随机/取向)‐聚己内酯‐神经生长因子和(随机/取向)‐聚己内酯‐神经生长因子&BSA膜有助于细胞生长,且对PC12细胞无细胞毒性。取向‐聚己内酯‐神经生长因子&BSA支架还增加了神经突的长度,并引导神经突沿纤维轴向延伸,激光扫描共聚焦显微镜图像证实了这一点,表明该静电纺丝膜具有引导神经组织生长和促进神经再生的潜力[57]。
静电纺丝神经导管不仅可以作为药物或其他生物活性分子的载体,还可以作为细胞的载体。通过静电纺丝技术制备聚己内酯/明胶(PCL/Gel)纳米纤维膜,将其缠绕在铜丝上,并用医用级粘合剂固定,制成管状生物移植物,用于桥接体内大鼠模型中的10毫米坐骨神经缺损。将人脱落乳牙来源干细胞(SHED)通过纳米纤维移植物移植至神经损伤部位。在体内实验中,分别使用静电纺丝导管以及接种SHED的静电纺丝导管处理神经缺损;未处理神经缺损作为阴性对照。通过足迹分析、足底测试、电生理学和免疫组织化学方法评估神经再生期间的功能恢复。结果表明,接种在静电纺丝移植物上的SHED能够存活并促进大鼠坐骨神经的轴突再生,因此含有细胞的生物相容性聚己内酯/明胶神经导管可支持轴突再生,是一种有前景的用于周围神经再生的组织工程移植物[67]。
16.5 电液动力学技术的结合
通过结合静电纺丝和静电喷雾,可轻松实现对静电纺丝膜的功能化。这种电液动力学技术利用与静电纺丝相同的设备,仅通过改变溶液性质或工艺参数,即可从纤维转变为微/纳米颗粒,从而制备出理想的药物载体。
与其他包封方法相比,静电喷雾是一种单阶段工艺,可实现更高的负载效率和更窄的粒径分布[68]。
与静电纺丝过程类似,静电喷雾可以通过不同的方式进行,例如混合静电喷雾、同轴静电喷雾和乳液静电喷雾。将药物共混到聚合物溶液中是最简单的将药物甚至细胞包封进静电喷雾颗粒的方法。在这种情况下,聚合物与药物之间的充分物理相互作用对于释放行为至关重要。当药物与聚合物不相容时,共混可能导致初始突释问题。同轴静电喷雾基于同轴针头的存在,不需要芯层和壳层溶液之间的相容性,因此药物可以被包封在颗粒的芯部。除了同轴静电喷雾外,乳液静电喷雾也能产生具有核‐壳结构的微/纳米颗粒。乳液在静电喷雾过程中已被证明是稳定的,并且能够形成精细的稳定射流喷雾[68]。
一种新型组织工程支架通过结合静电纺丝和静电喷雾技术制备而成,该支架具有高度取向的聚己内酯微纤维框架和嵌入BSA的聚乳酸‐羟基乙酸共聚物纳米球。取向微纤维对于引导轴突再生至最终的损伤靶点至关重要。
通过添加负载BSA的PLGA纳米球,PCL支架表面特性(如增加的纳米表面粗糙度和润湿性)得到改变,从而促进神经细胞黏附和增殖。采用该方法,神经营养因子可轻松载入PLGA纳米球内部,并实现缓释,以增强长期神经组织再生。采用同轴静电喷雾工艺制备含有1 mg/mL BSA水溶液的核‐壳PLGA纳米球,并将其喷洒到PCL微纤维膜上。作为对照,将等量的游离BSA直接喷洒到不含PLGA纳米球的PCL支架上。SEM图像显示,在可控条件下,静电纺PCL纤维形成高度取向且相互连通的多孔结构。喷涂的PLGA纳米球改善了支架的表面粗糙度。接触角从PCL的148° ± 4° 降低至含PLGA纳米球PCL的127° ± 4°,表明支架上存在PLGA纳米球可提高亲水性,可能与PLGA引入的亲水性羟基有关。更重要的是,MTS结果表明,在培养4天和6天后,与PCL支架及直接喷涂游离BSA的PCL支架相比,负载BSA的PLGA纳米球PCL支架上的神经PC‐12细胞增殖显著增加(P< 0.05)。这些支架可促进神经细胞增殖并引导其生长,同时维持神经营养因子的持续释放[69]。
16.6 微纳米技术的结合
最近,人工神经导管的设计与构建变得更加精细。人们逐渐意识到,只有结合不同的技术,才有可能满足损伤后实现完全周围神经再生所需的所有条件。
挤出聚合物纤维的编织通常用于制造具有优异机械性能、高柔韧性和显著抗扭结性的神经导管。简而言之,小直径纤维可单独使用或加捻形成多股纱线。将纤维或纱线装入编织装置的载体中,这些载体围绕中心点以交织模式移动,并将纤维缠绕在芯轴上以生成管状导管。可通过调节多个参数来改变最终影响导管性能的编织图案和角度,而芯轴直径决定了管腔直径,纤维尺寸范围则决定了管壁的厚度。编织导管的管壁通常具有不同程度的孔隙率,这可能导致纤维组织渗入导管内部,从而阻碍正常的神经再生[44]。
克莱门茨等人制备了孔径尺寸在20至140 μm之间、平均孔径为65 ± 19 μm的编织导管,易于组织浸润。他们采用静电纺丝技术在编织导管周围创建二次屏障涂层,以控制管壁的孔隙率。此外,这些导管在大鼠坐骨神经模型的临界尺寸缺损中进行了体内测试,并比较了无屏障涂层的编织导管、涂有交联透明质酸水凝胶的编织导管、在导管表面涂覆一层静电纺丝纤维的编织导管,以及静电纺丝层再覆盖透明质酸的组合结构导管的效果[44]。
同样,奎格利等人描述了一种通过结合不同制造技术制备具有可控孔径的多组分、多模式神经导管的方法。该神经导管由主套管编织成内径为2 mm的圆形管,材料为挤出聚乳酸单丝纱线。该内层为导管提供了适当的机械性能,而外层聚乳酸静电纺纳米纤维则决定了装置对神经营养因子和细胞浸润的通透性。在导管管腔内放置熔融挤出PLGA纤维,并嵌入含有神经营养因子的交联海藻酸盐水凝胶中,以促进轴突发芽和施万细胞发育。这些导管被植入大鼠体内,用于修复横断的坐骨神经,持续4周。与仅含海藻酸盐水凝胶的导管治疗的大鼠相比,使用全结构导管治疗的大鼠表现出更好的修复效果[70]。
或者,通过冷冻干燥丝/单壁碳纳米管(SF/SWNTs)并与含有纤连蛋白(FN)的取向静电纺丝纳米纤维结合,在SF/SWNT导管结构内制备多孔神经导管。在这种情况下,将冷冻干燥的SF/SWNTs用作静电纺丝过程的基底,以收集含FN的取向纳米纤维。最后,通过平头镊子手动操作将双层系统卷起,并在PBS中浸泡4小时以增加其柔韧性,从而制备成管状神经导向导管。随后将这些导管植入大鼠10毫米左侧坐骨神经缺损处。组织学分析表明,术后5周时,植入神经的近端区域发生了神经再生[71]。
16.7 结论与未来展望
本章综述了与静电纺丝技术相关的用于制备3D导管以实现周围神经再生的当前研究方法。静电纺丝导管由单组分或多组分纤维随机或取向组装而成的单层或多层系统被简要描述。还探讨了利用静电纺丝技术制造神经导管的可能性,该方法通过将静电纺丝膜与其他成熟技术(如静电喷雾、冷冻干燥、编织)相结合以实现功能增强。静电纺丝技术是开发具有定制性能的多种神经移植物的重要资源,能够满足特定的应用需求。在设计静电纺丝神经导管时,可从多个方向入手,包括选择天然或合成材料、添加特定的神经营养因子、药物或导电材料作为外部刺激以进一步促进轴突延伸,以及优化纤维排列以更好地引导再生性轴突生长。
尽管如此,仍迫切需要改进神经导管设计,因为神经再生需要多种因素的共同作用,本章对此进行了讨论。寻找更优材料的研究仍在继续。例如,如何提高静电纺丝神经导管的导电性仍是一个未解决的问题。采用压电聚合物(如聚偏二氟乙烯),通过在液相介质中激光烧蚀金属靶材制备胶体金纳米颗粒并将其添加进去,以制备复合静电纺丝纤维,可能是开发神经再生新材料的一个潜在方向[72]。




















 21
21

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








