使用银纳米线和聚二甲基硅氧烷调控粘附性的内聚型干式心电图传感器
1. 引言
可拉伸和柔性电子器件是一种目前引起大量研究兴趣的技术,特别是因为该技术具有广泛的应用前景。可拉伸和柔性电子器件可用于替代触摸屏、太阳能电池和有机发光二极管中当前使用的氧化铟锡,[1][2][3][4]可用于智能服装应用,[5]也可用于开发更有效且舒适的生物物理传感器。[6][7][8][9][10]本文提出了一种一体化心电图(ECG)传感器设计,该设计集成了柔性银纳米线电极。该传感器具有优异的电学性能,与现有心电图技术兼容,并具备长期佩戴所需的粘附性能。
当前心电图电极主要由以下几部分组成:刚性银/氯化银电极、导电凝胶和医用级粘合剂(含有导电凝胶的电极称为“湿电极”)。导电凝胶对这些湿电极至关重要,其作用主要有两个方面。首先,它降低了患者皮肤与银/氯化银电极之间的阻抗。[11][12][13]其次,通过调节皮肤‐电极界面,减少运动伪影,即当电极相对于患者皮肤滑动时在记录信号上出现的异常。[11][14][15]尽管导电凝胶对这些电极至关重要,但也存在严重缺点。凝胶会随时间干燥,不仅刺激皮肤,还会降低信号质量。[11][16] 这使得它们适用于短期使用,但不适用于长期应用。
将银纳米线网络嵌入聚二甲基硅氧烷中,为当前心电图电极技术提供了一种可行的替代方案。[8]由于嵌入聚二甲基硅氧烷中的银纳米线具有柔韧性和导电性,基于这些材料的电极能够贴合皮肤。这消除了在刚性金属电极中观察到的滑动效应会导致运动伪影。[8]因此,无需使用导电凝胶,这些“干电极”适用于长期使用。银纳米线被选为电极最合适的材料,因为与其他导电纳米线(如碳纳米管)相比,银纳米线成本更低且导电性更高,[4]并且由于此前含有银纳米线的电生理传感器已报道其不会刺激皮肤。[8]
此前,已有研究致力于开发包含柔性电极的生物物理传感器。迄今为止开发的传感器通常侧重于传感功能,但缺乏必要的粘附性能,无法在不使用魔术贴或胶带等额外粘合材料的情况下牢固地粘附于人体皮肤。那些已集成粘合机制的传感器则与当前临床心电图技术不兼容。我们在此类研究的基础上进行了拓展,开发出一种一体化原型,该原型可记录优质信号,通过可连接至商用心电图导联的定制卡扣与现有心电图技术兼容,并具备长期佩戴所需的足够粘附性。我们没有依赖可能引起皮肤刺激、残留或过敏反应的传统丙烯酸类医用胶粘剂,而是以一种新颖的方式利用聚二甲基硅氧烷的粘附性能来固定我们的电极。聚二甲基硅氧烷是理想的粘合材料,因其惰性、无毒且不会残留。
聚二甲基硅氧烷是一种由基料和固化剂组成的双组分聚合物。该聚合物通过将两种组分按特定比例混合,然后在高温烘箱中固化制备而成。通过以不同比例混合这两种组分,可以调节其不同的性能。已有充分文献记载,改变固化比例影响聚二甲基硅氧烷的性能,例如其杨氏模量以及对其他表面的粘附性。[20]对于大多数应用,如用于触摸屏或其他原型传感器,[3][9][21]聚二甲基硅氧烷通常以10份基料与1份固化剂的比例配制(10:1 PDMS)。先前的研究表明,相对于固化剂使用更高比例的基料,可通过增加聚二甲基硅氧烷表面游离寡聚物的数量来提高其对硼硅酸盐玻璃的粘附性,这些游离寡聚物可与接触聚二甲基硅氧烷的表面形成键合。[20]然而,在提高聚二甲基硅氧烷粘附性的同时,增加基料与固化剂的比例也会导致聚二甲基硅氧烷的杨氏模量降低,[20]从而产生更柔软的样品,我们观察到这类样品更容易受到损坏,例如撕裂。
我们开发的粘合解决方案包含两个部分。首先,我们采用15:1 聚二甲基硅氧烷而非传统的10:1 PDMS来制作电极本体。15:1 聚二甲基硅氧烷被确定为最佳选择,因其具备足够的机械强度,可在脱模过程中避免撕裂,同时又更柔软且柔韧。这使得电极能够更好地贴合皮肤表面的曲面轮廓,从而增大接触面积,有助于电极更长时间地保持在原位。粘附性的第二部分来自一种新颖的技术,即我们在电极的粘合面上涂覆一层薄薄的25:1 聚二甲基硅氧烷。25:1 聚二甲基硅氧烷具有足够的粘附性以固定电极(下一节报道的测试已证明),但若整个器件均由25:1 聚二甲基硅氧烷制成则并不理想,因为其本身过于柔软且易撕裂。结合使用这两种不同比例的材料,可确保电极既具备所需的机械强度(由15:1 PDMS本体提供),又具备所需的粘附强度(由25:1 聚二甲基硅氧烷粘合面提供)。
2. 结果与讨论
2.1 电极制备
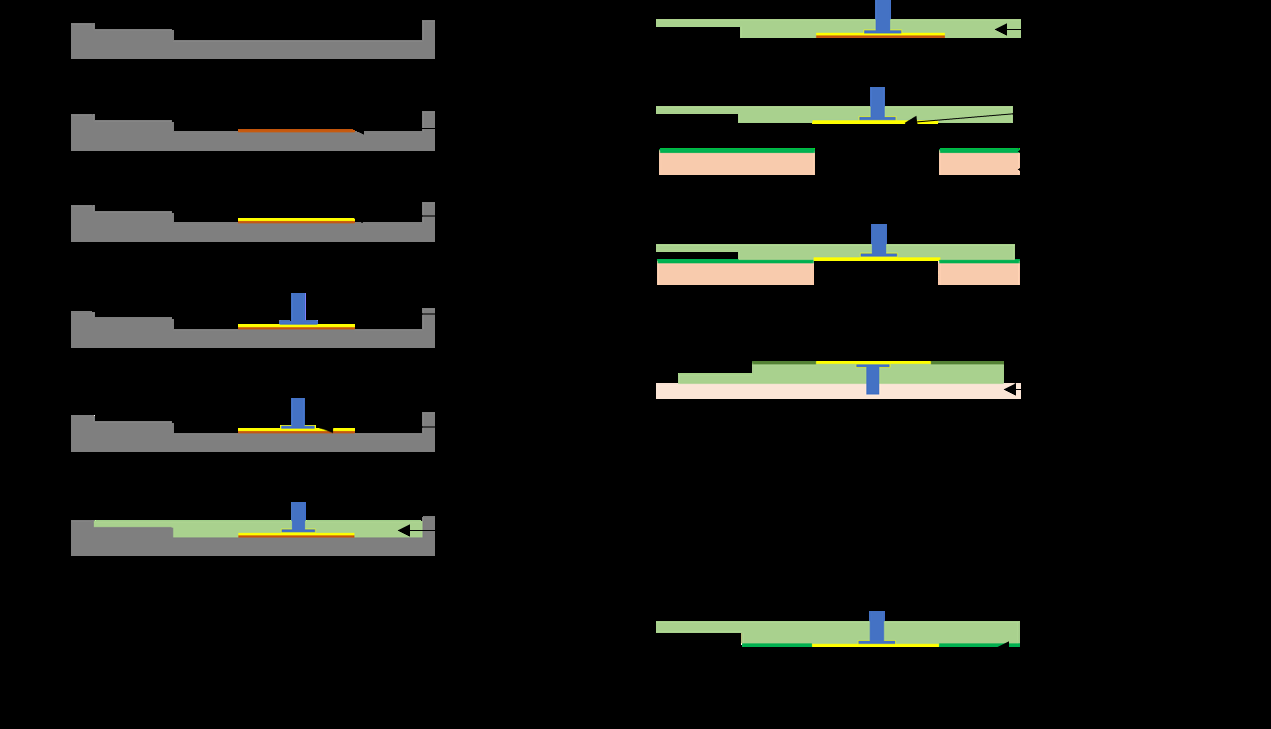
干式心电电极的制备过程如图1a所示。最终样品如图1b所示。电极呈泪滴形状,与当前市场上的产品一致。该形状是通过使用Microlution 363‐S微型铣床加工的铝制模具制成的。将一片厚度为100 μm、直径为15毫米的圆形聚酰亚胺薄膜放置在模具底部,然后用移液管将乙醇溶液中的银纳米线滴涂到聚酰亚胺上。选用聚酰亚胺是因为我们观察到银纳米线更容易从聚酰亚胺上释放,相比直接从铝制模具上释放,这提高了后续银纳米线向聚二甲基硅氧烷电极转移的比例。聚酰亚胺薄膜还有一个额外优点,即能将银纳米线限制在其表面,因为纳米线溶液会在聚酰亚胺上形成液滴而不溢出到铝制模具上,从而精确控制纳米线溶液覆盖的区域。如果没有聚酰亚胺薄膜,银纳米线会在模具中心形成不规则的形状。大约10分钟后乙醇完全蒸发,银纳米线留在聚酰亚胺表面,随后将一个定制扣件放置在银纳米线层上。该扣件设计成可与市售心电导联兼容。其设计的关键在于具有一个平坦的底部,以确保与先前沉积的银纳米线层良好接触。扣件放置到位后,再向扣件/银纳米线界面滴加更多银纳米线溶液,以确保扣件与银纳米线层之间良好的导电性。再次等待10分钟使乙醇蒸发。乙醇蒸发后,将15:1 聚二甲基硅氧烷倒入模具中,并在真空室中脱气30分钟,直至不再有可见气泡。脱气完成后,将样品置于65 oC的烘箱中固化40分钟,然后从模具中取出后,将聚酰亚胺薄膜小心地从样品上分离。为了涂覆一层薄的25:1 聚二甲基硅氧烷,将液态25:1 聚二甲基硅氧烷旋涂在带有可移除的直径为15毫米圆形塞的丙烯酸掩模上,该圆形塞尺寸与银纳米线层相同。操作时,先取下圆形塞,然后将样品轻轻浸入液态25:1 聚二甲基硅氧烷中并保持接触约10秒,随后对已附着一层薄25:1 聚二甲基硅氧烷的样品进行旋涂,以抚平该层中的不平整和波纹。旋涂完成后,样品再次在65 oC下固化40分钟。

2.2 粘附性表征
为了进行粘附测试,制备了不含银纳米线和扣件的样品。样品分别制备成有无 25:1 聚二甲基硅氧烷涂层的两种形式。这使得可以表征施加该层后粘附力的提升情况。我们通过记录从多种基底(如其他研究增强聚二甲基硅氧烷粘附性的研究)上剥离传感器时所施加的最大力来测量传感器的粘附能力。[20][22]电极测试所用的基底包括人体皮肤、丙烯酸和猪皮。实验中使用的猪皮取自当地杂货店的肉铺。将猪皮从脂肪和肌肉组织上剥离后,用万能胶粘附到铝质背衬上,使其尽可能平整。每次测试至少进行四次测量,并报告平均值。
测试期间,样品被固定在丙烯酸手柄上。使用了两种不同类型的手柄。第一种称为柔性样品,样品仅在中心处固定,从而使样品能够贴合人手腕的曲面几何形状。第二种构型是将聚二甲基硅氧烷样品固定在平面丙烯酸背衬上,以使其保持平面取向。这种刚性构型有利于与丙烯酸和猪皮等其他平面基底进行精确测量。这些构型分别如 Figure 2a和Figure 2b所示。
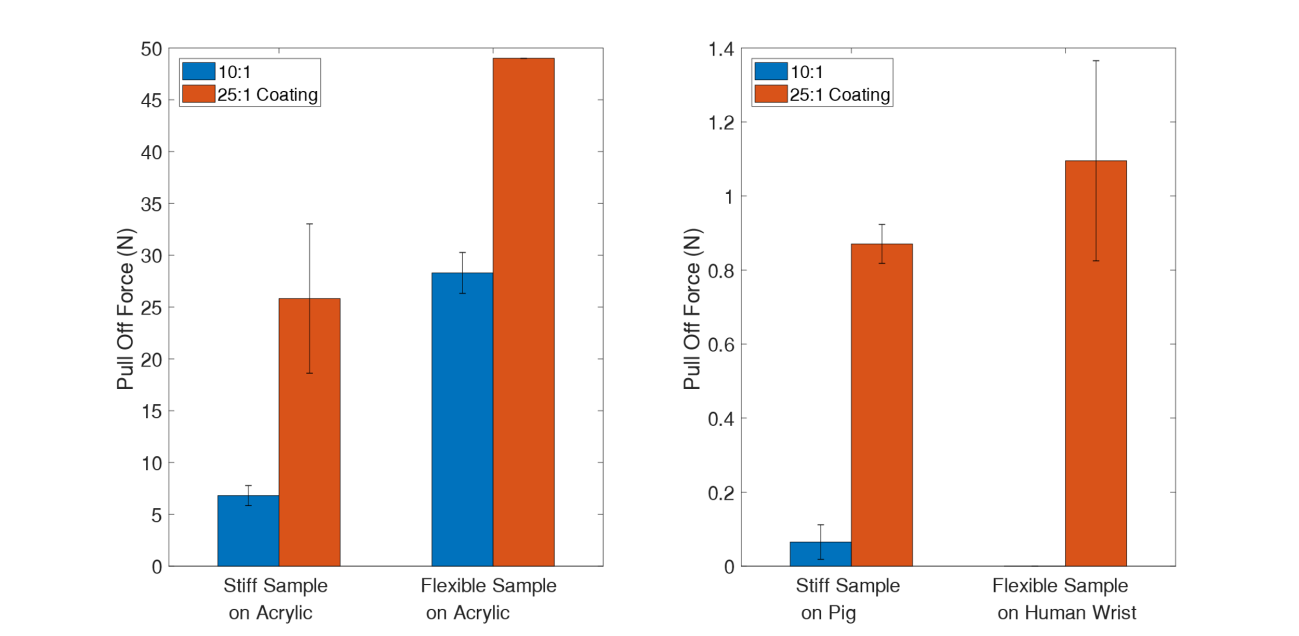
涂覆25:1聚二甲基硅氧烷的样品在人手腕上的平均最大粘附力为1.09 N,如图2c最右侧所示。这相比未涂层样品的粘附性有了显著改善,因为仅由10:1 PDMS构成且未涂覆25:1聚二甲基硅氧烷的样品对皮肤的粘附效果极差,无法保持在原位足够长的时间以测量其粘附力,往往在施加外部力之前就已自行脱落。
尽管这些未涂层样品不粘附皮肤,但它们会粘附其他基底,包括展平的猪皮和丙烯酸。猪皮上的测试采用刚性取向进行,而丙烯酸上的测试则在刚性和柔韧构型下均进行了。这三项测试的结果也汇总于图2c中。在猪皮测试中,25:1 聚二甲基硅氧烷层使粘附性从0.07 N增加到0.87 N(p值 <0.001),增幅约为12倍。对于丙烯酸,在使用刚性取向时,采用25:1 聚二甲基硅氧烷后粘附性从6.81 N增至25.82 N(p值 < 0.001),增幅约为4倍。最后,在丙烯酸基底的柔性构型下,常规10:1 PDMS的粘附力为28.29 N。当应用25:1层时,负荷传感器的5 kg量程(49.03 牛)被超过,但无论如何,这表明样品的整体粘附力再次显著增加。
总之,在10:1 PDMS上涂覆一层薄薄的25:1 聚二甲基硅氧烷不仅增强了对皮肤的粘附性,还增强了对丙烯酸和猪皮等其他基底的粘附性。这一结果具有前景,因为它表明该技术也可用作将聚二甲基硅氧烷粘附到刚性基底上的粘合解决方案,而不仅限于柔软的生物表面。
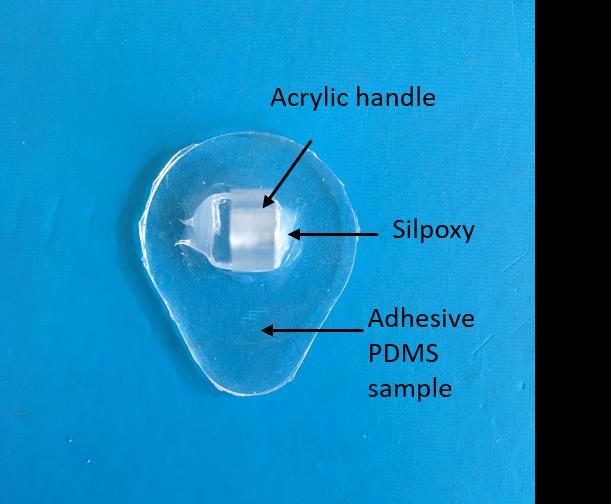
 和 b) 用于测量样品粘附性的样品。a) 展示了一个“柔韧”样品。b) 展示了一个由于平面亚克力背衬而呈“刚性”的样品。请注意,这些样品中未包含纳米线,因为它们仅用于粘附测试。c) 比较了25:1涂层样品与未涂层10:1样品在多种表面上的粘附力。)
和 b) 用于测量样品粘附性的样品。a) 展示了一个“柔韧”样品。b) 展示了一个由于平面亚克力背衬而呈“刚性”的样品。请注意,这些样品中未包含纳米线,因为它们仅用于粘附测试。c) 比较了25:1涂层样品与未涂层10:1样品在多种表面上的粘附力。)
通过研究样品粘附在身体上的时间长短,进一步表征了电极的粘附性。在上一节进行的测试中,基体为10:1 PDMS且粘合面涂覆25:1 聚二甲基硅氧烷的样品,其对皮肤的最大粘附力与基体为15:1且同样涂覆25:1 聚二甲基硅氧烷的样品相同。最大粘附强度似乎主要由25:1层决定,而表面下方的10:1或15:1基体材料对其无显著影响。然而,电极基体的组成在很大程度上决定了样品保持粘附在皮肤上的时间长短。实验中,将3个基体为10:1并涂覆25:1 聚二甲基硅氧烷的样品和3个基体为15:1并涂覆25:1 聚二甲基硅氧烷的样品粘贴于一名人体测试对象的躯干上,进行24小时观察期,以测量样品保持原位的时间。样品以对称方式粘贴,使每个10:1样品在躯干另一侧都有一个对应的15:1样品。Figure 3a显示了电极的位置及标签。在测试期间,测试对象进行正常日常活动,包括打字、书写和睡眠等静态活动,以及步行、骑车、拉伸和跳跃等轻度运动。
记录了样品脱落的时间,结果总结在图3b中。重要的是,15:1的A位置和B位置样品在整个测试期间均保持原位,10:1的A位置样品也是如此。唯一脱落的15:1样品位于位置C,在20小时37分钟时脱离。在所有三个位置上,15:1样品的表现均优于10:1,表明使用15:1材料制备样品带来了明显的益处。由于15:1 聚二甲基硅氧烷比10:1 聚二甲基硅氧烷更柔软且更柔韧,因此能更好地贴合人体几何形状。10:1 聚二甲基硅氧烷更刚性,因此与身体贴合较差,导致电极表面与皮肤接触的面积更小。观察发现,对于使用10:1 聚二甲基硅氧烷,电极边缘区域通常会随着试验的进行而从皮肤上剥离。对于由 15:1 聚二甲基硅氧烷制成的样品,其增加的柔韧性使得更多的表面保持与皮肤接触。这种增加的接触面积有助于延长粘附性持续时间。
在两种情况下均观察到,样本C从位置C处最先脱离皮肤。这表明样本的附着时间存在位置依赖性,可能与该位置皮肤所受应变的程度和频率有关。对于应变较小的部位,样本的粘附时间会更长;而身体上应变较大的部位,样本粘附时间则相对较短。由于本测试的结果表明,15:1 的样品比 10:1 的样品更持久地保持在原位,因此决定使用 15:1 的比例制备样品。采用这种 PDMS 比例替代常规的 10:1 比例,是样品粘附设计上的两项主要贡献之一;另一项贡献是在表面涂覆一层 25:1 聚二甲基硅氧烷。15:1 的电极展现出能够在躯干上持续贴附长达 24 小时的能力,使其成为心电图监测的一种可行解决方案。

2.3 银纳米线网络的表征
银纳米线网络按照第2.1节中讨论的步骤嵌入聚二甲基硅氧烷中。集成到传感器中的银纳米线网络面密度约为0.6 mg/cm²,该密度足以确保较低的传感器电阻。银纳米线心电图传感器依赖于具有优异与皮肤接触性能的高导电柔性网络。嵌入式银纳米线网络的传感器表面的扫描电子显微镜(SEM)图像如图4所示。该图像表明,银纳米线在传感器表面处随机分布。

2.4 感应性能
要成为有效的心电图传感器,皮肤与传感电极之间必须具有低阻抗。在这种情况下,传感电极是银纳米线层。对于湿电极而言,通过使用电解凝胶湿润皮肤,使信号能够从皮肤传导至固态银/氯化银电极,从而实现低阻抗。[11]在我们采用干式银纳米线电极的情况下,不存在此类电解质介质,而是通过银纳米线层与皮肤表面之间的直接共形接触来实现低阻抗。[8]
干电极的皮肤‐电极阻抗通过将电极放置在左手腕和右手腕,并使用是德 U1733C手持LCR表测量两者之间的阻抗来获得。阻抗在5个不同频率下进行记录:100赫兹、120赫兹、1千赫兹、10千赫兹和100千赫兹。电极在皮肤上持续放置六小时,在0小时、3小时和6小时分别进行阻抗测量。电极放置数小时以确保皮肤‐电极阻抗不会随时间恶化。测试结果如图5所示。0小时的测量值阻抗最高,3小时的测量值阻抗最低,6小时的测量值介于两者之间。皮肤‐电极阻抗发生细微变化的可能原因之一是皮肤水分含量的变化。水分对阻抗有显著影响,在试验过程中,由于水合水平和出汗等因素,水分含量可能发生改变。[9]尽管阻抗存在小幅波动,但该结果仍然重要,因为它表明电极的皮肤阻抗不会随时间降低,因此不会限制电极在长期使用中的适用性。
通过使用Lifepath‐C 可穿戴医疗监护仪进行四导联心电图测量,验证了电极的性能。对干式银纳米线电极进行了测试,并与当前市场上的湿电极进行了比较。图6a展示了使用粘性PDMS溶液将我们的干电极粘附在人体受试者上的情况。每组电极均在两种不同条件下进行测试,一次为受试者静坐时,另一次为受试者慢跑时。该测试结果如图6b‐g所示。包含慢跑状态下的测试是为了展示电极在受试者运动时的表现。所有信号的数据均通过可穿戴医疗监护仪的默认设置获取。
使用干电极采集的信号比使用湿电极采集的信号初始噪声更多,如图6b和6e所示,但通过在获取数据后对信号进行滤波,可以改善干电极信号的质量。最初使用萨维茨基‐戈莱滤波器对数据进行平滑处理,随后使用简单的低通滤波器去除心电图信号中常见的高频噪声。[23]滤波后,心电图信号的各个波形平滑且易于识别。图6c展示了受试者静坐时捕获的信号,滤波后信号中的噪声水平与使用商用湿电极记录的噪声水平相当。信号波形对齐良好,且无运动伪影存在。图6d显示了AgNW电极与商用电极在多个心跳周期内的信号并排对比。在此时间段内,AgNW电极的信号质量与湿式商用电极保持一致。
在图6f中,显示了受试者慢跑期间采集的数据,干电极的滤波后数据再次与湿电极的数据非常相似。信号波形对齐良好,幅度几乎相同。这表明,通过适当的滤波,干式银纳米线电极可以获得与传统湿电极相当甚至更好的信号。在图6f右侧,可在 AgNW电极信号中观察到一个可能是运动伪影的事件。图6g展示了不同电极信号在多个心动周期内的扩展对比,可以看出,商用电极获得的信号中也出现了类似的事件。与之前引入干式心电图传感电极的研究相比,[8][17]受试者慢跑时呈现的信号显示出更少的运动伪影和更少的基线漂移。
3. 结论
在本研究中,我们展示了一种使用基于嵌入聚二甲基硅氧烷中的银纳米线致密导电网络的柔韧传感电极开发的心电图传感器。该心电图传感器具有优异的传感能力,不会刺激皮肤,与当前临床心电图技术兼容,并且具有必要的粘附性能,可在无需添加胶带或其他粘性粘合剂的情况下佩戴24小时。这种粘附机制采用了一种新颖的设计,利用了两种不同的聚二甲基硅氧烷固化比例。传感器粘合面上涂覆的一层薄薄的 25:1 聚二甲基硅氧烷用于直接粘附于皮肤。该层与人体皮肤之间的粘附力为1.09 N。该传感器采用15:1 聚二甲基硅氧烷制成,取代了常规的10:1 PDMS。15:1 聚二甲基硅氧烷比10:1 PDMS更柔软,能更好地贴合身体,从而增加接触面积,因此延长了粘附持续时间。
4. 实验部分
材料 :本研究中用于制备样品的聚二甲基硅氧烷(PDMS)采用道康宁公司生产的Sylgard 184 硅橡胶弹性体套件。样品成型过程中使用的薄膜为杜邦 Kapton 聚酰亚胺薄膜。用于制备样品的银纳米线平均长度为40 ± 5 μm,平均直径为70 ± 10 nm,以5 mg/mL的浓度悬浮于乙醇中。
粘附力测试 :为了测量样品对各种基底的粘附力,首先按照第2.1节所述方法制备样品,但不包含银纳米线或扣件。样品制备完成后,使用TA.XTPlus质构分析仪进行测试。通过图2a和2b所示的丙烯酸手柄将样品连接到设备上。由于扣件会妨碍将 PDMS样品固定到丙烯酸手柄所需的设备操作,因此测试中忽略了扣件和银纳米线。使用电晕处理(Electro‐Technic 产品公司,型号 BD‐20AC)对丙烯酸手柄的粘合面以及PDMS样品的非粘合面进行处理,随后在台钳中压合20分钟,以将样品固定到刚性手柄上。柔性手柄与刚性手柄类似,唯一的区别在于柔性手柄上的丙烯酸粘合面要小得多。因此,电晕处理的强度不足以实现有效粘合,改用Smooth‐On公司生产的 Sil‐Poxy 硅胶粘合剂将样品与柔性手柄粘合。样品固定到手柄后,使用TA.XTPlus质构分析仪继续进行测试。将样品向下移动至以0.1 mm/s的速度将基底压下,直至达到14.7 kPa的压力。达到此压力后,样品保持原位20秒,然后以0.1 mm/s的速度抬起,直到样品从基底上移除。记录移除过程中测得的最大力。每种试验类型至少记录四次测量值,其平均值如图2c所示。这些测量值的标准偏差作为误差呈现。
粘附性持续时间测试 :再次制备不含扣件或银纳米线的样品。在将样品粘贴到测试对象之前,使用乙醇清洁皮肤。将样品粘贴到皮肤上后,测试对象进行包含轻度活动的正常日常活动。当样品从测试对象上脱落时,记录时间。在24小时后,试验结束,将仍附着的样品取下。
SEM成像 :使用FEI Nova NanoSEM 450和20千电子伏特的电子束获取扫描电子显微镜图像。
测量皮肤‐电极阻抗 :在此测试中,制备了全新的完整样品,如图1b所示。受试者的手腕用乙醇清洁后,每个手腕上放置一个样品,持续6小时。使用是德U1733C手持LCR表测量两个电极之间的阻抗。在每个时间点,每个频率下进行10次测量。报告的每个频率和每个时间点的阻抗为平均值,标准偏差作为误差报告。
记录心电图信号 :使用Lifepath‐C 可穿戴医疗监护仪记录心电图信号。用于获取商用电极基准的湿电极为Medi‐Trace 200泡沫心电图电极。干电极按第2.1节所述制备。报告中呈现的数据为导联1位置。使用以下方式记录的信号干电极和湿电极被分别记录为独立的试验。对于图6b‐g中所示的每次试验,均采集了 60秒的数据。
 银纳米线干式心电传感器设计
银纳米线干式心电传感器设计




















 820
820

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








