一、实验目的:
利用5mC抗体结合并沉淀具有5mC修饰的RNA片段;qPCR检测验证目标基因5mC修饰情况及具体位点。
二、实验材料
主要试剂
|
试剂名称 |
厂家 |
货号 |
|
PMSF |
Genstar |
B111-01 |
|
磷酸酶抑制剂 |
Selleck |
B15001 |
|
蛋白酶抑制剂 |
Selleck |
B14001 |
|
反转录试剂盒 |
TAKARA |
RR037A |
|
Anti-5-methylcytosine (5-mC) 抗体 |
ABCAM |
ab10805 |
|
Murine RNase Inhibitor(40 U/µL) 鼠源RNase抑制剂 |
Yeasen |
10603ES05 |
|
RNA甲基化免疫共沉淀试剂盒(Merip KIT) |
Bio.ruqi |
RQM008 |
|
qPCRmix |
Yeasen |
11202ES03 |
主要仪器及器材
|
仪器名称 |
厂家 |
货号 |
|
高速冷冻离心机 |
湘仪 |
TGL-16 |
|
PCR仪 |
BIO-RAD |
PTC-100 |
|
DynaMag™-2 磁力架 |
Thermo |
12321D |
|
荧光定量qpcr仪 |
Thermo Fisher Scientific |
ViiA7 |
|
垂直混匀器 |
Kylin-Bell |
BE-1100 |
三、蛋白与RNA信息
抗体信息:
Anti-5-methylcytosine (5-mC) 抗体
四、实验步骤
(一)RNA提取
- 样本前处理:收集 1×10^7细胞后,用预冷的 1×PBS漂洗两次,1000 rpm 室温离心 5 min,去上清;
- 向细胞中加入 1 mL Trizol 裂解,吹打至完全看不到细胞团块,室温放置 5 min;
- 按 1 mL Trizol 加入 200 μL 氯仿,盖好管盖(注意:此次一定要盖好盖子,避免震荡过程中液体渗出)。用手剧烈震荡 15 s,室温放置 3 min;
- 12000 g、4℃离心 15 min;
- 小心转移上清液(约500 μL)至新的 1.5 mL 无酶离心管中;
- 加入等体积异丙醇,室温静置10min;(若预期RNA量比较少,可加入适量糖原,并于-20℃或-80℃沉淀过夜;)
- 12000 g、4℃离心 10 min;弃掉上清,保留沉淀;
- 加入 1 mL 75%乙醇,颠倒混匀;
- 7500 g、4℃离心 5 min;弃掉上清;
- 7500 g、4℃离心 30s,用10ul小枪头尽量吸掉残留的液体;
- 室温静置5~10min,晾干乙醇;(看到RNA变半透明即可)
- 加入适量RNase-free水溶解RNA,室温静置10min,令RNA可以充分溶解;
- RNA冻存到-80℃冰箱备用。
(二)RNA片段化
1. RNA 样品中加入 等体积的frag buffer,吹打混匀;
2. 94℃孵育6min;
3. 用酚氯仿回收RNA;
4. 配制 1%琼脂糖凝胶检测 RNA 片段大小;
5. 取2 μL RNA 样品作为 Input 样品-80℃保存备用;
6. 取分别取 20 μL RNA 样品作为m6A组及IGG组。
(三)免疫沉淀
1. 5mC组及IgG组分别中加入 4μg 5mC 抗体及IgG抗体,置于垂直混匀器 4℃孵育过夜(16h)。
(五) protein A/G 与抗体结合
1. 取出protein A/G 磁珠,并充分震荡混匀;m6A组及IgG组中分别加入20ul磁珠,垂直混匀器 4℃孵育2 h;
2. 把样本置于磁力架上,静置1min,吸除上清;
3. 向EP管中加入200ul洗涤缓冲液,轻轻吹打混匀;并于垂直混匀器 4℃洗涤 5 min;
4. 把样本置于磁力架上,静置1min,吸除上清;
5. 重复3与4步骤3次。
(六) RNA纯化回收
1. input、m6A、IgG样本分别1 mL Trizol 裂解液;
2. 吹打混匀并置于垂直混匀器4℃裂解15min;
3. 按照(一)步骤,纯化回收RNA;
(六) RNA 反转录
1. 按照下列组分配制RT反应液(反应液制备请在冰上进行)。为了保证反应液配制的准确性,减少分装造成的误差,应按照比实际用量稍大的体积配制反应液,最后加入RNA样品。
|
试剂组分 |
使用量 |
终浓度 |
|
5×PrimeScript Buffer(for Real Time) |
2uL |
1× |
|
PrimeScript RT Enzyme Mix I |
0.5uL | |
|
Random 6 mers(100 μM)*1 |
0.5uL |
50 pmol |
|
RNA |
7 uL |
注意:注意反转录步骤RNA投入量按等体积进行,后续实验稀释及上机检测皆按比例进行。
2. 按如下程序进行反转录:
37℃,15min;85℃,5sec;-20℃保存备用!
3. 定量PCR检测
1) 将Mix在4℃下融解,轻柔地上下颠倒混匀并进行短暂离心。
2) 冰上配制下表中的反应液
|
成分 |
加入量 |
终浓度 |
|
Hieff qPCR SYBR® Green Master Mix (low Rox) |
5μL |
1× |
|
Forward Primer (10μM) |
0.2μL |
0.2 μM |
|
Reverse Primer (10μM) |
0.2μL |
0.2 μM |
|
cDNA |
2μL | |
|
RNase-free Water |
to 10μL |
3)将反应管进行短暂离心,确保所有反应液在反应孔底部。
4)采用三步法程序进行反应:
|
循环数 |
步骤 |
温度 |
时间 |
荧光采集 |
|
1 |
预变性 |
95℃ |
5min |
No |
|
40 |
变性 |
95℃ |
10s |
No |
|
退火 |
60℃ |
30s |
Yes | |
|
上述反应结束后,从60℃~95℃过程中进行熔解曲线分析 | ||||
5.实验结果
qPCR检测结果(详细数据见附件excel” 5mC RIP分析结果”)
5mC RIP-qPCR柱状图: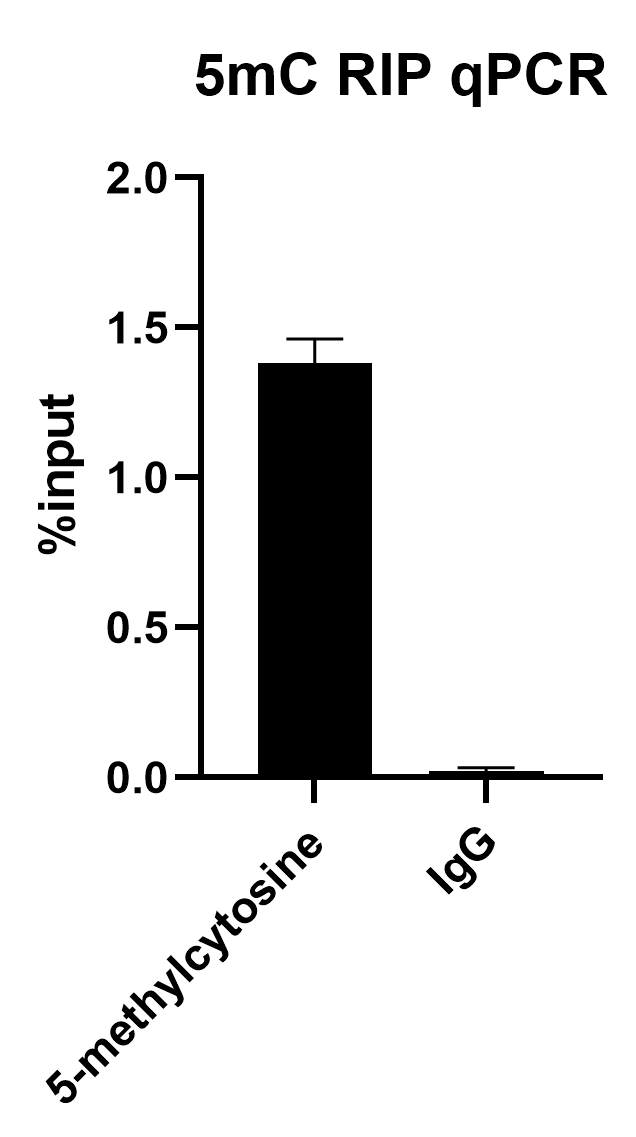
RNA 片段化图:
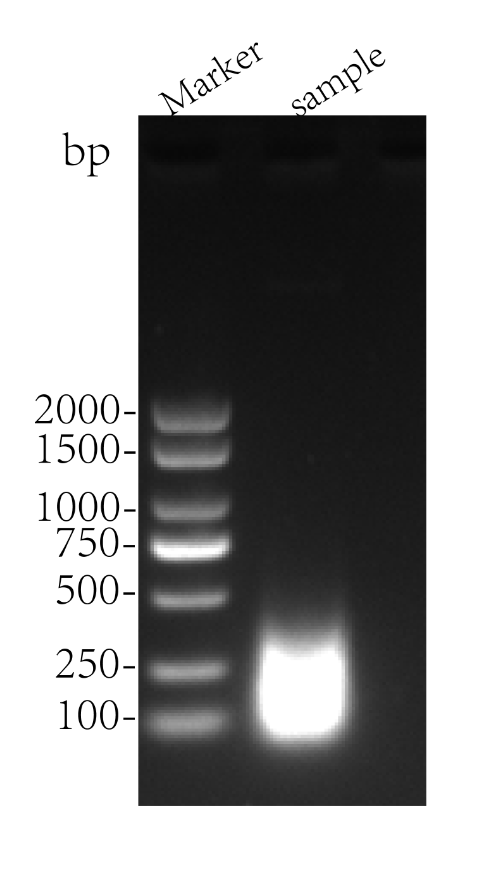






















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










