文章目录
- Moderna的《mRNAs as Medicines》课程共三章,面向所有人,无论您当前的科学知识水平如何。课程旨在为您提供对mRNA药物的全面理解,包括其工作原理及其潜在应用,视频地址。
小分子与蛋白质药物:传统医药的基石
模块概述

- 学习了蛋白质和mRNA的结构、合成方式及其在体内的作用。本模块将探讨:
- 经典药物的特性
- 技术进步如何扩展了药物选择
- 重新思考药物的可能性
- 核心问题:蛋白质和mRNA如何作为药物使用?
药物的定义
法律定义
药物(或称药品、药物制剂)是指:
“旨在用于疾病的诊断、治愈、缓解、治疗或预防的物质”
小分子药物
1. 常见形式
- 日常服用的药片
- 活性成分通常为小分子
2. 物理特性
- 尺寸:远小于蛋白质或mRNA
- 尺度:相当于单个氨基酸或核苷酸构件
- 穿透能力:许多小分子能轻松穿过细胞膜,在体内发挥作用而无需特殊递送系统
3. 主要优势
- 稳定性:
- 多数可制成固体剂型
- 在室温下长期稳定
- 给药便利性:
- 多数可口服
- 经消化系统溶解后可分布到全身(有时包括大脑)
4. 常见类型
- 抗生素:如青霉素
- 止痛药:如布洛芬、乙酰水杨酸(阿司匹林)
- 其他广泛用途:
- 治疗花粉症、恶心
- 降血压、降胆固醇药物
- 精神疾病治疗药物(如抑郁症、精神分裂症)
5. 局限性
- 研发过程复杂:
- 初期需筛选数万种化合物
- 需要数年的药物化学优化,将初步"命中"化合物改造为有效药物
- 靶点限制:主要针对细胞表面或细胞内的特定分子靶点
核心要点:小分子药物因其稳定性、口服便利性和组织穿透能力,已成为最常用的药物形式。然而其研发周期长、筛选难度大,且对某些疾病靶点难以发挥作用,这促使了新型药物形式的发展。
蛋白质药物:治疗性生物制剂与疫苗
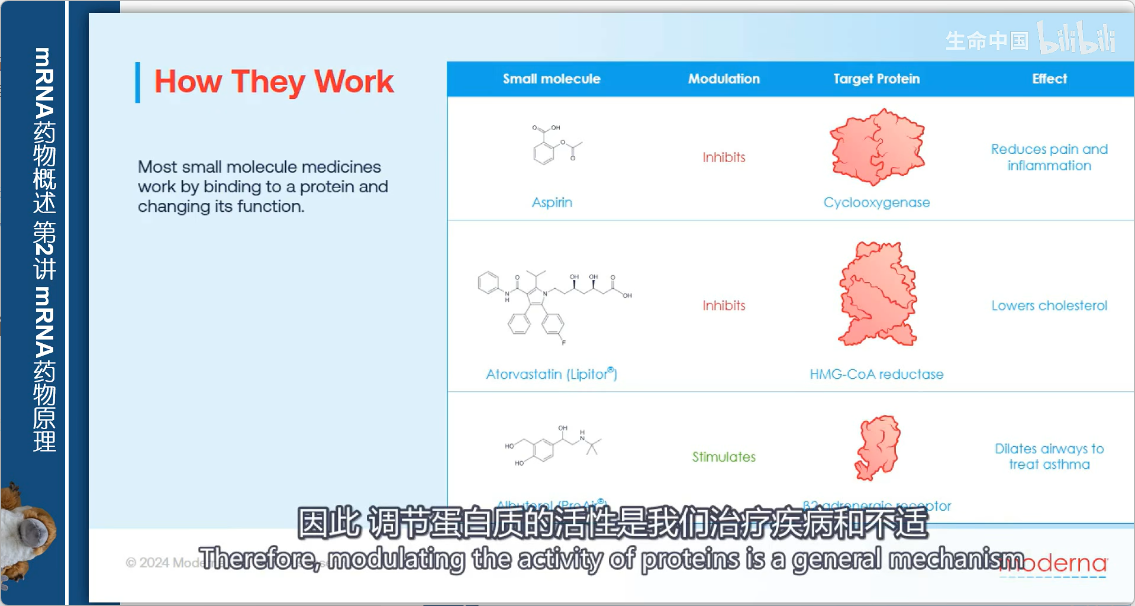
小分子药物的作用机制
- 核心原理:与特定蛋白质结合并改变其功能
- 作用方式:
- 抑制型:减慢或完全抑制靶蛋白功能
- 激活型:增强靶蛋白功能
- 通用策略:通过调节蛋白质活性来治疗疾病
小分子药物的研发挑战
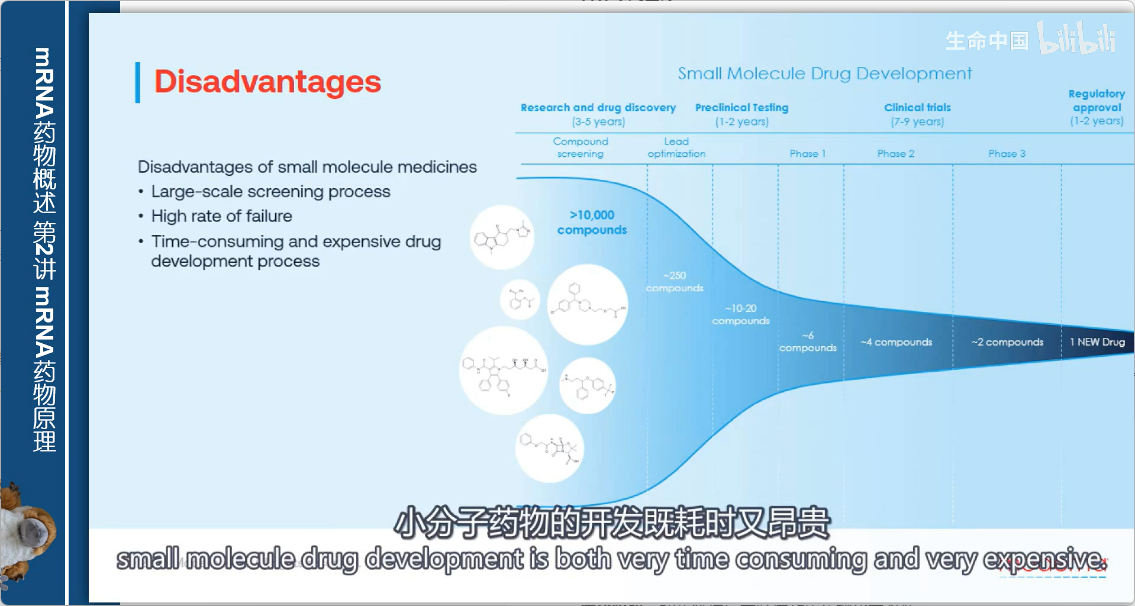
1. 复杂的研发流程
- 优化阶段:初步筛选后需经过数年药物化学改造
- 验证阶段:还需数年的临床前和临床研究来证明安全性和有效性
2. 高失败率
- 大多数小分子在研发过程中因以下原因被淘汰:
- 意外的毒性
- 缺乏疗效
3. 成本与时间
- 由于需要筛选大量化合物且失败率高
- 小分子药物开发既耗时又昂贵
蛋白质作为药物
1. 治疗性蛋白质(蛋白生物制剂)
- 已成为重要的药物类别
- 作用位置:绝大多数在血液中发挥作用
2. 主要类型与应用
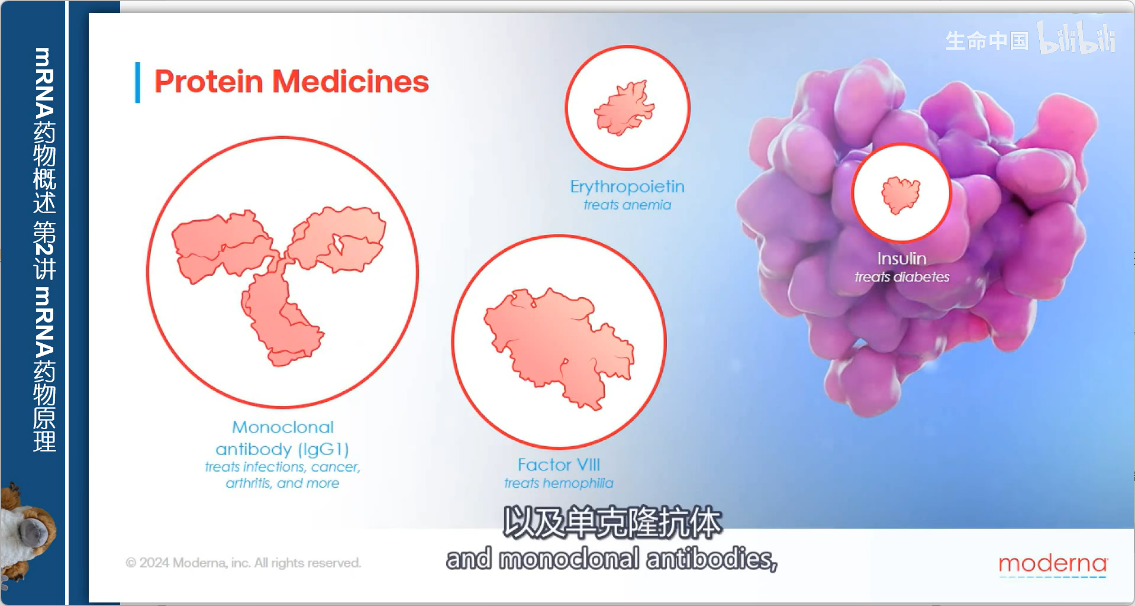
- 胰岛素:治疗糖尿病
- 凝血因子:治疗血友病
- 促红细胞生成素:治疗贫血
- 单克隆抗体:
- 应用广泛:从抗病毒感染到癌症、关节炎治疗
- 批准速度:2015-2020年间,FDA每年批准约10种新单克隆抗体药物
3. 蛋白质亚单位疫苗
- 来源:病毒或细菌的特定蛋白质
- 用途:预防未来感染
- 安全性优势:
- 仅包含病原体的一小部分
- 不可能引起疾病
- 作用机制:预先激活免疫系统,使其能识别并应对特定病原体
蛋白质药物的局限性
尽管具有显著优势,蛋白质药物也存在明显限制
蛋白质药物的局限性与mRNA药物的机遇
历史教训:早期蛋白质药物的风险
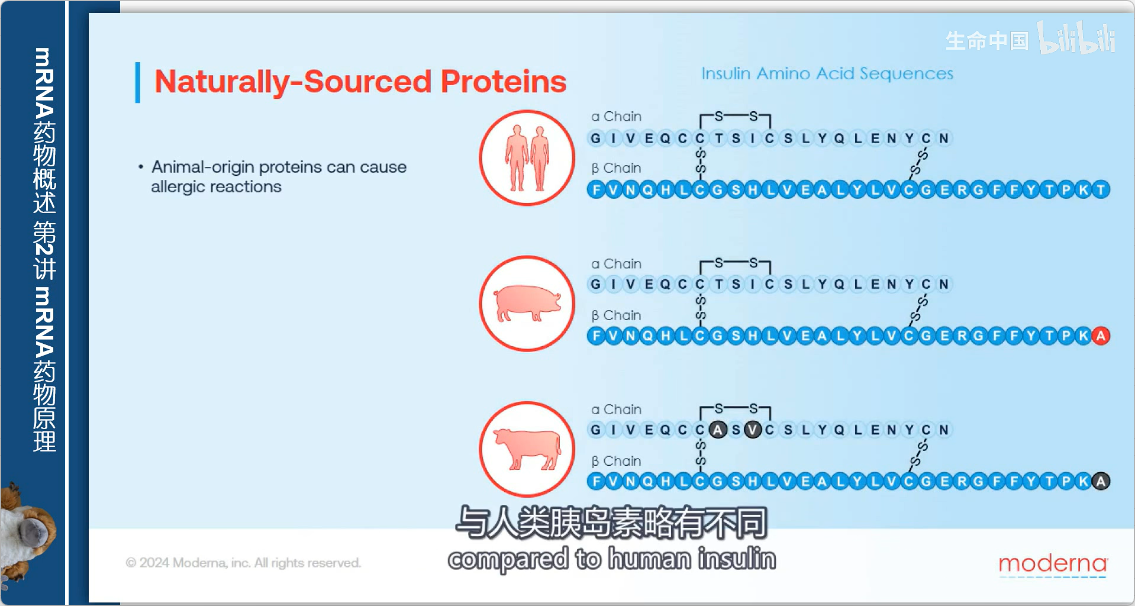
1. 胰岛素的问题
- 早期来源:从动物体内纯化
- 主要缺陷:
- 氨基酸序列与人类胰岛素略有不同
- 容易引起患者过敏反应
2. 血友病治疗的悲剧
- 早期治疗:使用从捐赠人血中纯化的凝血因子
- 严重后果:
- 1960年代:数千名患者感染乙肝
- 1980年代:数千名患者感染艾滋病
- 改进时间点:
- 1969年实施乙肝筛查
- 1985年实施HIV筛查
现代生产方法
1. 重组技术
- 当前主流:大多数治疗性蛋白质使用基因工程改造的哺乳动物细胞系生产
- 术语:“重组”(recombinant),意为"新的组合"
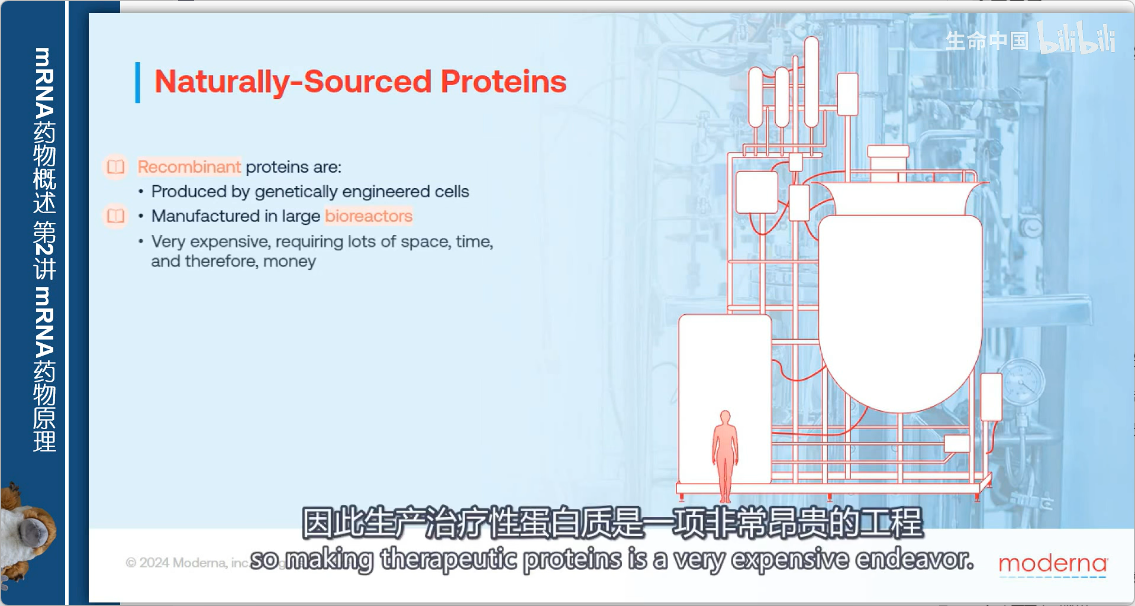
2. 生产过程
- 培养设备:大型不锈钢生物反应器
- 基础设施要求:
- 需要重大工业设施
- 维持细胞存活
- 防止污染
- 成本:非常昂贵
蛋白质药物的技术挑战
1. 稳定性与配方
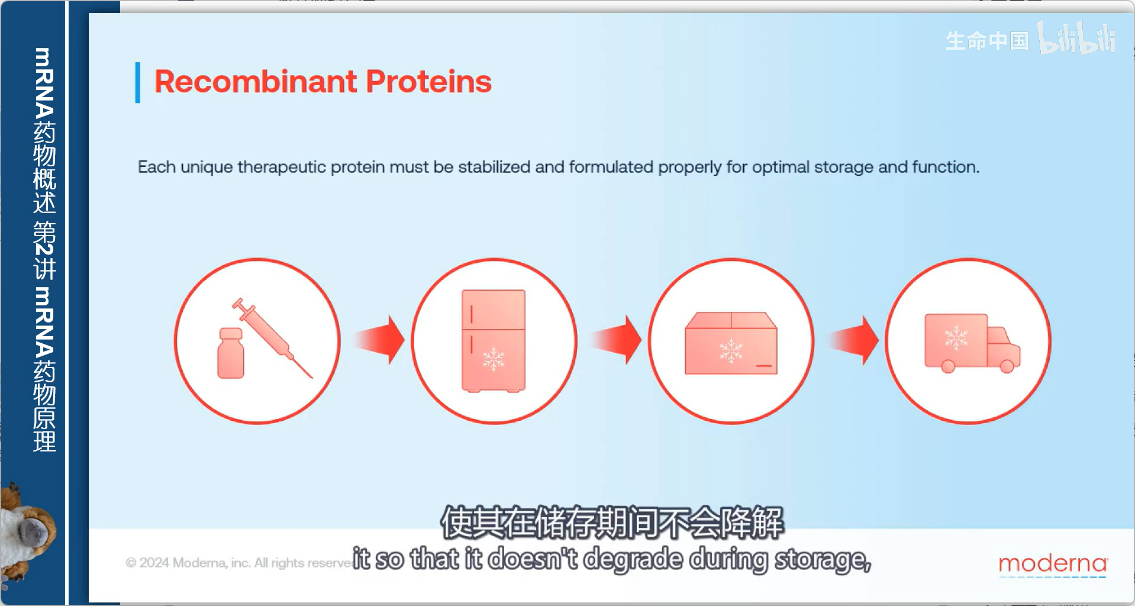
- 每种治疗性蛋白质都是独特的
- 需要大量工作来确定最佳的稳定和配方方案
- 目标:
- 防止储存期间降解
- 确保注射后能按预期功能发挥作用
2. 递送限制
- 大多数蛋白质难以进入细胞
- 作用范围受限:
- 主要在细胞外(如血液中)
- 或在内吞体、溶酶体等特殊细胞区室中
3. 靶点局限性
- 超过90%的人类蛋白质位于:
- 细胞内部
- 细胞膜上
- 这意味着传统蛋白质药物无法有效靶向这些重要位置的蛋白质
mRNA药物的创新思路
核心理念
- 传统方式:向人体提供预先制造的蛋白质
- mRNA方式:仅提供制造蛋白质的指令(即mRNA)
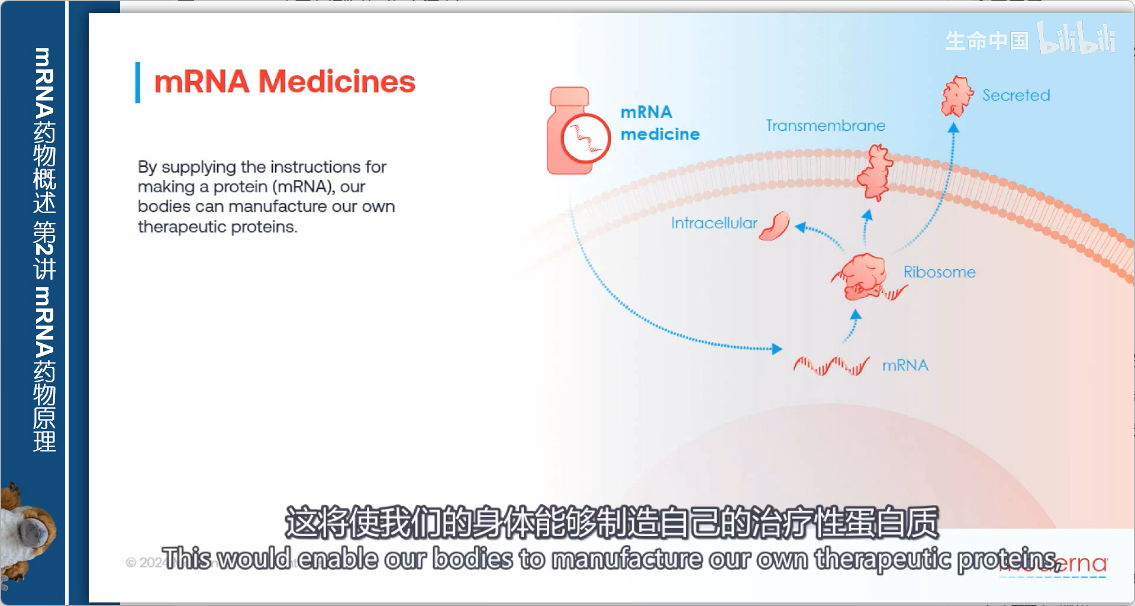
优势
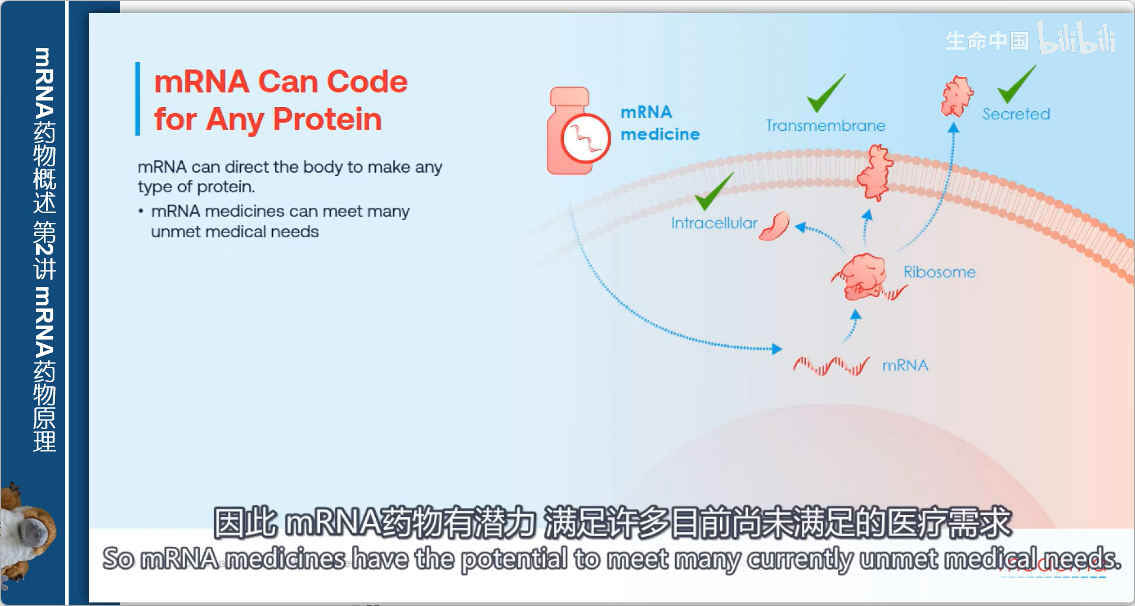
通过在细胞内生产蛋白质,mRNA技术使任何类型的蛋白质都可能成为药物:
- 细胞内蛋白
- 膜结合蛋白
- 分泌蛋白
这突破了传统蛋白质药物只能作用于细胞外环境的限制。
实现难度
- 理论看似简单,实则复杂
- mRNA作为药物的能力是近年才实现的
- 依赖于学术界和产业界研究人员数十年的努力
- 后续课程将探讨开发mRNA药物需要克服的多重障碍
理想药物的三大特性

理想的药物应具备:
- 剂量依赖性:效果随剂量变化
- 时效限制性:作用时间有限
- 可重复给药:可多次使用
传统小分子和蛋白质药物都具备这三种特性。时效限制性尤为重要——若出现副作用,停药即可。
mRNA的内在特性分析
1. 固有的瞬时性
- 与DNA对比:DNA是遗传信息的永久存储库
- 蛋白质和mRNA:本质上都是短暂存在的
- 大多数蛋白质处于持续更新状态
- 具有有限的生命周期,需要定期补充
- 编码它们的mRNA也不断被制造和降解
2. 生物学意义
这种动态平衡使身体能够:
- 快速改变关键蛋白质的数量
- 及时响应环境变化
案例研究:昼夜节律钟
- 核心组件:“时钟蛋白”(clock proteins)
- 周期规律:每24小时精确地出现和消失
- 调控方式:通过每日循环的时钟mRNA生成与降解来实现
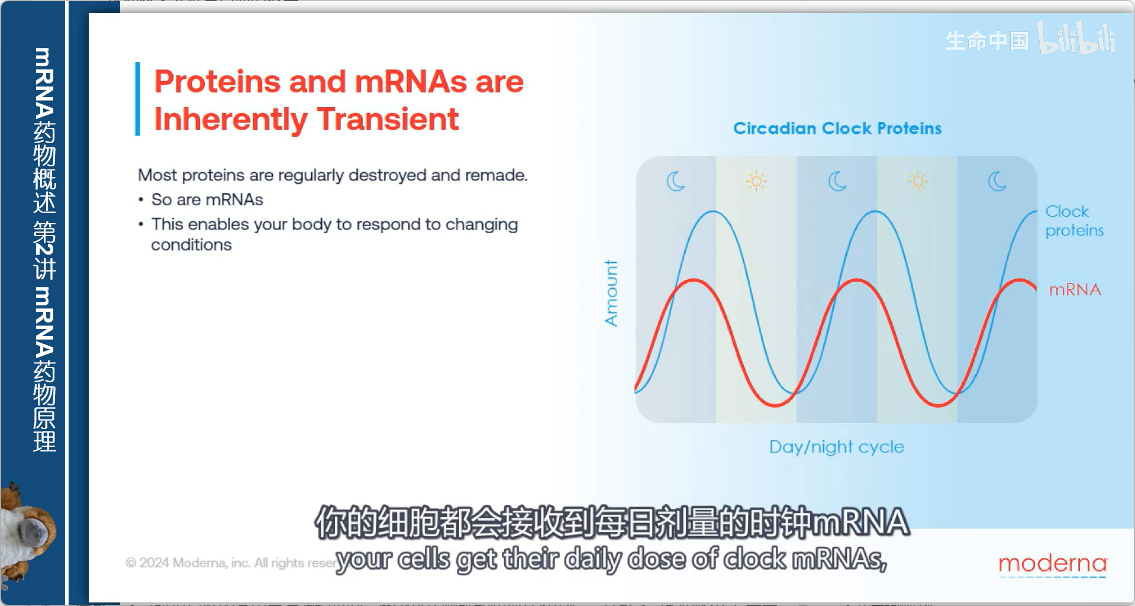
- 蛋白质产量与同时存在的mRNA量紧密相关
- 每天重复这一过程,为身体提供"日常剂量"的时钟mRNA
半衰期的概念
- 定义:半衰期是指某种物质生成后,其一半数量消失所需的时间
- 用途:衡量蛋白质和mRNA在细胞内存在时间的常用指标
蛋白质半衰期的多样性
1. 长寿命蛋白质
- 结构蛋白:通常寿命最长
- 晶状体蛋白(Crystalline):
- 眼睛晶状体中的蛋白
- 半衰期超过70年
- 一旦形成便不可替换,需维持终生
- 晶状体蛋白(Crystalline):
- 抗体:
- 半衰期10-21天
- 属于较长寿命的蛋白质
- 巨肌蛋白(Titin):
- 尽管是巨大蛋白质
- 半衰期仅3天
2. 中等寿命蛋白质
- 代谢酶类:
- 如葡萄糖-6-磷酸酶(Van Gerke病中缺失的蛋白)
- 半衰期8-48小时
3. 短寿命蛋白质
- 信号蛋白:
- 如松弛素(relaxin)激素
- 半衰期<10分钟
4. 总体分布
- 蛋白质半衰期跨度极大:从几分钟到数十年
- 中位数:约30小时(略超过一天)
mRNA的半衰期特征
1. 总体特性
- mRNA的寿命远不如蛋白质长
- 典型人类mRNA:半衰期仅5小时
2. 变异范围
- 最短:仅几分钟
- 最长:约5天
- 整体覆盖一个广泛的动态范围
mRNA作为药物的理想特性
mRNA的天然药物属性
1. 固有的瞬时性
- 关键事实:没有mRNA会持续终生
- 设计原理:短暂存在是为了让身体能够按需制造适量的蛋白质
2. 三大经典药物特性
mRNA天然具备理想药物的全部三个基本属性:
- 瞬时性:效果不会永久持续
- 剂量依赖性:mRNA剂量与编码蛋白产量呈正相关
- 可重复诱导:可多次给药,反复产生蛋白质
这使mRNA成为符合理想药物标准的完美候选者。
mRNA药物的额外优势
1. 全能蛋白生产平台
- 能指导身体制造任何类型的蛋白质
- 不仅限于细胞外作用的蛋白
- 可靶向细胞内、膜结合和分泌蛋白
2. 微型化生产基础设施
- 对比传统蛋白药物:
- 重组蛋白需要大型生物反应器和哺乳动物细胞培养
- mRNA生产无需细胞培养系统
- 生产方式:完全基于化学、生物化学和生物物理过程
- 设备特点:
- 设备相对小型化
- 可移动
- 生产设施高度灵活适应
3. 生产成本与规模优势
- 所需基础设施和设备相对简单
- 制造成本显著降低
- 易于扩大或缩小生产规模
治疗潜力广泛
mRNA技术有望满足多种未被满足的医疗需求,包括:
- 快速疫苗开发:针对新出现的病原体迅速开发疫苗
- 癌症免疫治疗:激活免疫系统对抗癌症
- 遗传代谢病治疗:恢复患者制造缺失蛋白质的能力
全球化生产网络
1. 分布式制造
- mRNA药物生产设施可轻松在世界各地多个地点建立
- 关键优势:实现本地化生产和快速分发
2. 数字化传输
- mRNA本质上是核苷酸序列信息
- 一旦成功开发新mRNA药物(如针对新发传染病的疫苗):
- mRNA序列可通过数字方式即时发送到所有生产基地
- 实现全球同步的本地合成和分发
3. 未来微型化
- 随着技术进步
- 可能将整个生产过程缩小到单个台式设备中完成
mRNA作为信息分子的独特性
核心特征
- 非直接活性药物:mRNA本身不是治疗物质
- 角色定位:是指导身体制造治疗性蛋白质的"配方"
平台化优势
当药物开发者掌握了:
- 临床级mRNA的生产和制剂技术
- 将mRNA靶向递送到特定细胞类型的方法(如:
- 疫苗:免疫细胞
- 代谢疾病治疗:肝细胞)
即可通过简单替换mRNA序列来创建新型药物,例如:
- 从一种疫苗快速转换到另一种疫苗
- 从一种治疗药物转换到另一种治疗药物
mRNA:真正的平台技术
1. 平台定义
根据Techopedia.com,平台是:
“一组作为基础的技术,用于开发其他应用、流程或技术”
2. 类比智能手机
- 我们身边的平台:智能手机
- 手机硬件 + 操作系统 = 平台
- 平台支持无数应用程序的快速开发
3. mRNA药物平台构成
- 硬件:mRNA药物生产设备
- 操作系统:不同规模下生产mRNA药物的工艺和技术诀窍
- 核心优势:
- 同一类型的mRNA药物使用相同的原材料和生产工艺
- 新药开发几乎无需重新设计
- 极大加速"应用程序"(即具体mRNA药物)的开发时间线
多重化优势
- mRNA药物可轻松实现多重化(multiplexing)
- 单次给药可同时递送多种mRNA
- 为联合治疗和多价疫苗提供了可能
多重化治疗潜力
1. 同时递送多种mRNA
- 单次给药可同时递送多种mRNA分子
- 为身体提供指令,使其同时制造多种不同蛋白质
2. 应用场景
- 多蛋白复合物:
- 某些蛋白质以多蛋白复合物形式发挥作用
- 可同时递送编码复合物各组分的mRNA
- 实现完整复合物的体内合成
- 联合疫苗:
- 将编码不同病原体蛋白的mRNA疫苗组合
- 单次注射即可预防多种传染病
这一特性极大地扩展了mRNA药物的治疗范围和效率。
mRNA药物的技术挑战与体外生产
核心原理回顾
- mRNA药物通过利用人体自然的蛋白质生产过程
- 使人体能够自行制造治疗性蛋白质
首要挑战:体外mRNA生产
1. 自然过程 vs. 工业需求
- 体内过程:在细胞核内从DNA转录产生mRNA
- 工业需求:需要在细胞外(体外)大量生产mRNA
2. DNA模板的制备

- 载体构建:将特殊修饰的DNA片段插入细菌
- 扩增复制:利用细菌繁殖产生大量DNA拷贝
- 纯化分离:仔细分离并纯化扩增后的DNA
3. mRNA合成过程(纯生化反应)

- 线性化:用特殊的"分子剪刀"切割DNA模板,使其线性化
- 体外转录:
- 将线性DNA与核苷酸混合
- 加入特殊的T7 RNA聚合酶
- 聚合酶按正确顺序连接核苷酸,生成mRNA
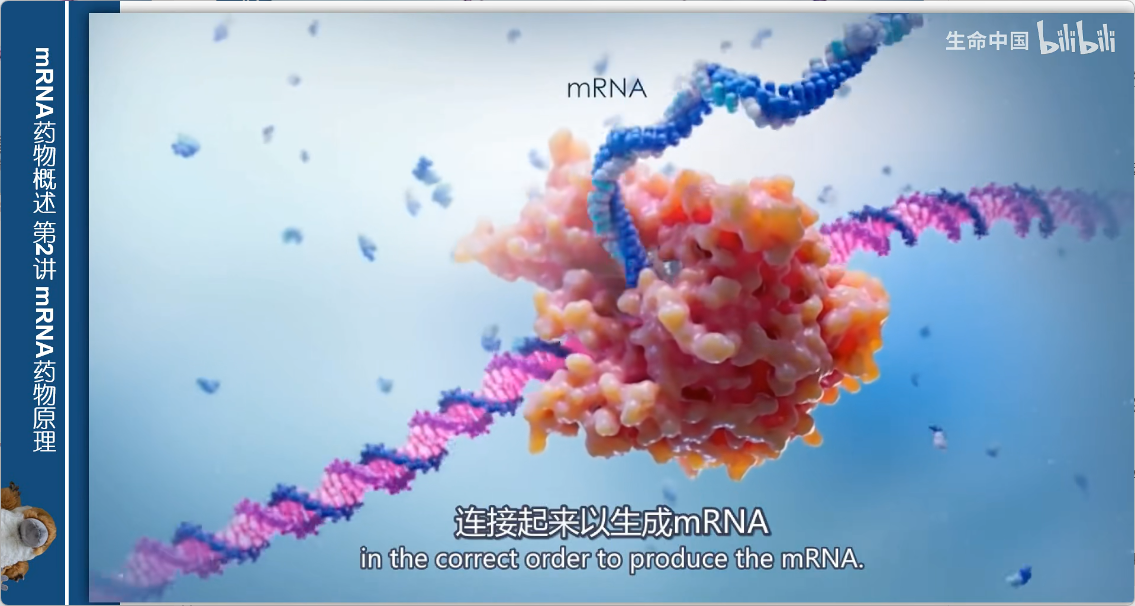
关键特点:此过程完全无细胞(cell-free),仅依赖生化反应,为后续大规模生产奠定了基础。
-
灵活的生产规模,mRNA合成反应可在多种规模进行:
- 研究级:微量用于实验室研究
- 个体化医疗:单个患者的用量
- 罕见病治疗:数十至数百名患者的用量
- 大规模疫苗生产:单批次可生产数千万剂mRNA疫苗

-
质量控制,纯化后的mRNA需经过多重质控步骤,确保:
- 完全去除DNA残留
- 去除所有未反应原料
- mRNA分子完整性达标
mRNA递送挑战
1. 无法单独给药
mRNA不能直接作为药物使用,因为人体存在多重生物屏障:
2. 给药途径限制
- 口服不可行:会被视为食物立即分解
- 主要给药方式:
- 疫苗:肌肉注射
- 治疗药物:静脉注射(IV)
- 新兴途径:
- 鼻腔/肺部吸入(通过吸入器)
- 皮肤直接应用

3. 生物稳定性问题
- 体内环境:mRNA通常不存在于细胞外
- 免疫识别:血液或淋巴系统中的裸露mRNA会被识别为:
- 死亡细胞碎片
- RNA病毒感染证据
- 快速降解:体液中的"清洁"蛋白会迅速破坏裸露RNA
4. 靶向性缺失
- 无导航系统:mRNA分子本身不含靶向特定组织或细胞的信号
- 无法跨越细胞膜:
- mRNA带高度负电荷,难以穿过细胞膜
递送解决方案:载体系统
由于上述所有原因,mRNA药物需要递送载体——一种包装材料,必须实现三个关键功能:
- 保护:防止mRNA在到达目标前被降解
- 靶向:帮助mRNA找到并进入目标细胞
- 穿透:协助mRNA跨越细胞膜进入细胞质
脂质纳米颗粒(LNP)作为主要递送系统

- 尽管多种递送载体正在测试中 最常用的是脂质纳米颗粒(LNPs)
LNP的结构与组成

1. 核心结构
- 内部:包裹着mRNA货物
- 外部:由脂质(脂肪)构成
- 脂质是构成所有细胞膜的基本成分
- 具有疏水性(不溶于水)
- 自然形成脂质双层或球形结构
- 本质:极微小的"脂肪球"
2. 关键挑战:如何将mRNA包裹在脂肪球内?
- 问题根源:mRNA因其磷酸骨架带有高度负电荷
- 传统方案缺陷:
- 使用永久带正电荷的脂质可吸引mRNA
- 但这类脂质对身体耐受性差
3. 创新解决方案:可电离脂质
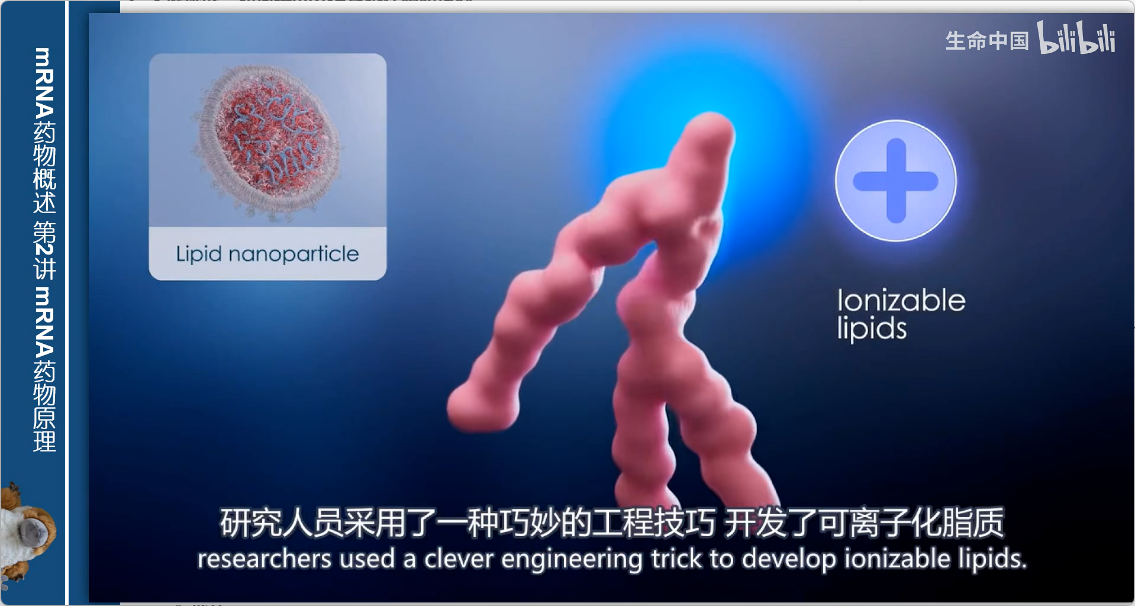
- 设计原理:
- 在酸性条件下带正电荷
- 在生理pH值(接近中性)下变为不带电
- 工作过程:
- 酸性环境下:带正电的可电离脂质包裹带负电的mRNA
- 进入体内后:转变为中性,减少毒性
- 优势:既保证包装效率,又提高生物相容性
4. 增强稳定性结构
- 问题:可电离脂质与mRNA的结合不够稳定
- 解决方案:添加额外保护层
- 成分:
- 双层磷脂(phospholipid)
- 间杂胆固醇
- 生物学意义:
- 磷脂双层和胆固醇都是人体细胞膜的重要组成部分
- 提高LNP的稳定性和生物相容性
- 成分:
结构验证
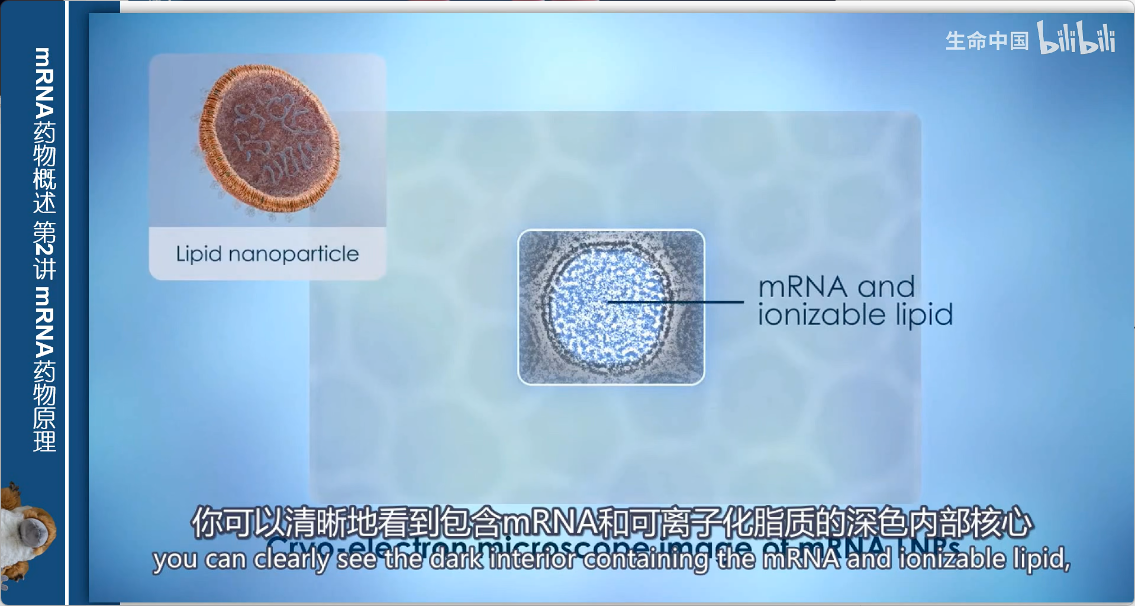
- 冷冻电镜图像清晰显示:
- 深色核心:包含mRNA和可电离脂质
- 外围结构:包围核心的脂质双层膜
LNP的基本参数
1. 载体容量
- 每个LNP包含4-6个mRNA分子
2. 尺寸要求
- 理想直径:80-100纳米
- 约为人发宽度的1/1000
- 数量级:每剂mRNA疫苗包含数万亿个LNP
- 尺寸重要性:特定尺寸范围有利于细胞高效吸收
稳定性保护机制
1. 融合问题
- LNP是软性材料
- 储存时若相互接触会融合,形成越来越大的"脂肪球"
2. 防融合解决方案:表面活性剂
- 功能:防止LNP在储存期间相互融合
- 常用物质:聚乙二醇(PEG)
- 广泛用于FDA批准的药物
- 存在于化妆品、牙膏等非处方产品中
- 作用机制:
- PEG涂层在LNP碰撞时保持脂质双层分离
- 有效防止融合
体内靶向机制
1. 生物识别
- 类比:HDL和LDL(脂质转运复合物)
- 在血液中运输脂肪
- 相似性:LNP在人体看来非常类似于天然脂质转运复合物
2. 靶向工程
- 不同脂质转运复合物对特定组织/细胞有亲和力
- LNP可被设计成具有特定组织/细胞亲和力

细胞内递送过程
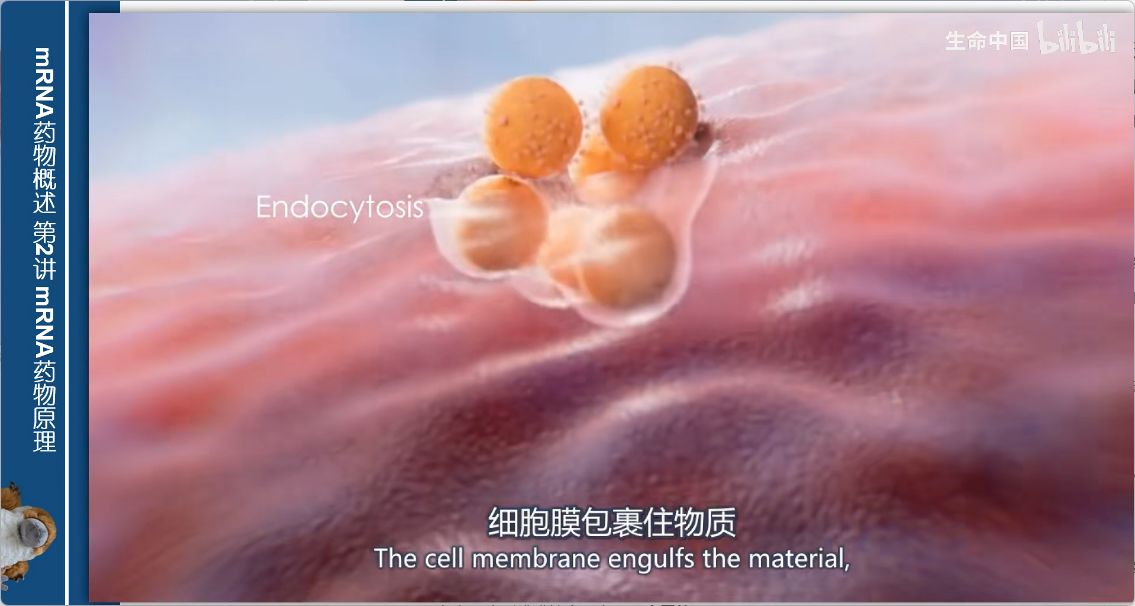
1. 细胞摄取
- 机制:内吞作用(endocytosis)
- 过程:
- 细胞膜包裹LNP
- 向内凹陷形成膜结合区室——内吞体(endosome)
2. 最终释放
- 关键步骤:LNP与内吞体膜融合
- 结果:将mRNA释放到细胞质
- 后续:mRNA与核糖体结合并翻译成蛋白质
LNP成分的生物降解
1. 磷脂和胆固醇
- 来源:是人体细胞膜的正常组成部分
- 代谢方式:像体内其他脂质一样被正常代谢
- 安全性:
- mRNA药物中的胆固醇含量极微小
- 相比人体内固有胆固醇量可忽略不计
- 对整体胆固醇水平无影响
2. 可电离脂质和PEG
- 设计特点:被工程化设计为可降解
- 降解过程:
- 分解成更小的片段
- 通过正常代谢途径快速清除
- 清除时间:所有片段在几天内完全消除
这确保了LNP载体系统的生物相容性和安全性。
克服先天性免疫屏障
回顾:LNP的作用
- 脂质纳米颗粒(LNP)保护mRNA免于过早降解
- 并将mRNA有效递送到细胞内
最后重大障碍:先天性免疫系统
1. 免疫系统认知误区
- 提到"免疫系统",人们通常想到抗体
- 抗体是血液中识别和中和特定病原体的蛋白质
- 由B细胞产生
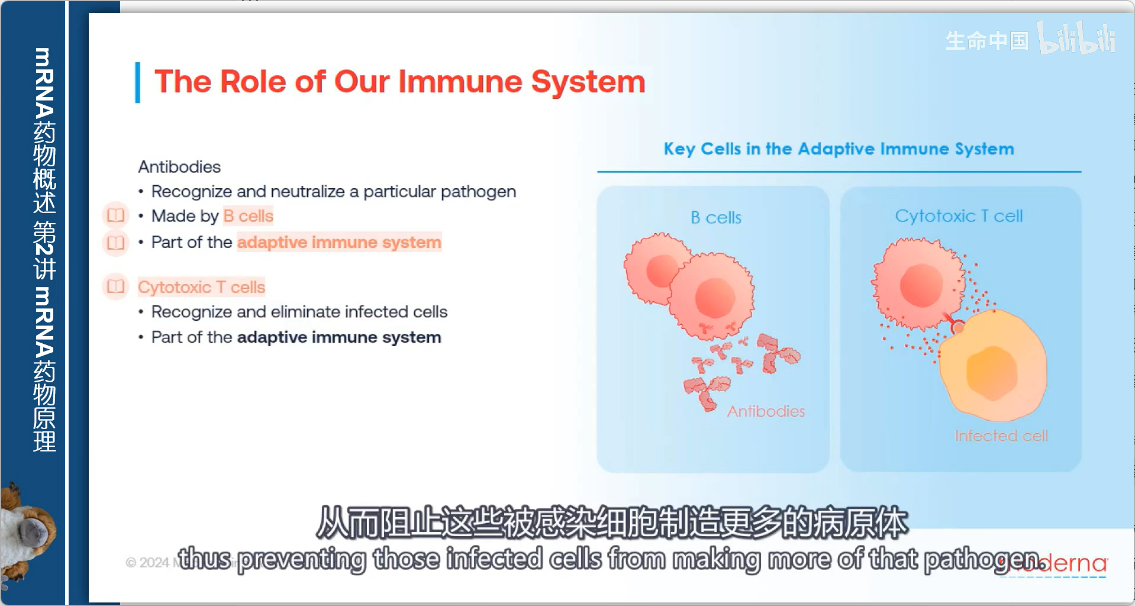
2. 适应性免疫系统
- 组成:
- B细胞:产生抗体
- T细胞:另一关键细胞类型
- 细胞毒性T细胞:识别并清除体内感染或异常细胞
- 疫苗作用机制:利用适应性免疫系统提供针对特定病原体(如SARS-CoV-2)的保护
先天性免疫系统(非特异性免疫):mRNA药物的主要障碍
适应性免疫系统的局限性
1. 功能特点
- B细胞:产生抗体,中和特定病原体
- T细胞:
- 细胞毒性T细胞识别并清除被病原体感染的细胞
- 防止感染细胞产生更多病原体
2. 响应速度限制
- 初次响应:需要数周至数月建立新的适应性免疫反应
- 再次响应:需要数天时间重新激活对既往接触过病原体的免疫
- 结论:对于新出现的病原体,适应性免疫系统响应太慢,不适合作为第一道防线
先天性免疫系统
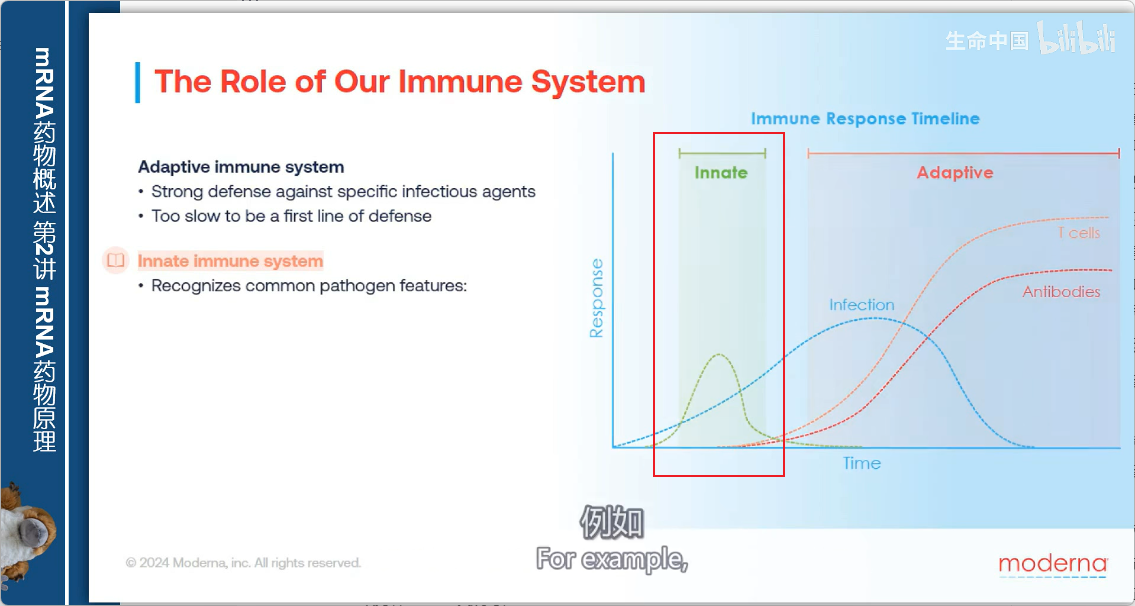
1. 核心功能
- 作为抵御新病原体的第一道防线
- 不识别特定病原体的独特特征
- 识别特定类型病原体的共有特征
2. 识别机制示例
- 细菌识别:
- 许多细菌表面含有脂多糖(LPS)
- 先天性免疫系统持续监测体内LPS
- LPS是细菌入侵的早期预警信号
- 免疫反应:
- 识别LPS后触发炎症警报
- 导致身体疼痛和发烧等症状
病毒RNA的先天性识别
1. RNA病毒特征
- 许多人类病毒以RNA形式携带遗传指令
- 常见例子:冠状病毒、流感病毒、脊髓灰质炎病毒
2. 感染过程与免疫监视
- 进入细胞:通过内吞作用
- RNA释放:从内吞体释放到细胞质
- 不完全效率:部分病毒RNA会滞留在内吞体内
3. 免疫识别原理
- 正常情况:人体自身mRNA在细胞核产生,存在于细胞质,不会出现在内吞体内
- 异常信号:内吞体内的RNA被视为危险信号
- 防御机制:先天性免疫系统有特殊蛋白质传感器,持续监测内吞体内的RNA
克服先天性免疫屏障:mRNA药物的关键突破
内吞体中的RNA识别机制
1. 危险信号识别
- 当传感器检测到内吞体内的RNA时,会假定其具有危险性
- 免疫反应:
- 触发警报信号
- 释放干扰素和细胞因子
- 导致局部炎症和可能的发烧
LNP递送面临的免疫挑战
1. 类似病毒的递送路径
- LNP通过内吞作用将mRNA递送到细胞(与病毒相同)
- mRNA从内吞体释放到细胞质的效率并非100%
- 部分mRNA会滞留在内吞体内
2. 免疫系统误判
- 含有mRNA的LNP可能被先天性免疫系统视为潜在的RNA病毒
- 关键问题:必须学会如何"绕过"内吞体中的先天性免疫传感器
突破策略一:规避单链RNA传感器
1. 关键发现
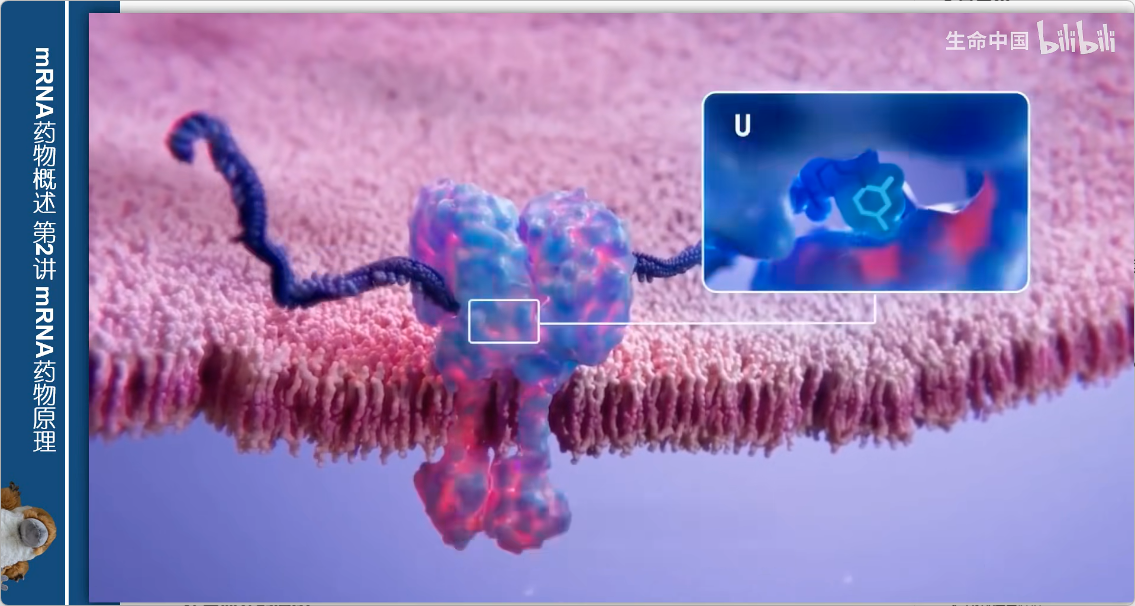
- 2000年代初的研究表明:
- 某些传感器识别的分子特征是RNA核苷酸尿嘧啶(U)
- U结合后会激活传感器,发出危险信号
2. 解决方案
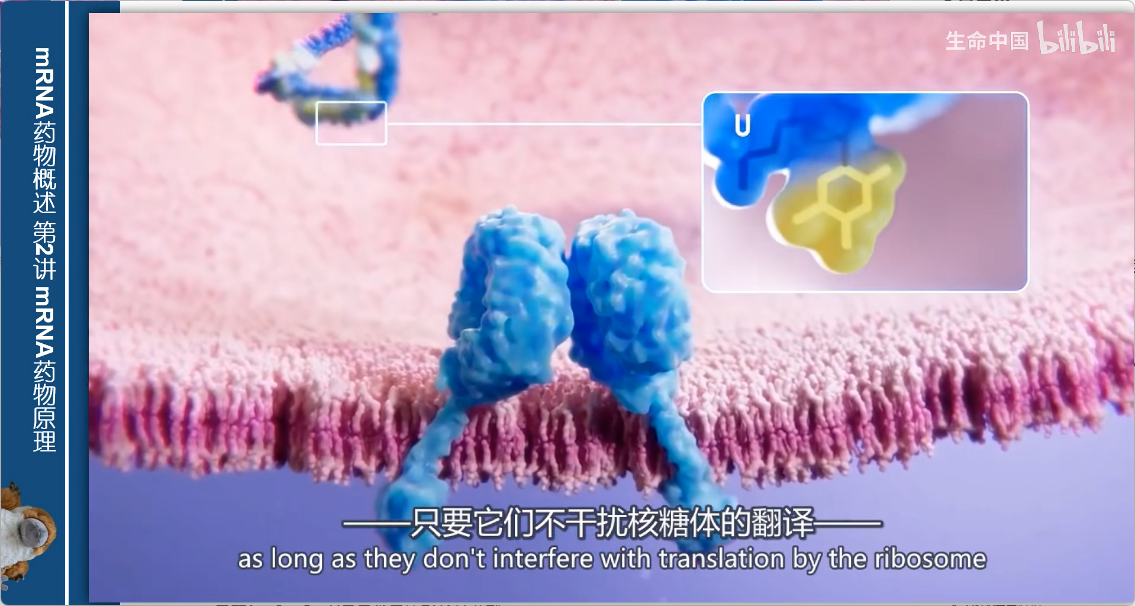
- 使用修饰版的U核苷酸
- 前提:不能干扰核糖体的翻译过程
- 效果:防止传感器在内吞体中识别RNA
3. 自然界的启示

- 尽管A、C、G、U是最常见的RNA核苷酸
- 细胞中存在许多修饰版本
- 自然界已知存在超过100种不同的修饰核苷酸
4. 成功案例
- 1-甲基假尿苷(1-mΨ):
- 人体内自然存在的修饰核苷酸
- 在转录反应中用1-mΨ替代U
- T7 RNA聚合酶会产生全程含1-mΨ的mRNA
- 效果:这种修饰mRNA能够逃避识别病毒RNA的先天性免疫传感器
突破策略二:规避双链RNA传感器
- 存在另一套防御系统,专门监测长段双链RNA
- 与前述传感器一样,这套系统也是为抵御病毒而进化
- 所有RNA病毒复制时都会经历双链RNA阶段
- 人体自身的mRNA主要是单链结构
- 双链RNA在正常细胞中不存在
第二道先天性免疫防线
1. 监测系统
- 另一组先天性免疫传感器同时巡逻:
- 内吞体
- 细胞质
- 监测目标:长段完全碱基配对的双链RNA
2. 免疫反应
- 传感器激活后触发警报信号
- 导致干扰素和细胞因子释放
- 引发炎症反应
生产过程中的挑战

-
意外副产物:使用T7 RNA聚合酶转录mRNA的传统工艺会产生少量双链RNA副产物
-
为制造有效的mRNA药物,必须将双链RNA副产物降至最低:
- 优化转录条件:改变反应参数
- 严格纯化:实施高效的纯化协议






















 515
515

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








