本文内容速览:

流式细胞术(Flow Cytometry,FCM)——一种对高速直线流动的细胞或微小颗粒进行快速、多参数定量分析和分选的技术,这个曾经主要活跃于医学和动物学实验室的高精尖“大佬”,现已强势进军植物圈!然而,将这门技术应用于植物时,研究者却面临着独特的挑战:植物坚韧的细胞壁、丰富的色素、复杂的次生代谢物以及多样的细胞器结构,都为样品的制备与分析设置了重重障碍。随着植物样品解离、细胞核提取及染色方案的不断优化与创新,这些技术壁垒被逐一攻克。如今,流式细胞术已成功穿透植物细胞的“壁垒”,一秒之内,成百上千个植物细胞的老底被摸得一清二楚:是DNA“大户”还是“贫民”?染色体是单倍、双倍还是Plus版?细胞们是在“躺平”(G0/G1期)还是在“搬砖”(S/G2/M期)?今天,就让小远带你一起揭秘,流式细胞术是如何在植物基因功能研究中发挥作用的。
01
流式细胞仪工作原理
流式细胞仪的工作原理如下:利用鞘液(是维持细胞悬液在流式系统中稳定流动与分散的重要成分)让细胞排成单列逐个、高速地通过激光检测点,通过分析细胞产生的散射光和荧光信号,从而对细胞进行多参数定量分析和分选。首先,需要把待检测的植物组织(如叶片)处理成单个细胞(如原生质体)或细胞核的悬液。对于植物来说,这一步通常需要通过酶解或机械研磨来破除坚韧的细胞壁,释放出原生质体或细胞核,经过荧光染料染色后送至检测点。这个时候,一束或多束特定波长的激光被精确地聚焦在细胞流上,每个细胞被激光照射后,会产生多种信号:1)前向散射光(FSC):与细胞的大小和体积相关,细胞越大,阻挡的光越多,FSC信号越强;2)侧向散射光(SSC):与细胞的内部复杂程度(如颗粒度、细胞器多少)相关,细胞内部越复杂,SSC信号越强;3)荧光:荧光的强度和种类反映了细胞的特定生化成分(如DNA含量、特定蛋白质的表达量)。光学收集元件收集分析样品的光信号后将其转化为电信号,通过计算机将该信号进一步放大变成我们可以读懂的数据点,检测的原始数据以规范的FSC数据文件储存在计算机上,通过分析系统进行数据处理和分析。
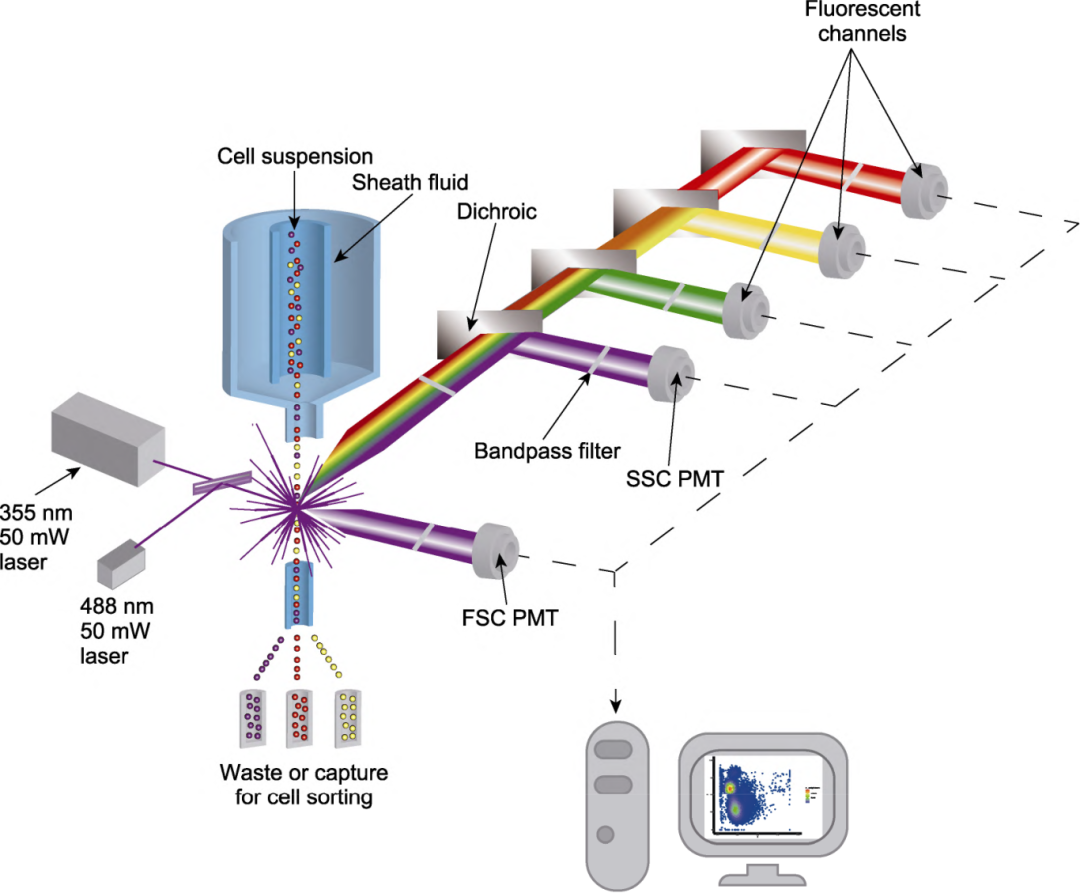
图1 流式细胞仪的基本结构(夏春皎等,2024)。FSC:前向散射光通道;SSC:侧向散射光通道;PMT:光电倍增管。
02
流式细胞术在植物研究中的应用
01
植物细胞核检测
植物细胞核检测主要是测定DNA含量。首先需要将植物组织在细胞核提取液中通过刀片剁碎等方式将细胞核游离出来,过滤之后加入RNase使RNA充分降解,然后加入与DNA特异性结合的荧光染料如PI或DAPI等,再次过滤后上机检测。当细胞核逐个通过流式细胞仪的激光检测区域时,荧光染料被激发并产生荧光信号,可根据荧光强度来测量细胞内DNA的含量,并统计出处于该荧光强度下的细胞核数量,最终,根据荧光强度可分析出植物基因组大小、染色体倍性等,根据细胞核数量可计算出植物的细胞周期有无变化。
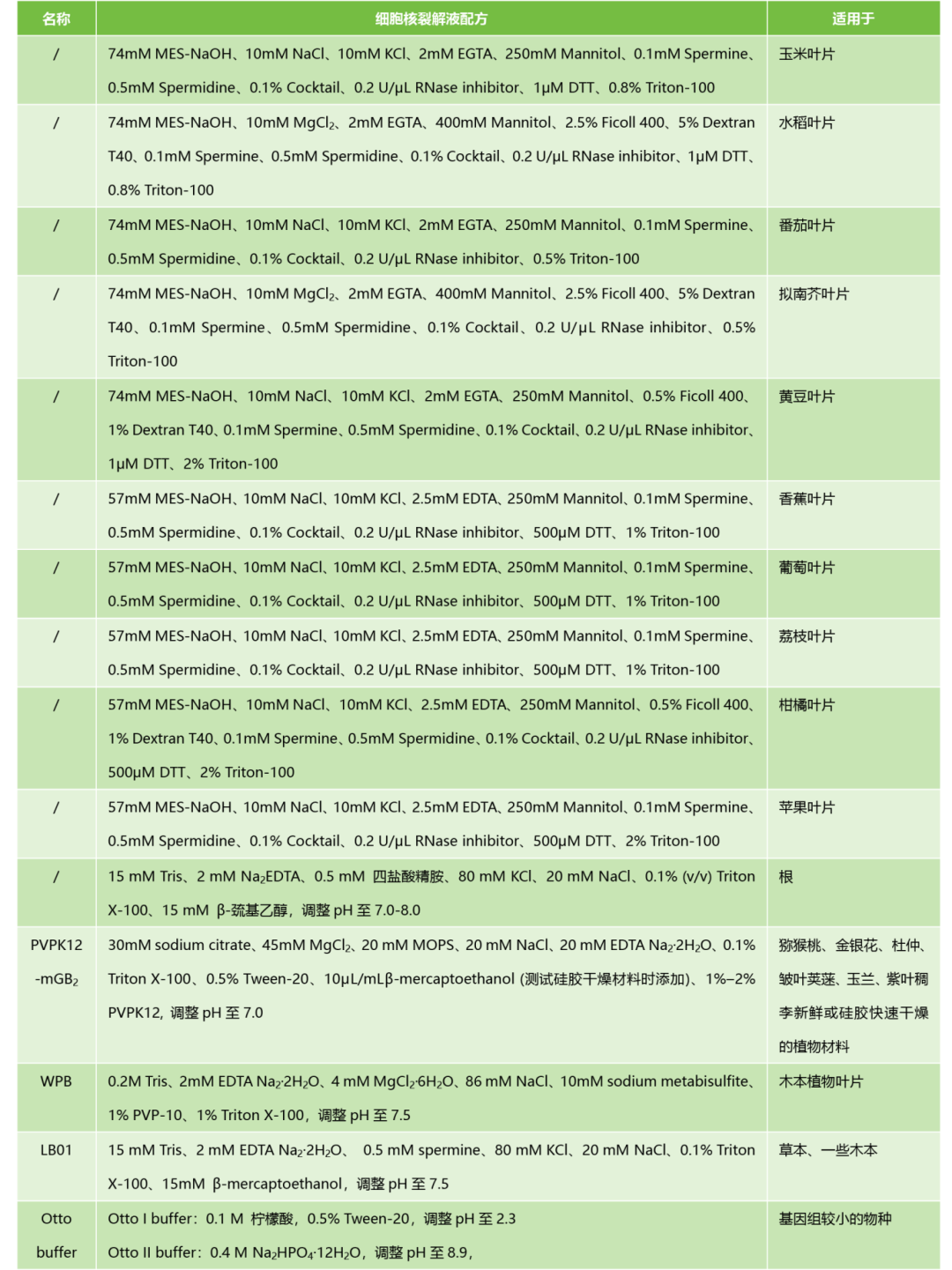
细胞核提取液的选择对能否获得高质量的单细胞悬液至关重要,直接影响了流式细胞检测的结果。植物不同的物种、不同的组织(根、叶和果实等)拥有不同的结构和成分,因此,需要找到最适配的细胞核提取液,小远在这里给大家总结了部分细胞核提取液配方以及适用的对象,大家可作为参考(张晋丹和冯旻, 2023; Liu et al., 2018; Yang et al., 2022)。
表1 细胞核裂解液配方。
02
预估基因组大小(C值)
预估植物基因组大小是流式细胞术在植物学中最经典和最广泛的应用,在物种分类与鉴定、物种进化和育种中具有重要的生物学意义。C值指的是生物体不复制的单倍体细胞核的DNA含量,单位为pg或Mbp(1pg≈978Mbp),因此,处于细胞周期G1期的细胞核具2C DNA,而G2/M期的细胞核具有4C DNA。通过比较待测样品与已知基因组大小的标准品的荧光强度峰值,可以计算出待测样品的基因组大小(C值)。
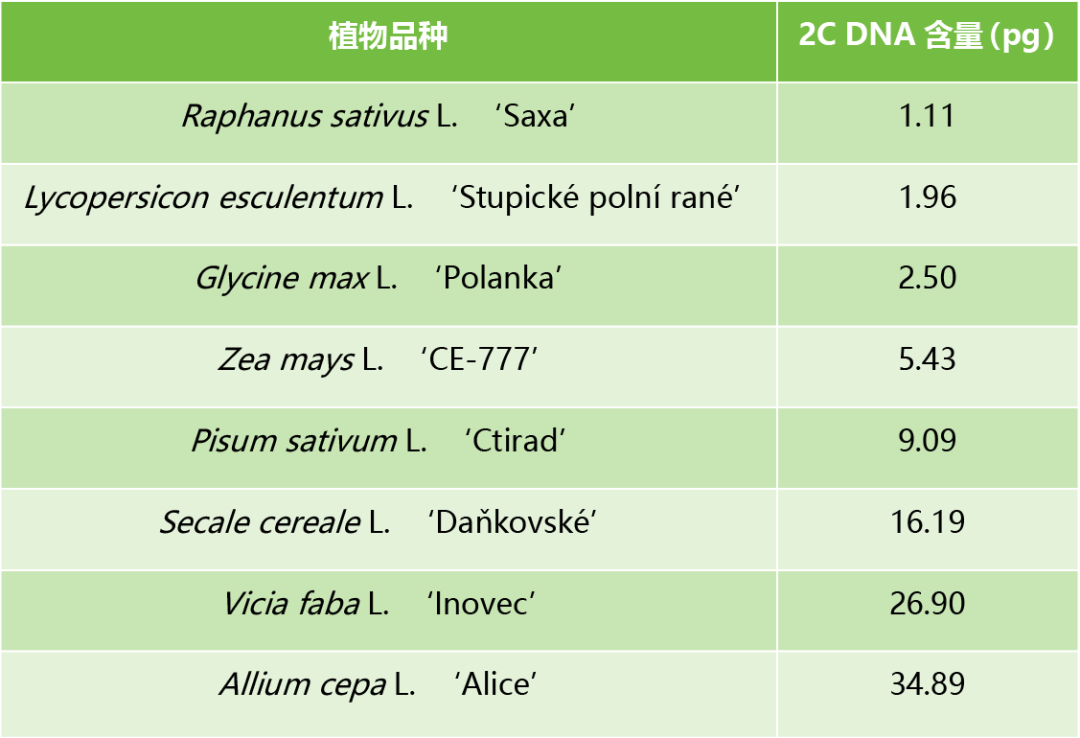
2007年9月,捷克共和国实验植物学研究所Jaroslav Dolezel课题组在Nature Protocols杂志上发表了一篇题为“Estimation of nuclear DNA content in plants using flow cytometry”的研究论文,给出了用于植物基因组大小评估的一套标准,主要包括以下8种植物(表2),该实验室还免费向全球各研究院所提供这套标准的种子。有了这套参考标准,直接代入公式就可以算出目标植物的基因组大小了,公式为:待测植物2C DNA含量(pg)=待测植物G1平均峰值/参考植物G1平均峰值×参考植物2C DNA含量(pg)。
表2 植物基因组大小检测的参考物种及含量(Dolezel et al., 2007)。
2022年9月,中国农业科学研究院作物科学研究所宗旭晓课题组联合中国科学院微生物研究所高胜汉课题组在Nature Genetics杂志上发表了一篇题为“Improved pea reference genome and pan-genome highlight genomic features and evolutionary characteristics”的研究论文,作者进行了豌豆(Pisum sativum L.)品种ZW6的从头基因组组装,并通过流式细胞术以番茄(Lycopersicon esculentum L.)基因组大小为参考标准,预估出豌豆ZW6品种的基因组大小为4.28Gb(图2)。
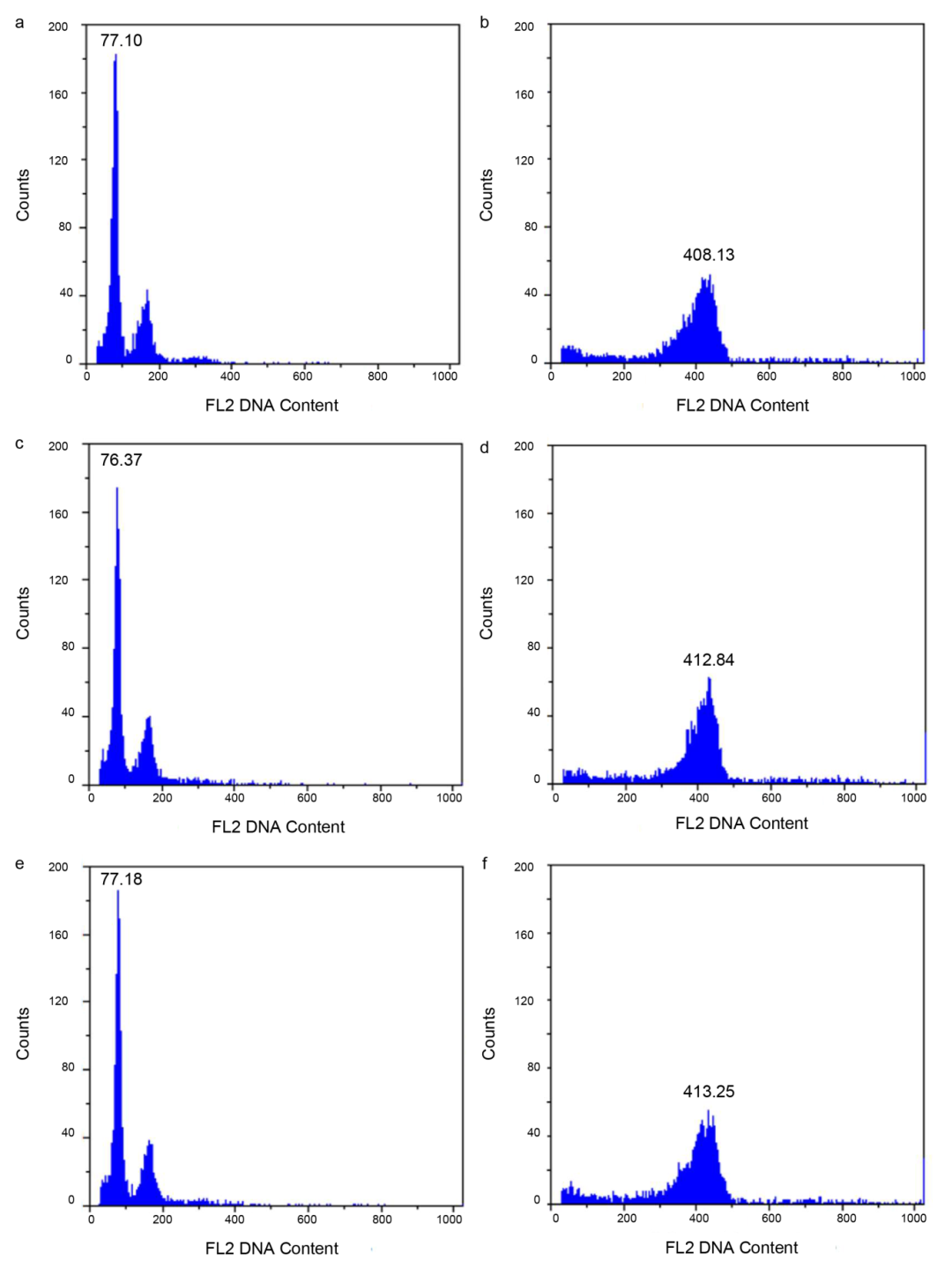
图2 用流式细胞术预估豌豆ZW6不同样品的基因组大小(Yang et al., 2022)。(a、 c、e)标准样品番茄的基因组大小;(b、 d、f)中国豌豆品种ZW6的基因组大小。其中,横坐标表示荧光强度,纵坐标表述处于该荧光强度下的细胞数量。
2025年5月,中南林业科技大学周韬课题组在《分子植物育种》杂志上发表了一篇题为“流式细胞术与基因组Survery分析福建紫薇基因组大小与特征”的研究论文,利用流式细胞术方法,以番茄基因组作为参考,分别检测PI染色后的福建紫薇(Lagerstroemia limii Merr.)与番茄的荧光峰,并计算出福建紫薇的基因组大小为348.16Mb。
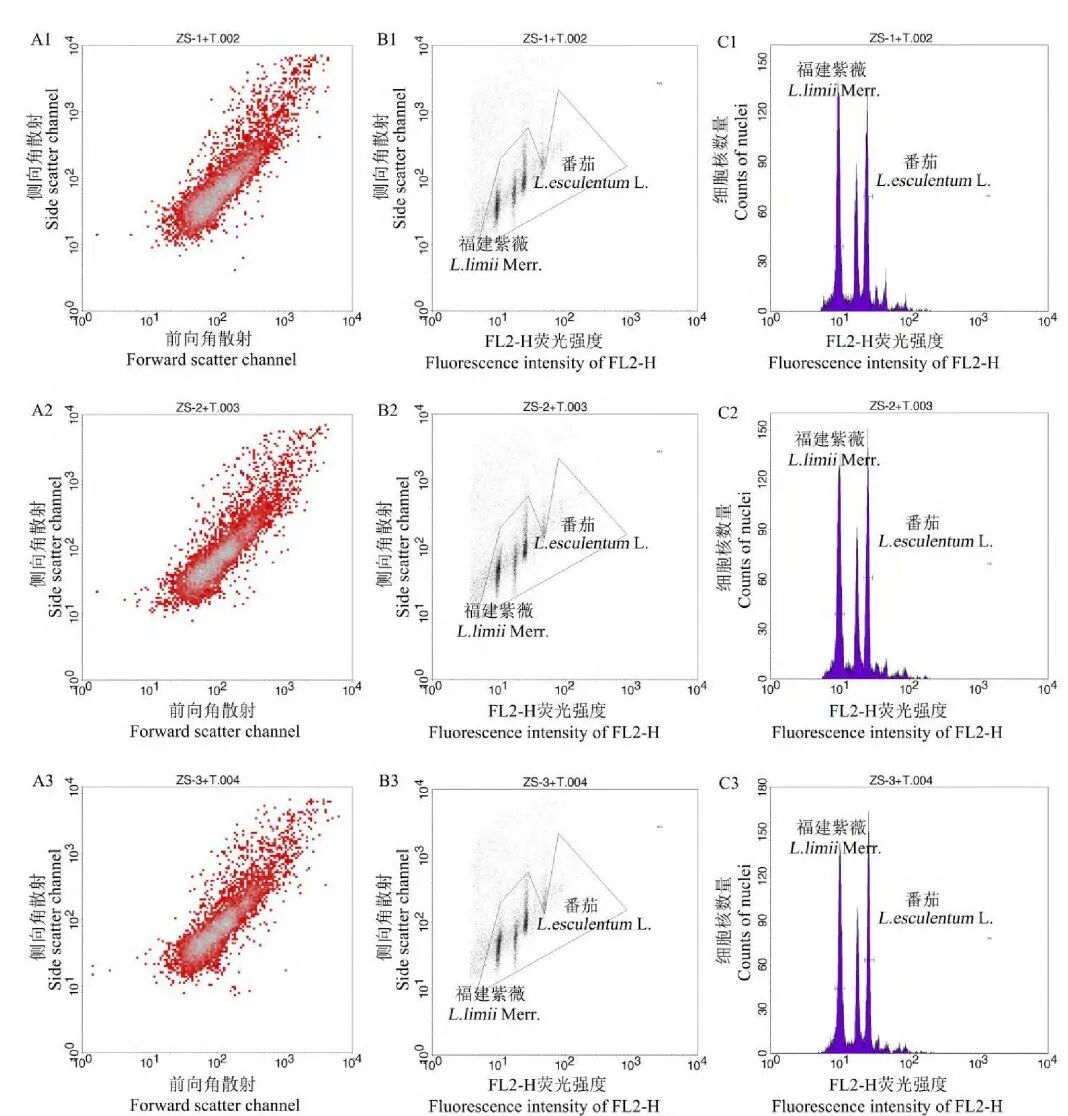
图3 流式细胞仪分析福建紫薇基因组大小(沈植国等,2025)。(A1-A3)福建紫薇和番茄细胞混合悬液FSC-SSC物理参数图;(B1-B3)细胞混合悬液流式散点图;(C1-C3)PI染色效果荧光强度测定峰。
03
植物染色体倍性分析
倍性指的是一个细胞中完整染色体组(即一个基本组 X)出现几套,例如二倍体表示拥有两套完整染色体组(通常用2X表示),四倍体表示拥有四套完整染色体组(通常用4X表示)等。在作物育种中,了解、控制倍性十分重要,倍性状态会直接影响基因表达、配对行为、遗传变异和杂交成功率等。基于DNA含量与荧光强度的线性关系,流式细胞术能够快速且精确地分辨出植物材料中的不同倍性细胞群体(单倍体、二倍体和多倍体),为多倍体育种和遗传稳定性评估提供了关键数据。
2019年1月,中国农业大学宋任涛课题组在The Plant Cell杂志上发表了一篇题为“Maize Dek15 encodes the cohesin-loading complex subunit SCC4 and is essential for chromosome segregation and kernel development”的研究论文,该研究解析出一个编码黏连蛋白loader亚基Sister Chromatid Cohesion Protein 4(SCC4)的基因参与染色体分离和玉米籽粒发育,黏连蛋白主要负责DNA复制完成后姐妹染色单体的黏连,是有丝分裂和减数分裂中保证遗传物质稳定传递到子细胞的关键复合物。作者通过流式细胞术检测12 DAP(day after pollination)和15 DAP下野生型和dek15/scc4突变体胚乳细胞的DNA含量(图4),发现dek15/scc4基因突变后会造成玉米细胞周期和胚乳内复制紊乱,导致大量非整倍体的出现。
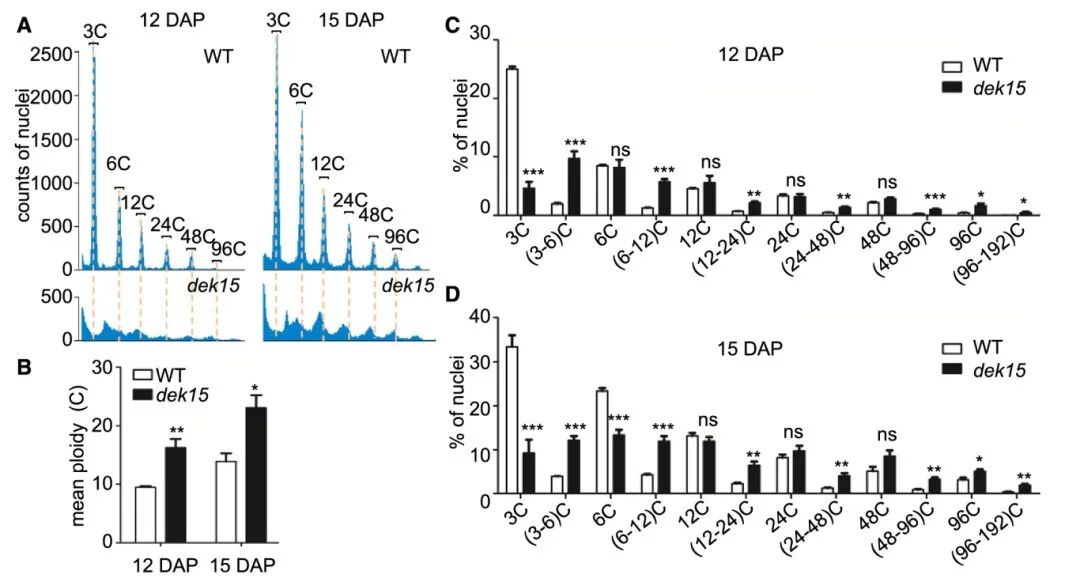
图4 野生型(WT)和dek15/scc4突变体的胚乳细胞在12DAP和15DAP下的流式细胞术(He et al., 2019)。(A)使用流式细胞仪分析野生型和dek15/scc4胚乳在12DAP(左)和15DAP(右)时获得的相对核DNA含量(相对荧光强度)的直方图;(B)野生型和dek15/scc4胚乳在12DAP和15DAP时的平均倍性水平;(C、D)野生型和dek15/scc4胚乳中DNA含量在12DAP和15DAP时的分布。
2023年5月,中国农业大学陈绍江、刘晨旭课题组在Plant Biotechnology Journal杂志上发表了一篇题为“The RUBY reporter enables efficient haploid identification in maize and tomato”的研究论文。该研究首次将RUBY报告基因用于玉米和番茄单倍体的高效鉴别,并通过流式细胞术鉴定植物倍性(图5),为不同作物单倍体鉴别体系创建提供了重要借鉴。

图5 番茄RUBY单倍体诱导系的单倍体鉴定(Wang et al., 2023)。(a)通过识别萌芽胚根的颜色来识别单倍体。列代表母本F1(Alisa Craig × MicroTom)、Alisa Craig和M82,行表示发芽的不同阶段;(b、c)来自F1的假定二倍体,(b)推测的二倍体,(c)推测的单倍体,(d)通过多态性分子标记对假定的单倍体和二倍体进行基因分型。单倍体呈现了F1中的一条带,而二倍体则显示出来自父母双方的两条带。I-III,单倍体;IV,二倍体;V,F1(Alisa Craig × MicroTom);VI,RUBY单倍体诱导系;(e、f)二倍体和单倍体的流式细胞术结果。
备注:更多关于单倍体诱导的研究可查阅文章“青出于蓝-单倍体诱导技术的衍生”、“纯系养成——单倍体诱导技术(二)”。
04
细胞周期检测
前面说到,处于细胞周期G1期的细胞核具2C DNA, 而G2/M期的细胞核具有4C DNA,那么我们就可以通过处于2C和4C荧光强度下的细胞核数量百分比,来判断植物的细胞周期有无变化。
2022年7月,华南农业大学刘耀光课题组在Plant Communications杂志上发表一篇题为“Rice OsUBR7 modulates plant height by regulating histone H2B monoubiquitination and cell proliferation”的研究论文,该研究发现水稻蛋白UBR7具有H2BK148ub E3连接酶功能,并与E2泛素结合酶OsUBC18协调发挥作用,OsUBR7通过介导H2Bub1调控靶基因表达和细胞增殖,因此,作者通过流式细胞术分析WT和osubr7突变体幼苗的细胞周期进程,发现与野生型相比,osubr7突变体G1期细胞数量减少,S和G2/M期细胞数量增多(图6),表明osubr7突变体中细胞周期进程受到抑制。
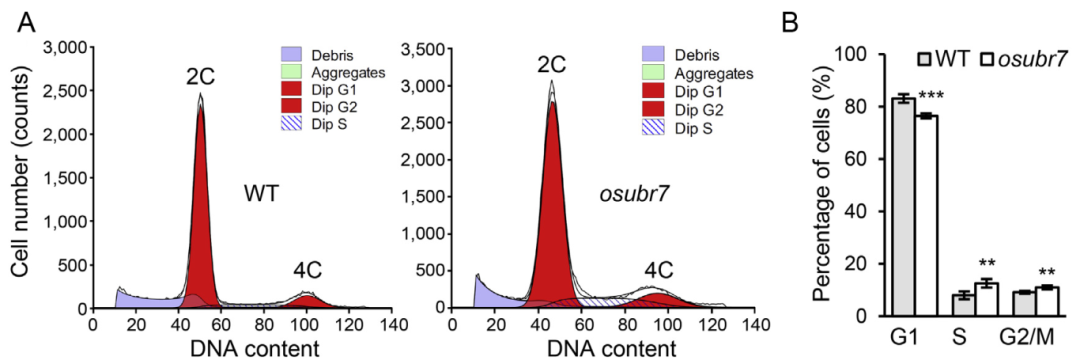
图6 OsUBR7介导H2Bub1导致细胞周期进程受到抑制(Zheng et al., 2022)。(A)通过流式细胞术测量WT和osubr7幼苗(7天龄)中具有2C和4C细胞核的细胞周期阶段的细胞数量;(B)WT和osubr7幼苗中细胞周期不同阶段的细胞百分比。
05
染色体分选
流式细胞仪可以从经过细胞周期同步处理、在中期富集的细胞悬浮液中分选出染色体,所分选的高纯度染色体或片段极大地简化了植物复杂基因组的分析,并为物理图谱构建、遗传学标记开发以及基因定位等方面的研究提供帮助(钱旺等,2021)。
2011年8月,捷克共和国生物技术和农业研究中心Zatloukalová课题组在Chromosome Research杂志上发表了一篇题为“Integration of genetic and physical maps of the chickpea (Cicer arietinum L.) genome using flow-sorted chromosomes”的研究论文,使用流式细胞术分选出鹰嘴豆地方品种WR315的染色体(图7),并且利用流式细胞术分选染色体的DNA,将遗传连锁群分配到特定的染色体上,此外,构建了部分基因组的BAC(bacterial artificial chromosome)文库,对假定的单/低拷贝BAC克隆进行了细胞遗传学定位,还开发出一套有效的细胞遗传标记物,其中2个分子标记可以鉴别染色体E和H(Zatloukalová et al., 2011)。
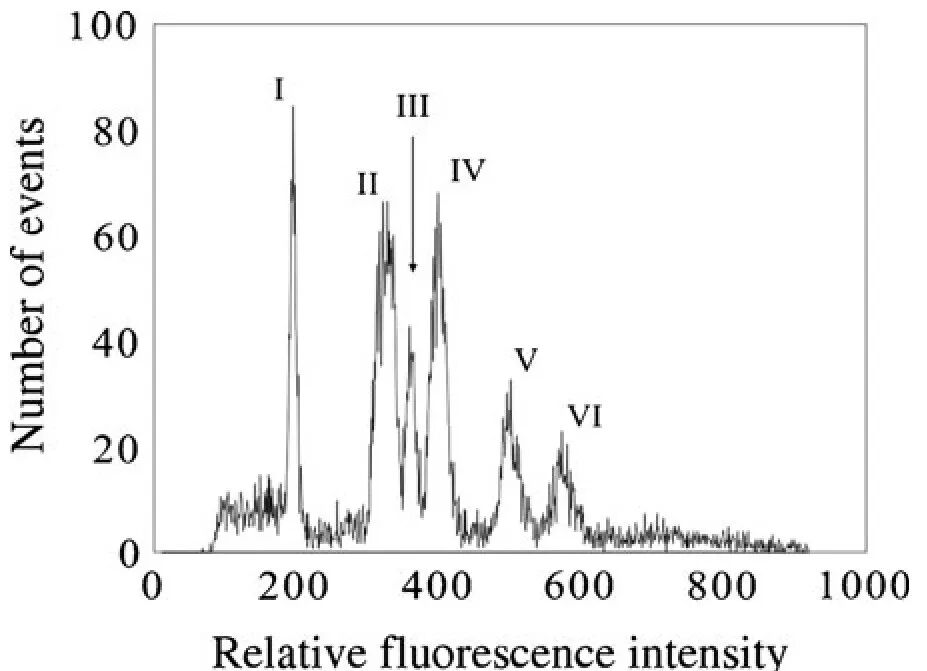
图7 鹰嘴豆WR315的流式核型(Zatloukalová et al., 2011)。有丝分裂染色体经DAPI染色。流式核型包含六个峰,其中峰I、III、V 和 VI 分别代表染色体H、E、B和A,峰II和IV分别代表复合染色体F-G和C-D。
06
植物原生质体检测
6.1
原生质体分选
小远在前面的内容中主要介绍了流式细胞术在细胞核分选与分析中的应用,但该技术同样广泛应用于植物原生质体的分选与分析,而原生质体的分选主要依赖于流式细胞分选技术(Flow-activated Cytometry Sorting,FACS)。
2023年12月,欧洲分子生物学实验室Marcus G. Heisler课题组在Scientific Reports杂志上发表了一篇题为“Global gene regulatory network underlying miR165a in Arabidopsis shoot apical meristem”的研究论文,研究发现,拟南芥中的microRNA165a(miR165a)靶向III类同源结构域亮氨酸-拉链(HD-ZIPIII)转录因子,导致异位器官形成、枝条顶端分生组织(SAM)终止、叶极性丧失和脉管系统发育缺陷。为研究miR165a的基因调控网络,作者使用多通道FACS结合RNA-seq,表征了表达miR165a的细胞类型的全局转录组模式。使用三种荧光标记进行细胞身份鉴定:pAtML1::mTag-BFP-ER(标记所有表皮细胞)、pREV::REV-2YPET(标记HD-ZIPIII区域表达细胞)以及pmiR165a::GFP-ER(标记miR165a区域表达细胞),并通过酶解制备原生质体,随后经流式细胞仪分选得到六个互不重叠的细胞群体(图8)。分选后的原生质体被分别收集、提取RNA并进行转录组测序,揭示了miR165a在SAM不同空间区域的下游调控网络。
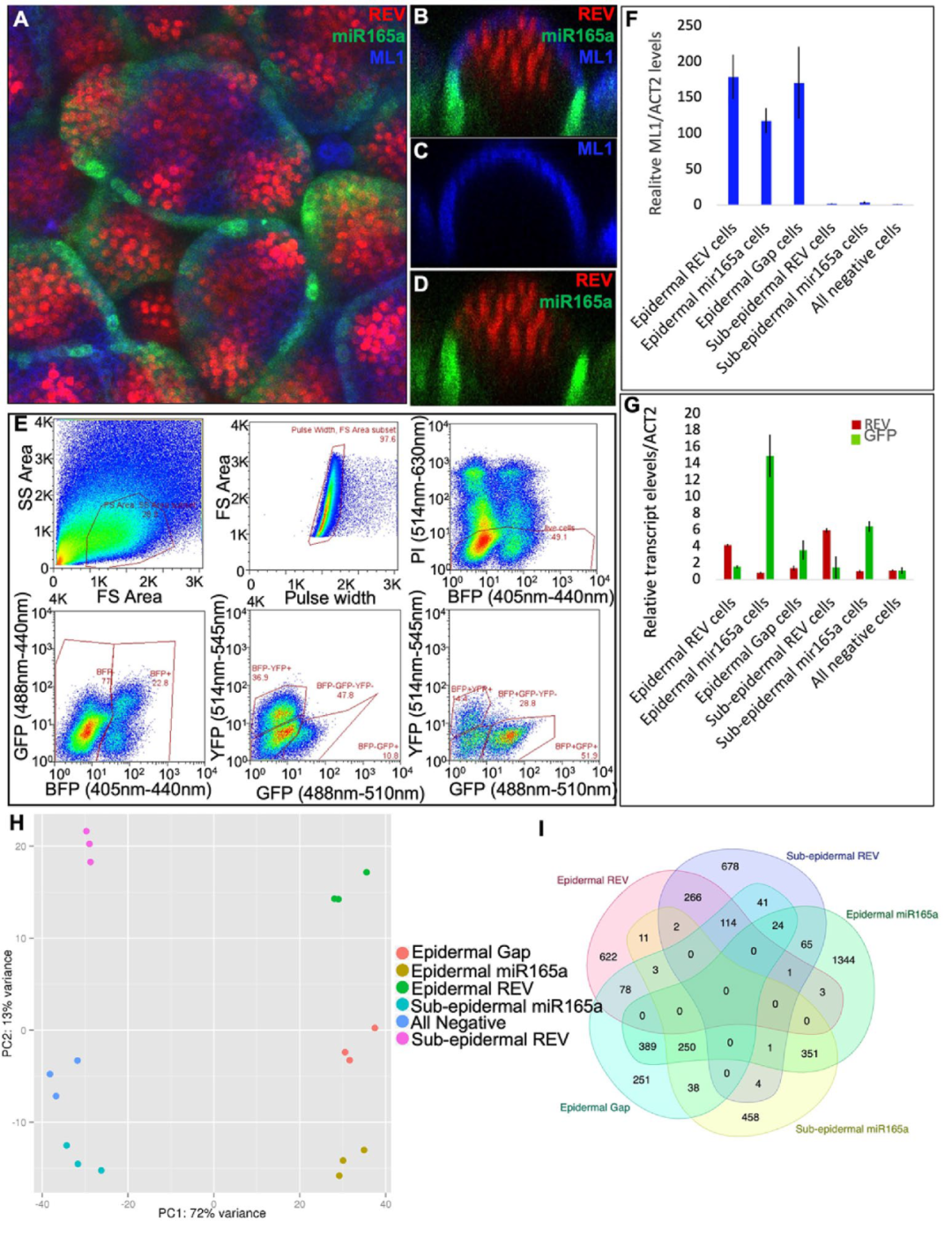
图8 鉴定miR165a SAM结构域中差异表达基因的实验设置(Sinha et al., 2023)。(A-D)ap1cal突变体顶端茎尖分生组织(SAM)中pREV::REV-2YPET(红色)、pmiR165a:GFP-ER(绿色)和pAtML1::mTag-BFP-ER(蓝色)标记物的表达;(E)对原生质体进行流式细胞分选。首先通过前向散射(FSC)和侧向散射(SSC)对总原生质体进行分离,然后通过FSC与Pulse width分析确定所有单体。分析单体原生质体中PI和BFP信号的存在情况。将所有PI阴性原生质体分为BFP阳性和BFP阴性,然后将BFP阳性和BFP阴性原生质体分为YFP阳性、GFP阳性和GFP&YFP阴性;(F)FACS分选原生质体群体中ML1转录水平的Q-PCR分析; (G)对分选出的原生质体群体中REV和GFP转录水平进行qPCR分析;(H)对六组分选的原生质体群体的RNA-seq数据进行主成分分析;(I)特定细胞类型富集基因的重叠分析。
6.2
原生质体的分析
流式细胞术对于原生质体的分析也有着广泛应用,主要用来检测植物体细胞融合情况、原生质体细胞大小、原生质体的生理指标及活性、原生质体内标记物表达和基因表达情况、次生代谢产物分析等。
2023年9月,广西大学农学部李素丽课题组在Plant Physiology and Biochemistry杂志上发表了一篇题为“Integrated flow cytometric and proteomics analyses reveal the regulatory network underlying sugarcane protoplast responses to fusion”的研究论文,作者通过流式细胞仪检测甘蔗品种ROC22和GT28原生质体融合前后的情况。融合前GT28和ROC22的原生质体分别用罗丹明(R-6G)和二乙酸荧光素(FDA)标记,一共扫描到549569个融合的杂合细胞,融合率为1.95%(图9),融合杂合细胞的平均体积(FSC值)比ROC22高1.17倍,比GT28原生质体高1.32倍(图10A、B),细胞内颗粒密度(SSC值)比ROC22原生质体高1.31倍,比GT28原生质体高1.47倍(图10C、D)。
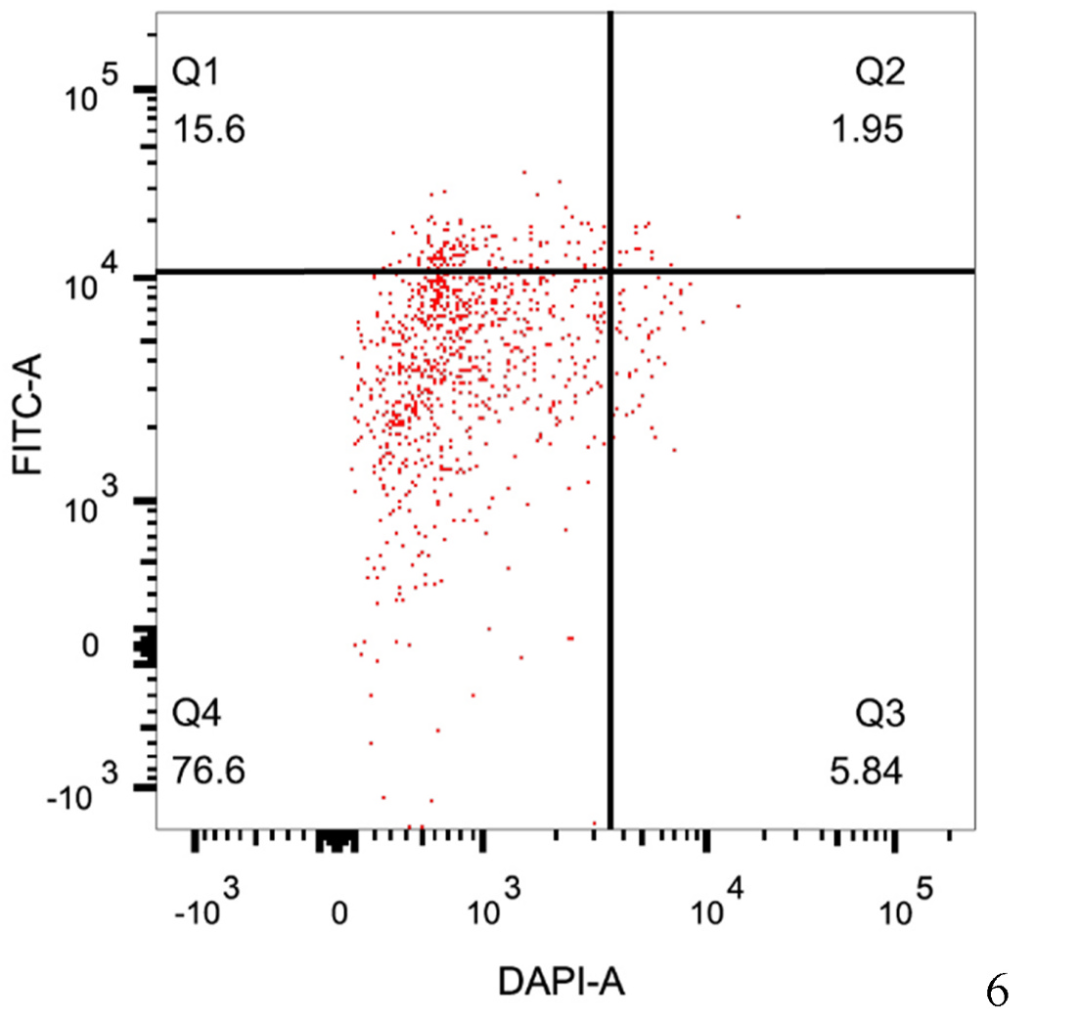
图9 杂合细胞的流式细胞分选(Wang et al., 2023)。(Q1)仅用绿色荧光染色的细胞;(Q2)杂合细胞(双阳性);(Q3)单染蓝色荧光的细胞;(Q4)未染色细胞(双阴性)。
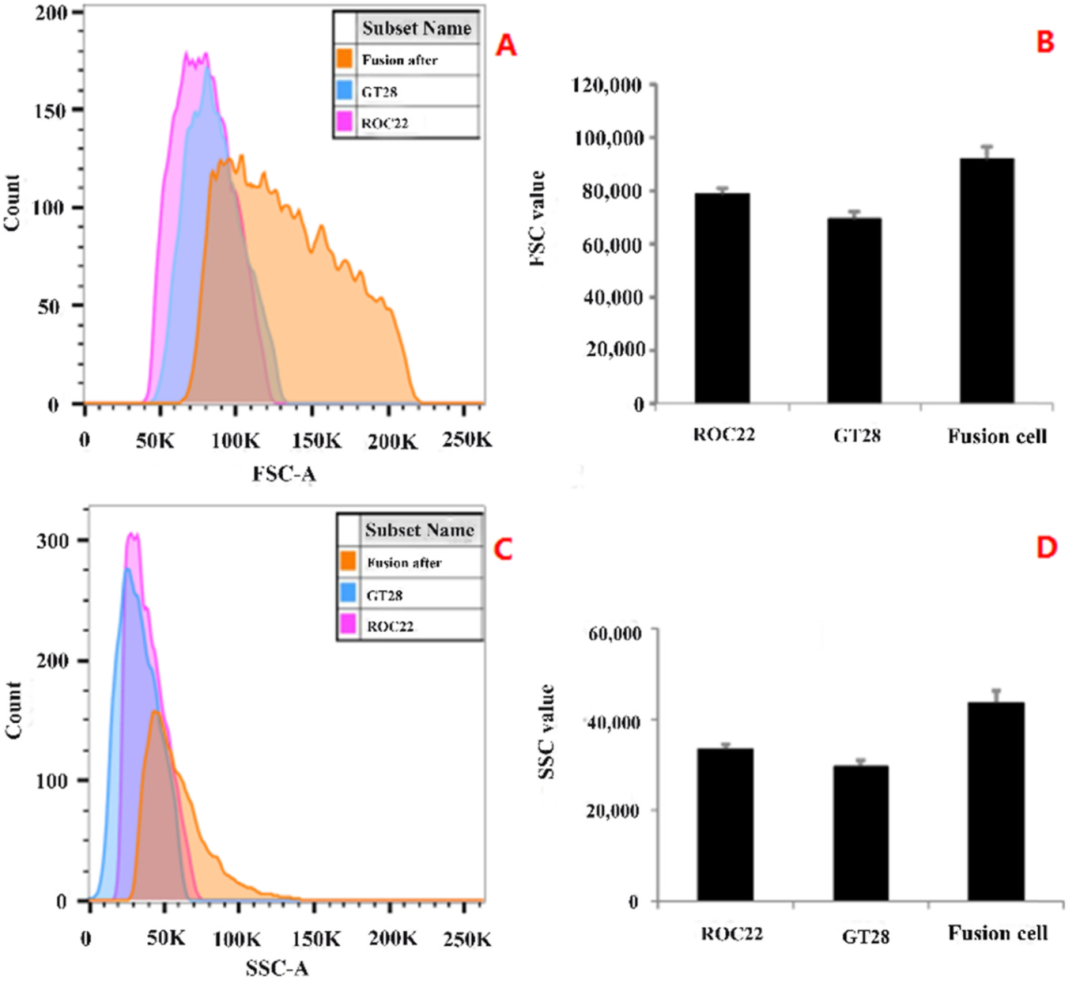
图10 流式细胞术检测细胞体积和细胞内颗粒密度(Wang et al., 2023)。(A)流式细胞术评估的FSC值;(B)FSC值的直方图;(C)流式细胞术评估的SSC值;(D)SSC值的直方图。
07
花粉活力分析
花粉活力是决定植物有性繁殖效率和结实率的关键因素之一,因此在作物育种、环境胁迫响应研究以及花粉储存与利用中都需要对花粉活力进行准确评估。传统的检测方法,如花粉萌发实验或活力染色(例如TTC、FDA染色),虽然直观,但存在通量低、操作耗时、主观性强、难以区分花粉亚群体等局限。因此,在需要快速处理大规模样本或分析花粉在胁迫条件下动态变化的应用场景中,传统方法的这些局限显得尤为突出。而通过引入流式细胞术结合荧光探针(如H2DCFDA)的方法,为解决上述问题提供了新的思路。
2019年2月,以色列巴伊兰大学Gad Miller课题组在The Plant Journal杂志上发表了一篇题为“Direct analysis of pollen fitness by flow cytometry: implications for pollen response to stress”的研究论文,作者利用H2DCFDA探针标记拟南芥和番茄成熟花粉内的活性氧(ROS),只有具有活力的花粉才能产生足够的ROS来氧化H2DCFDA,并通过流式细胞术快速区分花粉中低ROS与高ROS两个亚群体(图11)。进一步的分选与萌发实验表明,高ROS花粉的萌发能力显著优于低ROS花粉,从而验证了该指标的可靠性(Luria et al., 2019)。
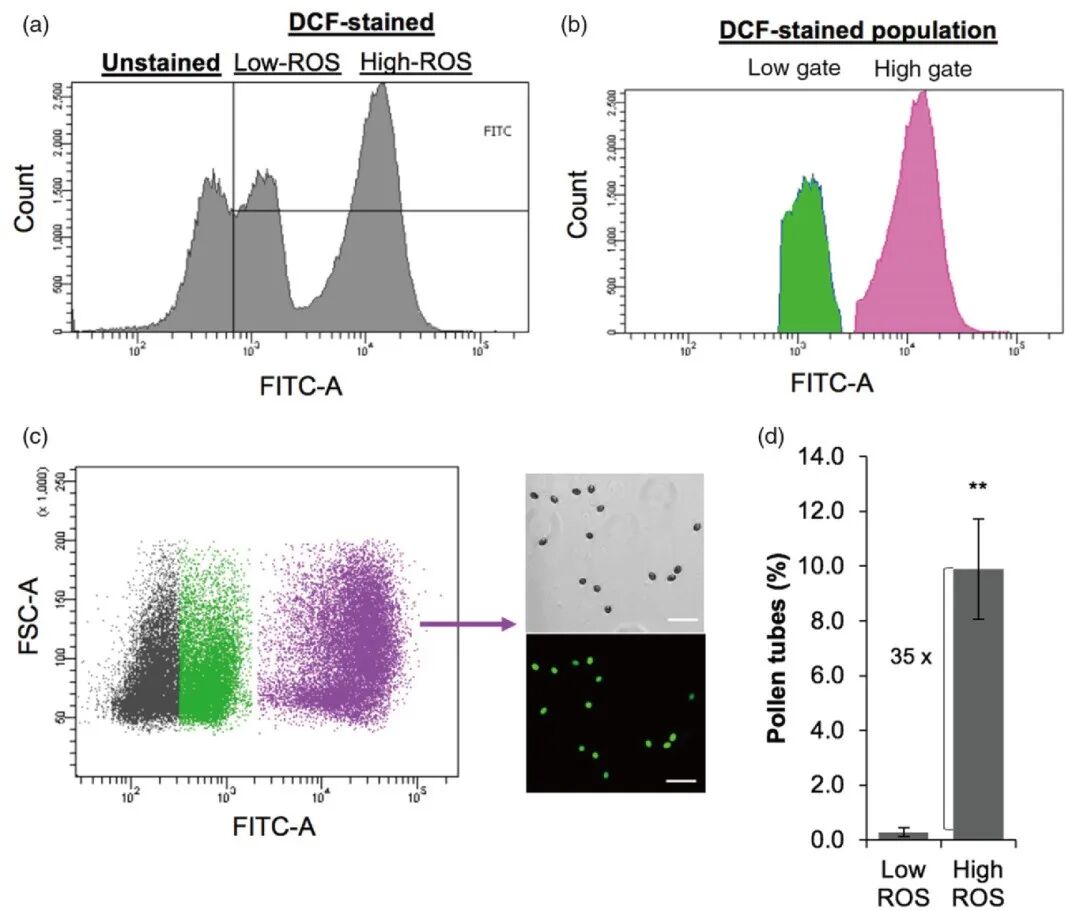
图11 对低反应性和高反应性活性氧(ROS)亚群进行分类,揭示了花粉萌发能力的差异(Luria et al., 2019)。(a)根据经验为低和高二氯荧光素(DCF)染色花粉设门;(b)通过流式细胞术分选(FACS)将花粉分为低(绿色)和高(粉色)DCF强度亚群;(c)分选后使用显微镜确定门控的准确性,并给出了纯化后高ROS的GFP和明场代表性图像示例;(d)低ROS和高ROS花粉的萌发率。
08
细胞凋亡检测
动植物细胞在某些发育阶段或者受到外界刺激时会发生细胞程序性死亡(PCD),这个时候细胞会发生一些形态和生化方面的变化,包括DNA片段化、类半胱天冬酶的激活以及细胞色素c从线粒体释放。PCD早期的时候膜磷脂发生外翻导致磷脂酰丝氨酸(PS)暴露于质膜外表面,Anexim-V作为一种磷脂结合蛋白能特异性结合PS,而7-AAD核酸染料可以进入细胞膜受损的细胞去结合DNA,通过流式细胞仪进行高通量定量分析,可根据荧光强度变化区分活细胞、早期PCD细胞和晚期PCD细胞,从而准确反映植物细胞死亡的动态过程。
2016年5月,东北林业大学唐中华课题组在Frontiers in Plant Science杂志上发表了一篇题为“Ethylene antagonizes salt-Induced growth retardation and cell death process via transcriptional controlling of ethylene-, BAG- and senescence-associated genes in Arabidopsis”的研究论文,作者为了探究乙烯是否参与调节盐诱导的细胞死亡以介导植物耐盐性,使用流式细胞术对拟南芥乙烯信号突变体(ein2-5、ein3-1和ctr1-1)在盐胁迫下的叶片原生质体进行PCD进程的检测(图12)。结果表明,乙烯不敏感突变体(ein2-5和ein3-1)更容易受到盐胁迫的影响,并且其PCD过程在NaCl处理下加速。
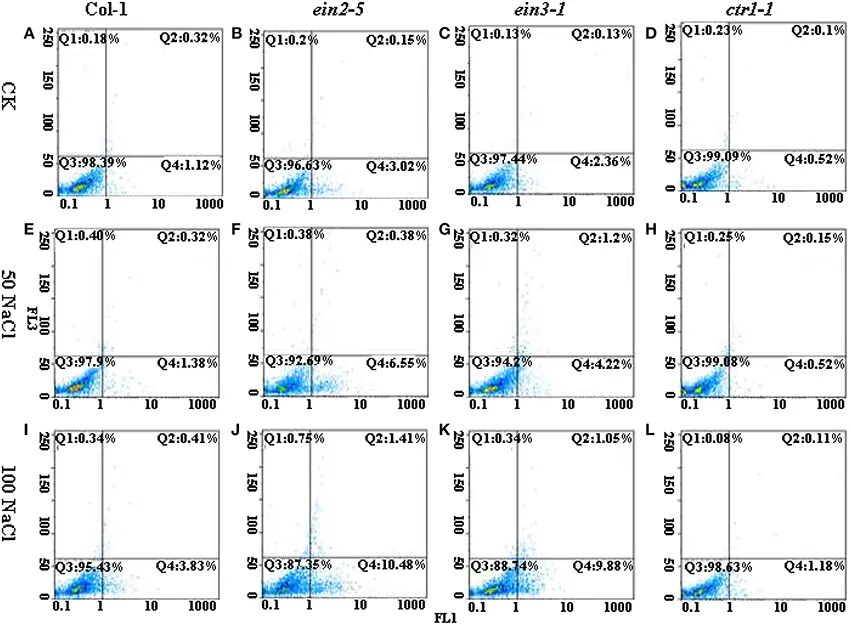
图12 对照或盐胁迫条件下拟南芥四个株系中程序性细胞死亡(PCD)发生的流式细胞术图像(Pan et al., 2016)。Q4区表示早期PCD细胞;Q2区表示晚期PCD细胞;Q3区表示完整细胞。
09
钙离子(Ca2+)浓度检测
钙离子(Ca2+)是植物细胞内重要的第二信使,参与多种生理和胁迫响应过程。早期植物钙信号的检测主要依赖于化学比色法、电极法以及利用荧光探针结合荧光显微镜或共聚焦显微镜成像的方式。这些方法能够提供Ca2+在特定细胞或组织中的分布信息,但通常通量较低,数据受人为操作和图像分析影响较大,难以在大样本量条件下获得可靠的定量结果。利用流式细胞术结合荧光钙探针(如Fluo-3 AM和Fluo-4 AM)能够实现对单细胞水平Ca2+信号的高通量、定量检测。该类探针为脂溶性的乙酰氧甲酯(AM)封闭形式,能够自由穿透细胞膜进入细胞内,在细胞内,酯酶会切除其AM基团,使探针转变为带电、亲水的活性形式并被固定在细胞质中,当探针与游离的Ca2+结合后,其荧光强度显著增强,荧光信号的强弱与细胞内游离Ca2+浓度呈正相关。
2023年5月,天津师范大学杨琳课题组在Plants杂志上发表了一篇题为“New insight into the function of dopamine (DA) during Cd stress in Duckweed (Lemna turionifera 5511)”的研究论文,作者为了探究多巴胺(Dopamine,DA)是否通过调控细胞内Ca2+信号来增强浮萍在镉(Cd)胁迫下的抗性机制,采用流式细胞仪测定了浮萍细胞内游离Ca2+的变化情况。将不同条件处理后的浮萍提取原生质体,并采用Fluo-3 AM荧光探针进行染色后上机检测。
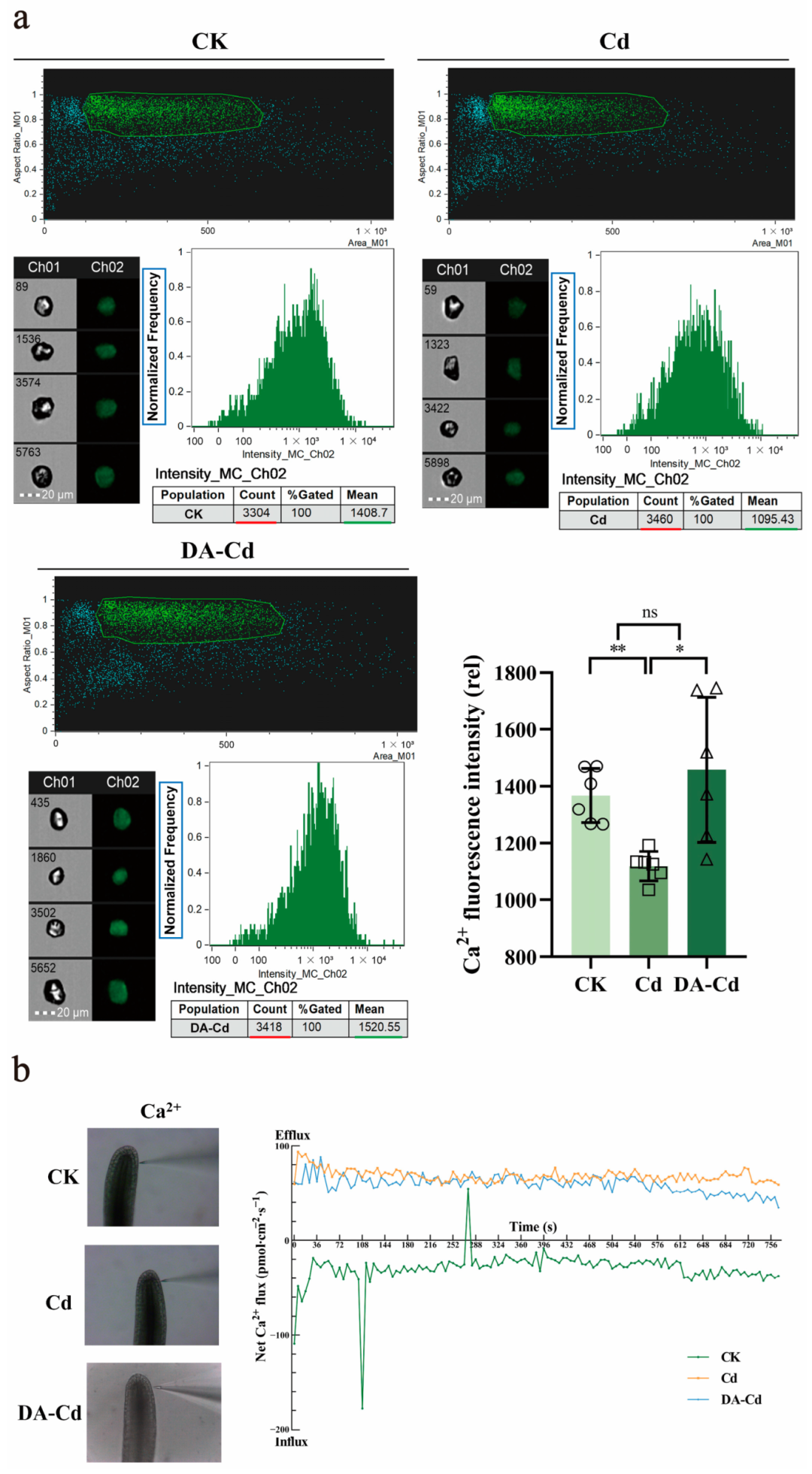
图13 使用流式细胞术检测原生质体的Ca²⁺荧光强度(Wang et al., 2023)。明场为Ch01,而488 nm激发光为Ch02。选择绿色框的原生质体来分析荧光强度。
流式细胞术已成为植物研究的重要工具,不仅在基因组大小测定、倍性分析、细胞周期检测、细胞分选和荧光检测等方面展现出优势,还为解析植物的遗传和生理机制提供了新思路。尽管其在空间分辨率和形态信息获取上仍有不足,但随着前处理技术优化、荧光探针改进以及与显微成像、单细胞与空间组学的融合,流式细胞术必将在植物发育研究、抗逆机制解析和种质创新中发挥更加重要的作用。
References:
钱旺,王秋松,杨善,等.染色体分选技术在植物学研究中的应用[J].热带亚热带植物学报,2021,29(02):221-228.
沈植国,丁鑫,李留振,李红伟,周韬.流式细胞术与基因组Survery分析福建紫薇基因组大小与特征[J].分子植物育种, 1-17.
夏春皎,李运广,夏姝,等.植物基因组学中的流式细胞分析及分选技术[J].植物学报,2024,59(05):774-782.
张晋丹,冯旻.一种提升流式细胞术分析效果的前处理方法[J].植物学报,2023,58(02):285-297.
Dolezel, J., Greilhuber, J., & Suda, J. (2007). Estimation of nuclear DNA content in plants using flow cytometry. Nature protocols, 2(9), 2233–2244.
He, Y., Wang, J., Qi, W., & Song, R. (2019). Maize Dek15 Encodes the Cohesin-Loading Complex Subunit SCC4 and Is Essential for Chromosome Segregation and Kernel Development. The Plant cell, 31(2), 465–485.
Liu, J. H., Li, Y. B. and Xiong, L.Z. (2018). Detection of Nuclear Ploidy by Flow Cytometry. Bio-101:e1010143.
Luria, G., Rutley, N., Lazar, I., Harper, J. F., & Miller, G. (2019). Direct analysis of pollen fitness by flow cytometry: implications for pollen response to stress. The Plant journal, 98(5), 942–952.
Pan, Y. J., Liu, L., Lin, Y. C., Zu, Y. G., Li, L. P., & Tang, Z. H. (2016). Ethylene Antagonizes Salt-Induced Growth Retardation and Cell Death Process via Transcriptional Controlling of Ethylene-, BAG- and Senescence-Associated Genes in Arabidopsis. Frontiers in plant science, 7, 696.
Sinha, S., Sahadevan, S., Ohno, C., Ram, H., & Heisler, M. G. (2023). Global gene regulatory network underlying miR165a in Arabidopsis shoot apical meristem. Scientific reports, 13(1), 22258.
Wang, R., Li, X., Zhu, S., Zhang, D., Han, S., Li, Z., Lu, J., Chu, H., Xiao, J., & Li, S. (2023). Integrated flow cytometric and proteomics analyses reveal the regulatory network underlying sugarcane protoplast responses to fusion. Plant physiology and biochemistry: PPB, 202, 107918.
Wang, D., Zhong, Y., Feng, B., Qi, X., Yan, T., Liu, J., Guo, S., Wang, Y., Liu, Z., Cheng, D., Zhang, Y., Shi, Y., Zhang, S., Pan, R., Liu, C., & Chen, S. (2023). The RUBY reporter enables efficient haploid identification in maize and tomato. Plant biotechnology journal, 21(8), 1707–1715.
Wang, W., Yang, Y., Ma, X., He, Y., Ren, Q., Huang, Y., Wang, J., Xue, Y., Yang, R., Guo, Y., Sun, J., Yang, L., & Sun, Z. (2023). New Insight into the Function of Dopamine (DA) during Cd Stress in Duckweed (Lemna turionifera 5511). Plants (Basel, Switzerland), 12(10), 1996.
Yang, T., Liu, R., Luo, Y., Hu, S., Wang, D., Wang, C., Pandey, M. K., Ge, S., Xu, Q., Li, N., Li, G., Huang, Y., Saxena, R. K., Ji, Y., Li, M., Yan, X., He, Y., Liu, Y., Wang, X., Xiang, C., … Zong, X. (2022). Improved pea reference genome and pan-genome highlight genomic features and evolutionary characteristics. Nature genetics, 54(10), 1553–1563.
Yang, M. C., Wu, Z. C., Huang, L. L., Abbas, F., & Wang, H. C. (2022). Systematic Methods for Isolating High Purity Nuclei from Ten Important Plants for Omics Interrogation. Cells, 11(23), 3919.
Zatloukalová, P., Hřibová, E., Kubaláková, M., Suchánková, P., Simková, H., Adoración, C., Kahl, G., Millán, T., & Doležel, J. (2011). Integration of genetic and physical maps of the chickpea (Cicer arietinum L.) genome using flow-sorted chromosomes. Chromosome research,19(6), 729–739.
Zheng, Y., Zhang, S., Luo, Y., Li, F., Tan, J., Wang, B., Zhao, Z., Lin, H., Zhang, T., Liu, J., Liu, X., Guo, J., Xie, X., Chen, L., Liu, Y. G., & Chu, Z. (2022). Rice OsUBR7 modulates plant height by regulating histone H2B monoubiquitination and cell proliferation. Plant communications, 3(6), 100412.
 流式细胞术解锁植物细胞奥秘
流式细胞术解锁植物细胞奥秘





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








